A savállandó meghatározása
Kétségtelenül tisztában vagy azzal, hogy egyes savak erősebbek, mint mások. A különböző vegyületek vagy funkciós csoportok relatív savasságát – más szóval a különböző vegyületek relatív képességét arra, hogy azonos körülmények között egy közös bázisnak protont adjanak – a savassági állandónak nevezett számmal, rövidítve \(K_a\), számszerűsíthetjük. Az összehasonlításhoz választott közös bázis a víz.
Első példaként az ecetsavat tekintjük. Ha vízben hígított ecetsavoldatot készítünk, sav-bázis reakció játszódik le a sav (protondonor) és a víz (protonakceptor) között.

Az ecetsav gyenge sav, így az egyensúly a reakcióalanyoknak kedvez a termékekkel szemben – termodinamikailag “felfelé halad”. Ezt a fenti ábrán az előre- és hátrafelé mutató reakciónyilak relatív hossza jelzi.
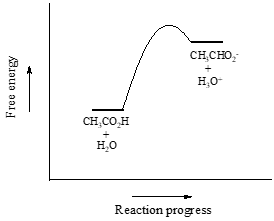
Az \(K_{eq}\) egyensúlyi állandó a következőképpen van definiálva:
\}{}{} = \frac{}{}\\]
Ne feledjük, hogy híg vizes oldatról van szó: kis mennyiségű ecetsavat adtunk nagy mennyiségű vízhez. Ezért a reakció során a víz koncentrációja (kb. 55,6 mol/L) nagyon keveset változik, és konstansként kezelhető.
Ha a víz koncentrációjára vonatkozó konstans kifejezést áthelyezzük az egyensúlyi állandó kifejezés bal oldalára, akkor megkapjuk az \(K_a\), az ecetsav savállandójára vonatkozó kifejezést:
\ = \frac{}{}\]
Az adott sav HA vagy HB+ disszociációs állandója általánosabban a következőképpen fejezhető ki:
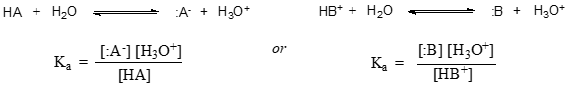
Az ecetsav \(K_a\) értéke \(1.75 \szer 10^{-5}\) – sokkal kisebb, mint \(1\), ami azt jelzi, hogy egyensúlyban sokkal több ecetsav van az oldatban, mint acetát és hidróniumion.
Ezzel szemben a kénsav, amelynek \(K_a\) értéke körülbelül \(10^9\), vagy a sósav, amelynek \(K_a\) értéke körülbelül \(10^7\), mindkettő lényegében teljes disszociáción megy keresztül vízben: ezek nagyon erős savak.
Egy olyan számot, mint az \(1,75 \szer 10^{- 5}\) nem túl könnyű sem kimondani, sem megjegyezni, sem szemléltetni, ezért a kémikusok általában egy kényelmesebb kifejezést használnak a relatív savasság kifejezésére. Egy sav \(pK_a\) értéke egyszerűen az \(K_a\) értékének logaritmusa (bázis 10).
\
A matematikát elvégezve azt találjuk, hogy az ecetsav \(pK_a\) értéke \(4,8\). A kénsav \(pK_a\) értéke -10, a sósavé pedig -7. Az \(pK_a\) értékek használata lehetővé teszi, hogy a gyakori vegyületek és funkciós csoportok relatív savasságát egy körülbelül -10 (nagyon erős sav) és 50 (egyáltalán nem savas vegyület) közötti számskálán fejezzük ki. Minél alacsonyabb az \(pK_a\)-érték, annál erősebb a sav.
A biológiai szerves kémia szempontjából fontos ionizálható (protonadományozó vagy -elfogadó) funkciós csoportok \(pK_a\)-értékei általában 5 és 20 között mozognak. Ezek közül a legfontosabbakat az alábbiakban foglaljuk össze, a konjugált savas formák nagyon durva \(pK_a\)-értékeivel. További savas csoportok, amelyek \(pK_a\) értékei közel vannak a nullához, szintén szerepelnek a referenciaként.
Típusos \(pK_a\) értékek
| csoport | közelítő \(pK_a\) |
|---|---|
| hidróniaion | 0 |
| protonált alkohol | 0 |
| protonált karbonil | 0 |
| karbonsavak | 5 |
| protonált iminek | 7 |
| protonált aminok. | 10 |
| fenolok | 10 |
| tiolok | 10 |
| alkoholok, víz | 15 |
| \(\alfa\)-szénsavak * | 20 |
*\(\alfa\)-szénsavakat a 7. fejezetben ismertetjük.6A
Ezeket a durva értékeket nagyon ajánlott most megjegyezni – aztán ha pontosabb értékre van szükségünk, bármikor utánanézhetünk egy teljesebb \(pK_a\) táblázatban. A könyv függeléke tartalmaz egy részletesebb táblázatot a tipikus \(pK_a\)-értékekről, és sokkal teljesebb táblázatok találhatók olyan forrásokban, mint például a Handbook of Chemistry and Physics.
\(pK_a\) vs. \(pH\)
Fontos tisztában lenni azzal, hogy a \(pK_a\) nem ugyanaz, mint a \(pH\): az előbbi egy vegyület vagy funkciós csoport inherens tulajdonsága, míg az utóbbi egy adott vizes oldatban a hidróniumion-koncentráció mérőszáma:
\\\]
Az \(pK_a\) értékek ismerete nemcsak a savak erősségének összehasonlítását teszi lehetővé, hanem a bázisok erősségének összehasonlítását is. A legfontosabb gondolat, amit nem szabad elfelejteni, a következő: minél erősebb a konjugált sav, annál gyengébb a konjugált bázis. Megállapíthatjuk, hogy a hidroxidion erősebb bázis, mint az ammónia (\(NH_3\)), mivel az ammóniumion (\(NH4^+\), \(pK_a = 9.2\)) erősebb sav, mint a víz (\(pK_a = 15.7\)).
gyakorlat \(\PageIndex{1}\)
Melyik az erősebb bázis, a \(CH_3O^-\) vagy a \(CH_3S^-\)? Az acetátion vagy az ammónia? Hidroxidion vagy acetátion?
Az \(pK_a\) fogalmának megértését alkalmazzuk egy összetettebb molekula kontextusában. Mekkora például az alábbi vegyület \(pK_a\) értéke?

A molekulán található négy különböző típusú proton potenciális savasságát kell értékelnünk, és meg kell találnunk a legsavanyúbbat. Az aromás protonok nem mind savasak – \(pK_a\) értékük 45 körül van. Az amincsoport szintén nem savas, \(pK_a\) értéke 35 körül van. (Ne feledjük, hogy a töltés nélküli aminok bázikusak: a pozitív töltésű protonált aminok 10 körüli \(pK_a\) értékekkel gyengén savasak). Az alkohol protonjának \(pK_a\) értéke körülbelül 15, a fenol protonjának \(pK_a\) értéke pedig körülbelül 10: tehát a fenti molekulán a fenol a legsavanyúbb csoport. (Ügyeljen arra, hogy felismerje a különbséget a fenol és az alkohol között – ne feledje, hogy a fenolban a \(OH\) csoport közvetlenül az aromás gyűrűhöz kapcsolódik). Ha ez a molekula reakcióba lépne egy erős bázis, például nátrium-hidroxid egy mólegyenértékével, akkor a fenol protonja adódna fenolát-anion képződéséhez.
gyakorlat \(\PageIndex{2}\)
Az alábbi molekulák mindegyikénél azonosítsa a legsavanyúbb funkciós csoportot, és adja meg annak megközelítő \(pK_a\) értékét.