Bevezetés
A reumatoid arthritis (RA) egy poligénes autoimmun betegség, amelyet szisztémás manifesztációkkal járó poliartritisz, valamint fokozott és súlyos morbiditás jellemez.1,2,2 Az RA a lakosság 0,5-1%-át érinti, az életminőség romlását, jelentős fizikai fogyatékosságot és jelentős gazdasági költségeket okoz.3-6 A betegség klinikai kifejeződése változatos, az enyhe önkorlátozó formáktól a nagyon agresszív, gyors lefolyású, az érintett ízület pusztulásában és az ebből eredő rokkantságban csúcsosodó fejlődésig terjed.7
Genetikai vizsgálatok megerősítették egy genetikai szubsztrátum létezését, amely részben a T-sejtválaszban szerepet játszó fehérjéket kódoló bizonyos génekhez kapcsolódik.1 Ezek az eredmények megerősítik a T-sejteknek tulajdonított szerep fontosságát a kóros immunválasz megindulásában és fennmaradásában ebben a betegségben.8
A RA patogenezise összetett, és a veleszületett és adaptív immunválaszhoz kapcsolódó különböző sejtpopulációkat érint. A patogenezisben részt vesznek a synovium rezidens sejtjei, mint a fibroblasztikus synoviociták B vagy az intima makrofágjai, és a vérből származó gyulladásos sejtek, mint a T-limfociták, B-limfociták és monociták9. Ezek mind hozzájárulnak a synoviocyta B fenotípus agresszív átalakulásához és egy intenzív gyulladásos infiltrátum kialakulásához, amelynek végeredménye a porc és a subchondralis csont pusztulása10,11 (1. ábra).
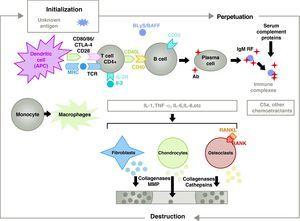
A rheumatoid arthritis patofiziológiája. A rheumatoid arthritis általános patofiziológiai szerveződése. AC, antitest; BAFF, B-sejt aktiváló faktor; BLyS, B-limfocita stimulátor; CD, differenciálódási klaszter; CPA, antigénprezentáló sejt; CPH, MHC; CTLA4, limfocita-asszociált antigén 4 T citotoxikus C5a frakció komplement 5a, FR, reumafaktor; Ig, immunglobulin; IL, interleukin; MMP, mátrix metalloproteinázok; RANK, receptor activator of nuclear factor B kappa; RANKL, receptor activator ligand for the nuclear factor B kappa; RCT, T-sejt receptor; TNF, tumor nekrózis faktor.
A RA jelenlegi kezelése a betegséget módosító antirheumatikus gyógyszerek (DMARD) önmagukban vagy kombinációban történő alkalmazásán alapul.12 Ezek a gyógyszerek lassítják az ízületi destrukciót, azaz képesek módosítani a betegség természetes lefolyását.4,13 A kielégítő klinikai választ adó betegek aránya azonban alacsony, és gyakran a betegek nagy százalékánál biológiai gyógyszer adása szükséges.9,13-15
Az utóbbi években új molekulákat és terápiás célpontokat azonosítottak, amelyek blokkolásával csökkenthető vagy megszüntethető a krónikus gyulladásos válasz. Az egyik ilyen új molekula az abatacept. Az abatacept egy teljesen humanizált fehérjekonstrukció, amely a humán citotoxikus T-limfocita-asszociált antigén 4 (CTL4) extracelluláris doménjéből és a humán immunglobulin G1 (IgG1) Fc régiójának genetikailag módosított fragmentumából áll, amely gátolja az immunválasz valódi magjában, tehát a betegség kezdeténél fellépő kosztimulációs T-sejteket.
T-sejt-aktiváció
A T-sejtek hatékony immunaktivációjához az antigénprezentáló sejtek (APC)14 membránreceptorainak két csoportjának részvételére van szükség (1. és 2. ábra). Az első az APC-k által használt hordozó, amely az előzőleg feldolgozott specifikus antigént a T-sejtekhez juttatja. A kutatásra fordított hatalmas erőfeszítések ellenére még mindig nem sikerült azonosítani az RA-t kiváltó arthritogén antigéneket8 . Egy olyan antigén APC-k általi prezentációja, amellyel szemben specifikus immunválasz alakul ki, egy trimolekuláris komplexen keresztül szerveződik, amely a következőket tartalmazza: az APC-ben jelen lévő fő hisztokompatibilitási komplex (MHC) molekulái, az antigén, amellyel szemben az immunválasz kialakul, és egy, az adott antigénre specifikus membránreceptor a T-sejtben (TCR)15 (az immunválasz jel- vagy jelátviteli útvonala 1).
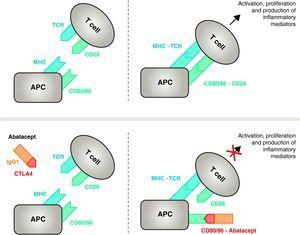
Az abatacept hatásmechanizmusa. A CTLA4 extracelluláris doménjét tartalmazó abatacept fragmentum a CD80/CD86 receptorokhoz kötődik, megakadályozva vagy kiszorítva a CD28 receptorral való kölcsönhatást. Ily módon szelektíven blokkolja a CD80/CD86 specifikus kötődését a CD28 receptorhoz, ami patofiziológiailag az immunaktiváció második jelének, és ezáltal a T-sejtek aktiválásának blokkolását jelenti CPA, antigénprezentáló sejt; MHC, major histocompatibility complex; TCR, T-sejt receptor.
A teljes aktiváció gátlásához a T-sejteknek az APC-k és a T-sejtek közötti sejtközi kommunikáció második receptorcsoportjára van szükségük, amely a kosztimulátoros útvonalakon keresztül történik és az úgynevezett 2 jelű immunválaszt alkotja.14 Bár többféle kostimulációs útvonal létezik, az egyik alapvető fontosságú, a CPA membránján lévő CD80 (B7-1)/CD86 (B7-2) receptoroknak a T-sejteken lévő CD28 receptorral való összekapcsolódása.10,16 Mindkettő egyidejű aktiválása intenzív intracelluláris jelátvitelt vált ki a T-sejtekben, ami elengedhetetlen a teljes aktivációhoz, a proliferációhoz, a túléléshez és a citokintermeléshez 8 . A T-limfociták aktiválódását követő 24-48 órában ugyanez az intracelluláris jelátvitel elindít egy szabályozó mechanizmust, amelynek célja, hogy magát a választ deaktiválja. Ez indukálja a CTLA411 expresszióját a limfocita sejtmembránon, amelynek feladata, hogy a CD80/CD86-hoz való nagyobb kötődési affinitása miatt versenyezzen a CD28-cal.17,18
A CD28 kosztimulátor receptortól függ mindkét T-sejt-alcsoport, a CD4+ és a CD8+ aktivációja. A CD4+ T-sejtek segítő T-sejtek. Felismerik az APC-n jelen lévő MHC II. osztályú molekulák által prezentált peptideket. Ezek az antigének a kórokozókat, például baktériumokat feldolgozó exogén útvonalból származnak. Számos autoimmun betegség a CD4+ T-sejtek kóros válaszával jár együtt. A CD8+ T-sejtek a maguk részéről citotoxikus limfociták (CTL). A CD8+ T-sejtek felismerik az MHC I. osztályú molekulák által prezentált antigéneket, főként vírusokat és tumorokat. Aktiválás után a CD8+ sejtek perforin, granzimek és interferon (IFN)-g termelésével közvetítik a célsejtek pusztulását. A T-sejtek mindkét altípusa a CD2815-tel történő költségstimuláció révén aktiválódik, bár a CD8+ T-sejtek aktivációja kevésbé függ ettől a költségstimulációs útvonaltól. Valójában, míg minden CD4+ sejt a CD28-at expresszálja a membránján, addig ez csak a CD8+ sejtek kb. 50%-ánál fordul elő.19 Emellett a CD4+ sejtek nagyobb választ mutatnak a CD2820 kötődésére. Ráadásul a CD28 promóter nem abszolút követelmény a CTL aktiválásához.21 Mindezek kettős terápiás előnyt jelentenének a klinikai gyakorlatban. Egyrészt az abatacept a betegség patogenezisében preferenciálisan a célsejtre hat. Továbbá a CD8+ limfociták aktivitására gyakorolt csökkentett hatás jobb biztonsági profilt biztosítana a vírusos és tumoros szövődmények tekintetében.
A CD4+ T-sejtek aktivációja a kiindulópontja egy nagy mennyiségű citokin termelődésével és sejtproliferációval járó proinflammatorikus kaszkádnak, amely, ha állandósul és fennmarad, mint az RA-ban, nagyon aktív krónikus gyulladáshoz vezet, amely képes elpusztítani azokat a szöveteket, amelyekben kiváltja, az RA8 esetében leginkább az ízületeket (1. ábra). Az ízületi hártya a vérből beszivárgó sejtek, köztük maguk a T-limfociták és altípusaik, valamint a B-limfociták miatt kezd el burjánzani A monociták makrofágokká és oszteoklasztokká differenciálódnak, és aktiválják az ízületi kondrocitákat is. Ebben a környezetben nagy mennyiségű proinflammatorikus citokin, például interleukin (IL)-1, IL-6 és tumor nekrózis faktor (TNF) és sok más citokin termelődik. A B-sejtek olyan autoantitesteket is termelnek, mint a reumafaktor vagy az anti-citrullinált peptid antitestek. Mindezek nemcsak az ízületi hártya, hanem az alatta lévő csont és porc pusztulásához is vezetnek.22
Biotechnológia a reumatoid artritisz kezelésében
A fent említett kutatások miatt kifejlesztették és kereskedelmi forgalomba hozták a különböző molekulák biotechnológiai gyártását, amelyek célja a specifikus célpontok blokkolása. Az első generációt a TNF-neutralizáló gyógyszerek megjelenése jellemezte: az etanercept, az infliximab és az adalimumab, valamint az anakinra, amelyek az IL-1 hatását gátolják. Ezt követően olyan új molekulák jelentek meg, mint az abatacept az immunválasz kostimulációjának modulálására, a certolizumab és a golimumab a TNF blokkolására, a rituximab a B-limfociták CD20 receptora ellen, valamint az IL-6-ot blokkoló tocilizumab.7,23-26
Az e gyógyszerek bevezetésének köszönhető hatalmas ugrás a terápiás hatékonyság tekintetében, a betegek jelentős hányada, becslések szerint 25% és 40% között, nem reagál a jelenleg forgalomban lévő gyógyszerekre vagy biológiai készítményekre, vagy a mellékhatások előfordulása miatt.27-32 A helyzet javításának szükségessége továbbra is ösztönzőleg hat a különböző terápiás célpontok szabályozását célzó új molekulák keresésére és fejlesztésére, amelyek javíthatják a terápiás hatékonyságot, mint például az abatacept esetében, amely szelektíven modulálja a T-sejtek aktiválását.33
Az abatacept egy fehérjekonstrukció, amelyet rekombináns DNS-technológiával állítanak elő hörcsög petefészek sejtekben.34,35 Ezt a molekulát úgy tervezték, hogy beavatkozzon a T-sejtek kosztimulációs útvonalainak szabályozásába, amelyek fontos szerepet játszanak a különböző autoimmun betegségek, fertőzések, transzplantált szervek kilökődése és a tumorimmunitás patogenezisében.36
Az abataceptet metotrexáttal kombinálva alkalmazzák olyan RA-betegeknél, akiknél nem volt megfelelő válasz vagy intolerancia más DMARD-okra, beleértve a metotrexátot (MTX) vagy a TNF-alfa gátlót. Poliartikuláris juvenilis idiopátiás artritiszben olyan 6 éves vagy idősebb betegeknél javallott, akiknél nem volt megfelelő válasz más DMARD-okra, beleértve legalább egy TNF-neutralizáló gyógyszert.35
Az Abatacept hatásmechanizmusa
Az Abatacept a CD80/86-CD28 kosztimulátoros jel szelektív modulátora, és amint azt korábban tárgyaltuk, ez elengedhetetlen a T-sejtek aktiválásához Az Abatacept gátolja a T-sejtek aktiválódását, szelektíven blokkolva az APC-ben lévő CD80/CD86 receptor specifikus kötődését a T-sejt CD28-hoz (ábra. 2).22,37 A farmakológiai stratégia a betegségre jellemző felgyorsult immun-/gyulladásos válasz gátlását és az immunrendszer normál homeosztázisának helyreállítását célozza. Valójában az endogén CD28 és a CTLA4 közötti versengés a CD80/86-hoz való kötődésért az a fiziológiai mechanizmus, amely a normális immunválasz szabályozására és adott esetben lezárására szolgál. Az Abatacept a CD80/86 CD28-hoz való kötődésének blokkolásával gátolja az immunválasz egy második jelének továbbítását, amely közvetve negatív jelzést hoz létre a T-sejtek aktivációjára. Ezenkívül az abatacept valószínűleg nagyobb hatást fejt ki a T-sejtekben a kosztimulátoros jel kialakulásának megakadályozásában, inaktiválva a már aktív, a T-sejtekhez nem kötődő CTLA4
Támogató hatású gyógyszer
1. Miért tartozik az abatacept az immunmoduláns gyógyszerek csoportjába? Alapvetően azért, mert a nem egy adott citokin szelektív blokkolásával kifejtett farmakológiai hatása miatt sejtdepletiót eredményez, különösen a T-sejteknél, elkerülve az immunválasz megfelelő működéséhez nélkülözhetetlen útvonalak radikális elnyomását.8
2. Hogyan akadályozza meg a molekula Fc régiójának a receptorához való kötődését? Az abatacept Fc régiója genetikailag módosított, így nem kötődik a CD16 és CD32 receptorokhoz, és nagyon gyengén kötődik a CD64 receptorhoz. Ez a kialakítás megkerüli az Fc-receptor által közvetített olyan sejtválaszokat, mint az antitestfüggő celluláris citotoxicitás (ADCC) és a komplementfüggő citotoxicitás (CDC).18 Mindkettő sejtlízissel jár, amelynek lehetséges káros hatásai a prolongált38 kezelések során jelentkezhetnek. Ezért úgy tűnik, hogy az IgG1 módosított fragmentuma aktív, ezáltal megakadályozza az ADCC-ből eredő káros eseményeket.39
3. Az abatacept gyulladáscsökkentő hatása. Az abatacept jelentősen csökkenti számos gyulladásos mediátort RA-s betegeknél, visszaállítva azok normális szintjét, amit több, a gyógyszer kutatása során felhasznált klinikai vizsgálat is bizonyított.
Egy II-b fázisú, 1 éves, placebokontrollos vizsgálatban RA-s és MTX-re nem megfelelő választ adó betegeknél az infúziót megelőző napokban mintát vettek és megmérték a kiválasztott markerek szérumszintjét, hogy tanulmányozzák az abatacept mediátorokra és proinflammatorikus citokinekre gyakorolt hatását. A betegek egy csoportja MTX-et és 10mg/kg abataceptet kapott, rendszeres ütemterv szerint. A kontrollcsoportot eközben MTX-szel és placebóval kezelték. Egy évvel a kezelés után a 10mg/kg abatacept csoportban a markerek normalizálódtak, míg a placebocsoportban emelkedettek maradtak (TNF: 7,4 vs 10,3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228,3. 1697,1pg/ml IL-6: 7,3 vs 19,9pg/ml).40
4. Immunogenitás. A gyógyszerre vonatkozó adatok szerint a 3877 (4,8%), legfeljebb 8 évig abatacept-tel kezelt RA-s betegből csak 187-nél alakultak ki antitestek a gyógyszerrel szemben a kezelés alatt.41 Az abatacept elleni antitesteket a gyógyszer abbahagyása után (>42 nappal az utolsó adag után) vizsgálták a betegeknél, és 1888 betegből 103-nál (5,5%) szeropozitívak voltak. Ezzel szemben egy másik vizsgálatban 2000 beteg abatacept antitestjeit mérték, és arra a következtetésre jutottak, hogy az abataceptnek alacsony az immunogenitása.42,43
5. Abatacept és tuberkulózis. A TNF részt vesz a tuberkulózis (TBC) gyulladásos válaszában és immunpatológiájában. In vitro vizsgálatok azt mutatják, hogy a TNF növeli a fagocitikus aktivitást és a mycobactericid makrofágok, míg in vivo részt vettek a kezdeti kialakulása és az azt követő fenntartása granulomák, valami, ami ellenőrzi a növekedés a mycobacteria és korlátozza a terjedését. Egerekben a látens TBC reaktiválásának krónikus modelljében vizsgáltuk a fertőzés alakulását abatacept-tel kezelt egerekben, összehasonlítva egy másik csoporttal, amelyet egy egér monoklonális anti-TNF-ellenes szerrel kezeltek.42 4 hónappal azután, hogy C57BL/6 egereket Mycobacterium tuberculosisszal fertőztek, és miután megerősítették, hogy látens TBC-fertőzésük van, az egereket 16 héten keresztül két kísérleti beavatkozás egyikével kezelték. Ezt követően az anti-TNF-fel kezelt egerek mindegyike elpusztult disszeminált tuberkulózisban, az átlagos túlélés 44 nap volt. Ezzel szemben az abatacept-tel kezelt egerek egyike sem pusztult el.
Míg a szérum IFN-g koncentrációja nem változott az abatacept-csoportban, addig az anti-TNF-fel kezelt egerekben emelkedett. Ezt a növekedést a CD4+ és CD8+ fokozott infiltrációjának tulajdonították, amelyet a baktériumtelepek széles körű szétszóródása okozott.
Míg tehát az anti-TNF terápiával kezelt egerek 100%-os mortalitást mutattak, az abatacept nem változtatta meg az egerek azon képességét, hogy a tuberkulózis terjedésének megfékezésére alkalmas gyulladásos választ szervezzenek. Azonban még mindig nincs elegendő klinikai adat ahhoz, hogy ezeket az eredményeket emberekben is megerősítsük.
6. Az abatacept antiresorptív hatása a csont remodellingre. Az osteoclast-aktivitás RA-ban fokozódik, mind az ízületben, csonteróziót okozva, mind szisztémásan, elérve az általános osteoporosishoz társuló szintet.44,45
Tény, hogy az ízületi membránban kimutatták az NF-kB nukleáris faktor receptoraktivátorának (RANKL) ligandjának növekedését.45,46 Az abatacept dózisfüggően gátolja az in vitro vizsgált egér osteoclast-képződést és az osteoclastogen aktivitást. Ezt dentinlemezeken tenyésztett egér-osteoklasztokon vizsgálták, amelyek különböző dózisú abatacept hozzáadása után 6 nappal a reszorpciós gödrök számát mérték.47
A gyógyszer szignifikánsan csökkentette a csontreszorpció területét. Ezek az adatok arra utalnak, hogy az abatacept olyan molekula, amely közvetlenül az osteoclast prekurzor sejtekhez kötődik, gátolva azok differenciálódását. Ez a mechanizmus magyarázhatja a gyógyszer RA-ban szenvedő betegeknél kifejtett antierozív hatását. Tény, hogy az abatacept-tel kezelt betegeknél a RANK és ligandjának, a RANKL-nak a szintje csökkenő tendenciát mutatott a synoviumban, ami mind a megnövekedett osteoprotegerin-szinthez társult.48 Bár a megfigyelés hátterében álló pontos mechanizmus nem világos, ezek az eredmények jól korrelálnak az abatacept-tel kezelt betegeknél megfigyelt radiológiai javulással.
7. Az abatacept hatásai más immunsejtekre. Bár az APC az abataceptet megkötő célsejt, és a makrofágok is kifejezik a CD80/86 receptorokat a felszínükön, kevés tanulmány vizsgálja a gyógyszer hatását e sejtek aktivitására. Valóban, egy nemrégiben végzett in vitro vizsgálat kimutatta, hogy a makrofágok kifejezett CD80/86 receptor expressziót mutattak, és az abatacept kezelés jelentősen csökkentette a citokin49 termelést. Ezek az eredmények arra utalnak, hogy a gyógyszer hatásmechanizmusa kiterjeszthető a betegség patogenezisében kulcsfontosságú sejtek, a makrofág-vonal szabályozására.
Az abatacept elnyomja az antigénspecifikus T-sejtek follikuláris migrációját, és ennek következtében a nyirokcsomóban a T-sejtek és a follikuláris B-sejtek közötti együttműködést is. Ezt a megállapítást in situ figyelték meg BALB/c50 egerek nyirokcsomóiban. Miután az ilyen egereket antigénspecifikus előstimulált T-sejtekkel transzfundálták, az egerek későbbi immunizálása T-sejt-proliferációt és migrációt mutatott a B-limfociták területére. Az abatacept-tel kezelt egerekben a T-sejtek proliferációja és migrációja gátolt volt, ami a legtöbb esetben korlátozta a jelenlétét a nyirokcsomó paracortexében. Így az abatacept-kezelés elhúzódása csökkenti az intraganglionáris autoantigén memória limfociták proliferációját, mobilitását és eloszlását, ami az autoantitestek csökkenéséhez vezethet.
Következtetések az Abatacept hatásmechanizmusára vonatkozóan
Az Abatacept egy teljesen humanizált fehérjekonstrukció, amely a humán citotoxikus T-limfocita-asszociált antigén 4 (CTL4) extracelluláris doménjéből és az IgG1 Fc régiójának genetikailag módosított fragmentumából áll, amelyet úgy terveztek, hogy beavatkozzon a T-limfociták kosztimulációjának szabályozásába A gyógyszer a CD80/CD86 CD28 receptorhoz való specifikus kötődésének szelektív blokkolásával gátolja a T-sejtek aktiválódását, és ezáltal gátolja a T-sejtek proliferációját és a B-limfociták immunválaszát Ez a farmakológiai hatás a gyulladásos mediátorok szintjének csökkenését eredményezi RA-s betegeknél, valamint biztonságos és hatékony klinikai választ.
érdekellentét
Dr. Gabriel Herrero-Beaumont kutatási támogatást kapott a Bristol-Myers-Squibb-től. Dr. Santos Castañeda oktatási és kutatási támogatásban részesült az Abbott, az MSD és a Pfizer cégektől.