A DNS viszonylagos szerkezeti egyszerűségét és ismétlődő jellegét tekintve ebből következik, hogy a specifikusan hozzá kötődő fehérjék közös DNS-kötő doménmotívumokkal rendelkezhetnek, de specifikus aminosav-oldalláncokkal, amelyek lehetővé teszik a specifikus kötő kölcsönhatásokat.
- helix-turn-helix: prokarióta DNS-kötő fehérjékben található.
Ábra: helix-turn-helix
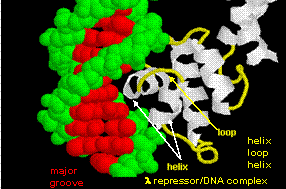
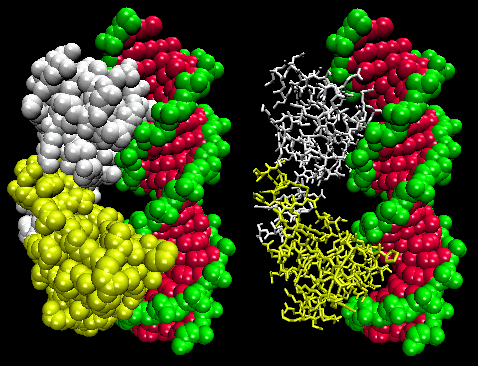
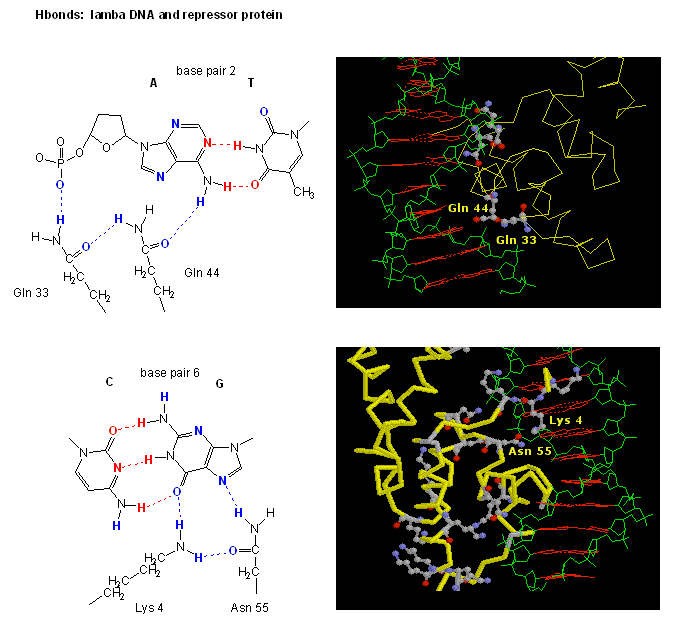
Az ábrán két ilyen fehérje, a 434-es bakteriofág cro-represszora és a lambda-represszor a lambda bakteriofágból. (A bakteriofágok olyan vírusok, amelyek baktériumokat fertőznek.) Vegyük észre, hogy a specificitás részben a fehérje és az operátor DNS nagy barázdája közötti specifikus H-kötések kialakításával érhető el.
Ábra: Lambda-represszor/DNS komplex
Ábra: H Bond kölcsönhatások aλ represszor és a DNS között
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
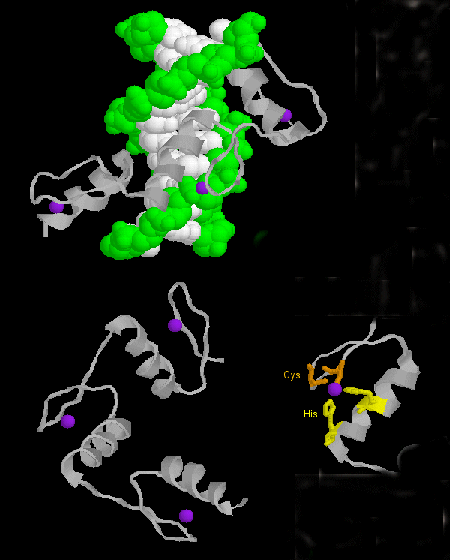
- cinkujj: (eukarióták) Ezeknek a fehérjéknek közös szekvencia-motívuma az X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4-, amelyben X bármelyik aminosav. A Zn2+ tetraéderes koordinációban van a Cys és His oldalláncokkal, amelyek a két antiparallel béta szál egyikén, illetve egy alfa hélixen helyezkednek el. A cink által stabilizált cinkujj a DNS nagy barázdájához kötődik. ]
Ábra: cinkujj
![]() Jmol: Zif268:DNS komplex Jmol14 (Java) | JSMol (HTML5)
Jmol: Zif268:DNS komplex Jmol14 (Java) | JSMol (HTML5)
A zn-ujj fehérjék, amelyek közül 900-at kódol az emberi genom (köztük a fentebb ismertetett eukarióta szigetelőkötő fehérjét, a CTCF-et), mozgósíthatók a sejtekben lévő specifikus mutációk tényleges javítására, ami, ha a mutáns sejtek elég nagy százalékában végbemegy, gyógyíthat bizonyos genetikai betegségeket, például a súlyos kombinált immunhiányos betegség egyes formáit. Ebben az új technikában (Urnov et al, 2005) több összekapcsolt Zn-ujj kötő domén (a természetben előforduló vagy a laboratóriumban előállított mutáns formák egyike), amelyek mindegyike egy bizonyos nukleotidszekvenciára specifikus, egy nem specifikus endonukleázhoz kapcsolódik, amely a FokI enzimből származik. A nukleáz dimer formában aktív, így az aktív komplexhez két endonukleáz doménre van szükség, amelyek mindegyike négy különböző Zn-ujj doménhez kötődik, hogy a célhelyen összeálljon. A kötődés specifikussága a Zn-ujj domének általi szelekcióval érhető el. Ezután a nukleáz a DNS-en egy bevágást hoz létre, és a gazdasejt javító mechanizmusai következnek. Ez a folyamat magában foglalja a szálak szétválását, a bevágott régió homológ rekombinációját a sejten belüli komplementer DNS-sel, és a bevágás javítását. Ha felesleges vad típusú (nem mutálódott) DNS-t adunk a sejtekhez, és azt sablonként használjuk, a normál DNS-javító mutáció kijavítja a mutációt. Urnov és munkatársai kimutatták, hogy a mutációt tartalmazó tenyésztett sejtek akár 20%-a is javítható a laboratóriumban. Ha ezek a sejtek szelektív növekedési előnyre tesznek szert, a mutálódott sejtek végül vad típusú sejtekre cserélődnének.
- szteroidhormon-receptorok: (eukarióták) A legtöbb hormonnal ellentétben, amelyek a sejtfelszíni receptorokhoz kötődnek, a szteroid hormonok (a koleszterin származékai) áthaladnak a sejtmembránon, és egy hormonkötő doménen keresztül kötődnek a citoplazmatikus receptorokhoz. Ez megváltoztatja a receptor alakját, amely aztán egy DNS-kötő doménen keresztül a DNS egy meghatározott helyéhez (hormonválasz elem) kötődik. A cinkujjhoz analóg szerkezetben a Zn 2+ tetraéderesen koordinálódik 4 Cys-hez, egy gömbszerű szerkezetben, amely dimerként kötődik a DNS két azonos, de fordított szekvenciájához (palindrom) a nagy barázdában. (Példák a palindromokra: Képes voltam, mielőtt megláttam Elbát; Dennis és Edna vacsoráznak, mondtam, ahogy Enid és Edna vétkeztek.
Lássuk konkrét példaként a glükokortikoid receptort (GR). A DNS-hez dimerként kötődik. A dimer két DNS-kötő doménje a DNS két szomszédos fő barázdájához társul a GR-kötő szekvenciában (GBS), egy rövid DNS-szekvenciában a promóteren belül. Meijsing és munkatársai megállapították, hogy a GBS nemcsak a GR kötőhelyeként működik, lehetővé téve a gének átírását, hanem a receptor konformációját is befolyásolja, ami a génátírást más módon szabályozza. A csoport olyan luciferáz “riporter géneket” konstruált, amelyekben a GBS a luciferáz fehérje génjéhez kapcsolódik, amelyek a GBS segítségével a luciferáz fehérjét (amely fluoreszkál) expresszálnák, ha átíródnának. Azt találták, hogy a relatív transzkripciós aktivitás nem korrelált a GR és a GBS relatív kötődési affinitásával. Azok a GBS-ek, amelyek sokkal aktívabbak voltak, mint mások, összehasonlíthatóan kötődtek a kisebb aktivitásúakhoz, míg a hasonló transzkripciós aktivitású GBS-ek különböző affinitással kötődtek. Ez azt mutatja, hogy a GBS egyedi funkciót ad a hozzá kapcsolódó GR-nek (azaz a transzkripciót nem egyszerűen az befolyásolja, hogy a GR kötődik-e a GBS-hez vagy sem). Kiderült, hogy a receptor �lever karja� konformációs változásokon megy keresztül, amikor DNS-hez kötődik, és a változások specifikusak arra a szekvenciára, amelyhez kötődik. Egy mutáns fehérjét, a GR-γ-t, a vad típusú fehérjével, a GR-α-val azonosnak állították elő, kivéve a kar karját, és megállapították, hogy eltérő transzkripciós aktivitással rendelkeznek, annak ellenére, hogy a DNS ugyanazon helyéhez kötődtek, ami azt mutatja, hogy a kar és annak konformációja befolyásolja a transzkripciót.
- leucin cipzárak (vagy olló): (eukarióták) Ezek a fehérjék 35 aminosavból álló szakaszokat tartalmaznak, amelyekben a Leu 7 aminosav intervallumban ismételten megtalálható. A fehérje ezen régiói amfifil hélixeket alkotnak, amelyek egyik oldalán Leu, a hélix két fordulata után egy Leu található. Két ilyen fehérje dimert alkothat, amelyet ezeknek a nem poláros, leucinban gazdag amfifil hélixeknek az egymáshoz való kötődése stabilizál, egy tekercset alkotva, hasonlóan az izomfehérje miozinhoz. A leucin cipzár a fehérje fehérje kötő doménjét képviseli. A DNS-kötő domén az első 30 N-terminális aminosavban található, amelyek bázikusak és alfa-hélixet alkotnak, amikor a fehérje DNS-hez kötődik. A leucin cipzár ezután úgy működik, hogy két DNS-kötő fehérjét hoz össze, lehetővé téve, hogy az N-terminális bázishélixek bázisspecifikus módon kölcsönhatásba lépjenek a DNS nagy barázdájával. A valin és az izoleucin a leucinnal együtt gyakran találhatók olyan aminosavakból álló szakaszokban, amelyek kölcsönhatásba lépve más típusú tekercseket alkothatnak.
Ábra: leucin cipzárak (VMD-vel készült)
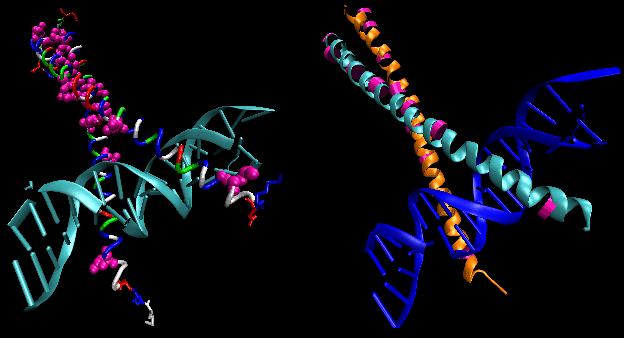
![]() Jmol: Jmol14 (Java) | JSMol (HTML5)
Jmol: Jmol14 (Java) | JSMol (HTML5)
Ahogyan a cinkujjas nukleázokat is használták már mutációk javításának indukálására, egy másik vizsgálatban a patkány genomban speciálisan tervezett ZFN-eket használtak arra, hogy olyan töréseket okozzanak a ds-DNS-ben, amelyek a DNS-javítás pontatlan mechanizmusából (NHEJ által) származó mutációkat tartalmaznak, és így specifikus mutációkat tartalmaznak (Geurts, et al. 2009). Ez a folyamat, a �gén kiütése,� megakadályozza a célgén által normális esetben átírt fehérje termelődését. Öt- és hatujjas ZFN-eket használtunk, hogy nagyfokú specificitást érjünk el a génhez való célzott kötődésben három különböző fehérje esetében: zöld fluoreszcens fehérje (GFP), immunglobulin M (IgM) és Rab38. A knockout a vizsgált patkányok 12%-ánál sikeres volt; ezeknél az állatoknál nem volt vad típusú fehérje és nem volt expresszió. A ZFN-ek eléggé specifikusak voltak ahhoz, hogy a 20 előre jelzett, nem célzott hely egyikén sem észleltek mutációt. Ez a vizsgálat alátámasztja a transzkripció és expresszió szabályozásának életképességét a betegségek kezelésében, valamint a specifikus kötődés fontosságát.
Láttuk, hogy két fő tényező járul hozzá a DNS fehérjék általi specifikus felismeréséhez; a hidrogénkötések kialakulása specifikus nukleotid donorokhoz és akceptorokhoz a nagy barázdában, valamint a DNS hélix szekvenciafüggő deformációja megváltozott alakúvá a fehérje ligandumok fokozott affinitásával. Például a Tata-kötő fehérje (TBP) képes kölcsönhatásba lépni a TATA-doboz kiszélesített kis barázdájával. Az új eredmények azt támasztják alá, hogy emellett a fehérjék a nukleotidszekvenciától függően “beszűkült” minor barázdákban lévő információt is képesek felhasználni.
A DNS A-ban dúsított nyomvonalai olyan csavarodó konformációkhoz vezethetnek, amelyek bázispárok közötti hidrogénkötést okoznak a major barázdákban, a minor barázdák beszűkülését eredményezik. Az AT bázispárok nagy mennyiségben koncentrálódnak a keskeny minor barázdákban (szélesség <5,0 �), a CG bázispárok pedig gyakrabban fordulnak elő a széles minor barázdákban.
Hogyan befolyásolja a minor barázdák szűkülése a DNS felismerését? A keskeny minor barázdák növelik a DNS negatív elektrosztatikus potenciálját, ezáltal specifikusabbá és felismerhetőbbé téve azt. A DNS gerincfoszfátjai közelebb vannak a barázda közepéhez, amikor az keskeny, így a keskeny minor barázdák negatívabb elektrosztatikus potenciállal korrelálnak.
A fehérjék minor barázdával kölcsönhatásba lépő részei arginint tartalmaznak, amelynek oldallánca a keskenyebb és negatívabb minor barázdában elfér. Az argininek rövid szekvencia-motívumokként tudnak kötődni és bizonyos esetekben beilleszkedni, ami fokozza a DNS alakfelismerés specificitását. Az Arg előnyben részesül a Lys-szel szemben, mivel az Arg-ban lévő töltés effektív sugara nagyobb, mint a Lys-ben lévő töltéshordozóé. Ez az Arg esetében kisebb desolvációs energiát eredményez, ami elősegíti a szűkített nagy barázdához való kötődését. Ez a felfedezés azt mutatja, hogy “a DNS alakjának szerepét figyelembe kell venni a teljes genom annotálásakor és a transzkripciós faktor-kötőhelyek előrejelzésekor”.
Ábra: Arg a T3c transzpozáz kötődésében a T3c transzpozon szűkített kis ligetében
- A fehérje/DNS kölcsönhatások csúszó modellje
Megosztók és attribúciók
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)