Editorial on the Research Topic
The Role of AAA+ Proteins in Protein Repair and Degradation
ATPases Associated with diverse cellular Activities (AAA+) comprises a superfamily of proteins that perform an large variety of functions essential to cell physiology, beleértve a fehérje homeosztázis szabályozását, a DNS-replikációt, a rekombinációt, a kromatin átalakítását, a riboszómális RNS feldolgozását, a molekuláris célzást, az organellák biogenezisét és a membránfúziót (Hanson és Whiteheart, 2005; Erzberger és Berger, 2006; Snider et al., 2008). E szupercsalád tagjait az úgynevezett AAA+ domén jelenléte határozza meg, amely tartalmazza az ATP megkötéséhez és hidrolíziséhez szükséges kanonikus Walker A és B motívumokat (Hanson és Whiteheart, 2005). Jellemzően a genomok körülbelül tíz és több száz AAA+ családtagot kódolnak (1. táblázat; Finn és mtsai., 2017), amelyek mindegyike feltehetően specifikus funkcionális fülkékhez alkalmazkodik, amelyek a szubsztrátfelismerés és -feldolgozás pontos mechanizmusait igénylik (Hanson és Whiteheart, 2005). Az AAA+ fehérjék feltűnő adaptív kisugárzása a különböző környezetben való működésre az AAA+ domén sokoldalú hasznosságát illusztrálja (Erzberger és Berger, 2006). Az AAA+ fehérjék jellemzően hexamer komplexeket alkotnak, és motorként működnek más fehérjék, DNS/RNS vagy többkomponensű komplexek átalakításában (1. ábra). Valóban, számos chaperon és ATP-függő proteáz olyan alegység, vagy olyan alegysége van, amely ebbe a szupercsaládba tartozik (1. ábra; Olivares et al., 2016).
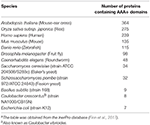
Táblázat 1. táblázat. Az AAA+ fehérjék száma a modellorganizmusokbana.
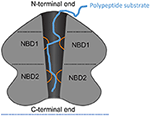
1. ábra. A ClpA mint példa AAA+ hexamer sémája. A ClpA mint példa AAA+ hexamer doménarchitektúrájának és kölcsönhatásainak sematikus ábrázolása, monomerenként két AAA+ doménnel. Itt a ClpA hexamer kivágott oldalnézete látható, amely a központi, polipeptid-vezető csatornát ábrázolja. A ClpA három domént tartalmaz, köztük egy N-terminális domént és két AAA+ domént: nukleotidkötő domén 1 és 2 (NBD1 és NBD2). Az N-terminális domén a szubsztrátspecifitás szabályozóival lép kölcsönhatásba, míg a C-terminális vége a kamrai proteáz ClpP-vel lép kölcsönhatásba. Az NBD1 és NBD2 mobil hurkai (narancssárga) a központi csatornába nyúlnak és polipeptidszubsztrátot (kék) vonnak be, ezáltal lehetővé téve az ATP-hidrolízis és a polipeptid transzlokáció összekapcsolását a központi csatornán keresztül.
Az elmúlt években jelentős előrelépés történt számos AAA+ fehérje szerkezetének és működési mechanizmusának azonosításában (Gates et al., 2017; Puchades et al., 2017; Ripstein et al., 2017; Zehr et al., 2017). Ebben a kutatási témában ennek az izgalmas előrelépésnek számos elemét közvetítjük 21 cikkben, amelyek számos AAA+ chaperon és proteáz részletes szerkezeti és mechanisztikai áttekintését foglalják magukban, többek között: ClpX (Alhuwaider és Dougan; Bittner et al.; Elsholz et al.; LaBreck et al.; Vass et al.), ClpA (Bittner et al.; Duran et al.), ClpB és Hsp104 (Chang et al.; Duran et al.; Franke et al.; Johnston et al.), Hsp78 (Abrahão et al.), ClpC (Alhuwaider és Dougan; Elsholz et al.), ClpE (Elsholz et al.), Pontin (Mao és Houry), Reptin (Mao és Houry), FtsH (Alhuwaider és Dougan), 19S proteaszóma (Snoberger et al.; Yedidi et al.), Lon (Alhuwaider és Dougan; Bittner et al.; Fishovitz et al.), p97 (Hänzelmann és Schindelin; Saffert et al.; Ye et al.), Pex1/6 (Saffert et al.), CbbQ (Mueller-Cajar), rubisco aktiváz (Bhat et al.), torsinok (Chase et al.) és mitokondriális AAA+ proteázok (Glynn). Itt bemutatjuk ezeket az izgalmas munkákat.
Tanulmányok a ClpXP-ről, a Lonról és a rokon ATP-függő proteázokról
A “The Protein Chaperone ClpX Targets Native and Non-native Aggregated Substrates for Remodeling, Disassembly, and Degradation with ClpP” című kutatási cikkükben LaBreck et al. elegáns kísérletsorozatot végeznek annak megállapítására, hogy a ClpX rendelkezik dezaggregációs aktivitással olyan polipeptidekkel szemben, amelyek specifikus ClpX-felismerő jeleket tartalmaznak (LaBreck et al.) ClpP jelenlétében a ClpX ezen szubsztrátok dezaggregációját a lebontásukhoz kapcsolja. Fontos, hogy azt is megállapították, hogy a ClpXP megakadályozza a ClpX felismerő jeleket tartalmazó fehérjék által képzett aggregátumok felhalmozódását in vivo (LaBreck és mtsai.). Ezek a vizsgálatok rávilágítanak a ClpX-re mint fehérje-deggregázra, amelyet korábban alulértékeltek.
“The Essential Role of ClpXP in Caulobacter crescentus Requires Species Constrained Substrate Specificity” című kutatási cikkükben Vass és munkatársai a ClpX fajspecifikus funkcióit vizsgálják (Vass és munkatársai). Érdekes módon a ClpX egyes fajokban, például a C. crescentusban nélkülözhetetlen, más baktériumokban, például az E. coliban viszont nem (Vass et al.). Fontos, hogy az E. coli ClpX in vivo nem tudta komplementálni a C. crescentus ClpX-et (Vass et al.). Ez az aktivitáshiány a ClpX N-terminális doménjének fajspecifikus különbségeinek volt köszönhető, amelyek kritikusak a replikációs kapcsok betöltő DnaX alegységének feldolgozásához a C. crescentusban. Így a ClpX specifitásában mutatkozó kis különbségek különösen kritikusak lehetnek az egyes baktériumfajok számára.
A “Functional Diversity of AAA+ Protease Complexes in Bacillus subtilis” című áttekintésükben Elsholz és munkatársai több AAA+ proteáz funkcióját tárgyalják a B. subtilisben, nevezetesen: ClpCP, ClpEP, ClpXP, ClpYQ, LonA/B és FtsH (Elsholz et al.). Tárgyalják, hogy a különböző stresszválaszok hogyan szabályozzák expressziójukat, és milyen fenotípusok figyelhetők meg e különböző proteázok deléciója esetén. Leírják, hogy e proteázok némelyike képes a kompetencia, a sporuláció, a motilitás és a biofilmképződés szabályozására. Végül a szerzők tárgyalják e proteázok célzott felhasználását új antibiotikumok kifejlesztésére.
A “AAA+ Machines of Protein Destruction in Mycobacteria” című áttekintésükben Alhuwaider és munkatársai (Alhuwaider és Dougan) a mikobaktériumok AAA+ proteázainak szerkezetének és működésének meghatározásában elért legújabb eredményeket tárgyalják. Ezek a proteázok a következők: ClpXP1P2, ClpC1P1P1P2, Lon, FtsH és Mpa. A szerzők tárgyalják a mikobaktériumokban jelen lévő Pup-proteaszóma rendszert (PPS) is, amely az eukarióták ubikvitin-proteaszóma rendszerének felel meg. Alhuwaider és munkatársai ezután a ClpP1P2 aktivitását diszreguláló vagy gátló, illetve a ClpC1-et diszreguláló új vegyületek megvitatásával zárnak. Ezek a vegyületek ígéretes aktivitást mutatnak a mikobaktériumokkal szemben.
A “The Copper Efflux Regulator CueR Is Subject to ATP-Dependent Proteolysis in Escherichia coli” című kutatási cikkben Bittner és munkatársai bemutatják, hogy a Lon, ClpXP és ClpAP AAA+ proteázok felelősek az E. coli CueR degradációjáért, amely egy transzkripciós faktor, amely a réz efflux Cue rendszer indukcióját szabályozza (Bittner és munkatársai). A szerzők megállapították, hogy a CueR AAA+ proteázok általi felismeréséhez a CueR hozzáférhető C-terminusára van szükség. Arra a következtetésre jutottak, hogy az ATP-függő proteázok szükségesek az E. coli réz homeosztázisához.
Fishovitz és munkatársai “Utilization of Mechanistic Enzymology to Evaluate the Significance of ADP Binding to Human Lon Protease” című kutatási cikkükben részletes összehasonlítást végeznek a humán és E. coli Lon között (Fishovitz és munkatársai). Részletes mechanisztikus vizsgálat segítségével megállapították, hogy az E. coli Lon-tól eltérően a humán Lon alacsony affinitással rendelkezik az ADP iránt, annak ellenére, hogy hasonló kcat és KM értékeket mutat az ATPáz aktivitásban. Azt javasolják, hogy a humán Lont nem egy szubsztrát által támogatott ADP/ATP csere mechanizmus szabályozza. Ezek a különbségek a humán és az E. coli Lon között lehetővé tehetik a fajspecifikus Lon-inhibitorok jövőbeli kifejlesztését.
A “Multifunkcionális mitokondriális AAA-proteázok” című áttekintésében Dr. Glynn a két mitokondriális AAA-proteázt, az i-AAA-t és az m-AAA-t tárgyalja (Glynn). Mindkettő mitokondriális belső membránfehérje. Az i-AAA azonban az ATPáz és a proteáz doméneket a mitokondriális intermembrán térbe vetíti, míg az m-AAA proteáz a katalitikus doméneket a mátrixba. E proteázok szerkezetét és működési mechanizmusát tárgyaljuk. A proteázok képesek teljes szubsztrátlebontást végezni, de csak bizonyos szubsztrátokat is képesek hasítani, mint például az MrpL32 és az Atg32 esetében.
ClpB és Hsp104
A “Structural Elements Regulating AAA+ Protein Quality Control Machines” című minikritikájukban Chang et al. tárgyalják, hogy a pórus hurok-1, az Inter-Subunit Signaling motívum és a Pre-Sensor I insert motívum hogyan járulhat hozzá két Hsp100 dezaggregáz, a bakteriális ClpB és az élesztő Hsp104 aktivitásához (Chang et al.). Egy modellt javasolnak arra vonatkozóan, hogy ezek a szerkezeti elemek hogyan tehetik lehetővé, hogy az AAA+ ATPáz ciklus összekapcsolódjon a ClpB és a Hsp104 központi csatornáján keresztüli szubsztrát-transzlokációval. Ez a polipeptid-transzlokációs folyamat vélhetően alátámasztja, hogy a ClpB és a Hsp104 hogyan vonja ki a polipeptideket az aggregált struktúrákból (Chang et al.).
Duran et al. áttekintésükben (Duran et al.) “Comparative Analysis of the Structure and Function of AAA+ Motors ClpA, ClpB, and Hsp104: Common Threads and Disparate Functions” (Az AAA+ motorok ClpA, ClpB és Hsp104 szerkezetének és működésének összehasonlító elemzése). Tárgyalják e három AAA+ fehérje (ClpA, ClpB és Hsp104) azon képességét, hogy hexamer komplexeiken keresztül polipeptideket transzlokáljanak. Mindegyik fehérje két AAA+ doménnel rendelkezik, és ismertek a fehérjék kibontakoztatásáról. Fontos, hogy a ClpB és a Hsp104 ismert arról is, hogy dezaggregázként működnek, míg a ClpA a ClpP proteázzal komplexet képezhet. A szerzők kiemelik, hogy tranziens állapotkinetikai módszereket kell alkalmazni e motorfehérjék kinetikai mechanizmusainak vizsgálatához. Leírják, hogy ilyen módszerek alkalmazásával hogyan tudták kimutatni, hogy például a ClpA körülbelül 20 aa s-1 sebességgel transzlokálja a polipeptideket, míg a ClpP proteázzal komplexben a ClpA transzlokációs sebessége még ennél is nagyobb, körülbelül 35 aa s-1 . A szerzők kitérnek a Hsp70 chaperon fontosságára a ClpB/Hsp104 működésében,valamint a Hsp70 és a ClpB/Hsp104 közötti kölcsönhatás fajspecifikusságának megfigyelésére.
“Mutant Analysis Reveals Allosteric Regulation of ClpB Disaggregase” című kutatási cikkükben Franke és munkatársai mutációs elemzést végeznek az E. coli ClpB dezaggregázon annak alloszterikus szabályozásának jellemzésére (Franke et al.). A ClpB egy N-terminális doménre és két AAA+ doménre osztható, amelyeket egy helikális régió, az úgynevezett M-domén választ el. A szerzők az első AAA+ doménben azonosítottak egy erősen konzervált maradékot, az A328-at. A ClpB-A328V mutáns nagyon magas ATPáz aktivitást és sejttoxicitást mutatott. Váratlanul a ClpB-A328V magas ATPáz-aktivitása elsősorban a második AAA+ gyűrűnek volt köszönhető, amint azt amid-hidrogéncsere tömegspektrometriával értékelték. A szerzők arra következtetnek, hogy az A328 egy kulcsfontosságú maradék a ClpB mindkét AAA+ gyűrűjének ATP-hidrolízisének szabályozásában.
A “Substrate Discrimination by ClpB and Hsp104” című kutatási cikkükben Johnston és munkatársai leírják a ClpB és a Hsp104 veleszületett szubsztrátpreferenciáit a DnaK és Hsp70 chaperonrendszerek hiányában (Johnston és munkatársai). Megmutatják, hogy a szubsztrátspecifikusságot az egyes fehérjék első AAA+ doménje határozza meg. Erre a következtetésre úgy jutottak, hogy tesztelték a két chaperon több modellszubsztrátra való képességét. A két chaperon különböző kiméráit is tesztelték.
A “Hsp78 (78 kDa Heat Shock Protein), a Saccharomyces cerevisiae mitokondriális mátrixában található reprezentatív AAA családtag” című cikkben Abrahão és munkatársai a Hsp78 szerkezetét és működését tárgyalják (Abrahao és mtsai.). A Hsp78 a Hsp104 mitokondriális paralógja, amely a fehérjék dezaggregációjában és reaktiválásában játszik szerepet (Abrahao et al.). Érdekes módon a Hsp104 és a Hsp78 elveszett a protozoából a metazoába való átmenetkor (Abrahao et al.). Abrahao és munkatársai azonban tárgyalják az ANKCLP létezését, amely a Hsp78 és a Hsp104 mellett jelenik meg a protozoonokban, és túlélte az evolúciós átmenetet a metazoa felé. Az ANKCLP a Hsp104 és a Hsp78 nukleotidkötő domén 2 (NBD2) doménjéhez hasonló AAA+ doménnel rendelkezik, de egyébként nagymértékben eltér. Érdekes módon az ANKCLP mutációi emberben 3-metilglutaconsavuriát, progresszív agysorvadást, értelmi fogyatékosságot, veleszületett neutropeniát, szürkehályogot és mozgászavart okoznak (Abrahao és mtsai.).
p97
A “Structure and Function of p97 and Pex1/6 Type II AAA+ Complexes” című áttekintésükben Saffert és munkatársai két különböző AAA+ komplexet tárgyalnak, amelyek ubikvitinált szubsztrátfehérjéket alakítanak át (Saffert és munkatársai). A p97 egyik funkciója, hogy az ER-hez kapcsolódó degradáció során az ubikvitinált szubsztrátokat az ER-membránból a proteaszómába diszlokálja (Saffert et al.). Ezzel szemben a Pex1/Pex6 egy heterohexamer motor, amely váltakozó Pex1 és Pex6 alegységekből áll, és elengedhetetlen a peroxiszóma biogeneziséhez és működéséhez. A p97 és a Pex1/6 legújabb krio-elektronmikroszkópos (krio-EM) szerkezeteit tárgyalják, és kiemelik a legfontosabb szerkezeti különbségeket.
“A Mighty ‘Protein Extractor’ of the Cell: Structure and Function of the p97/CDC48 ATPase” című áttekintésükben Ye és munkatársai összefoglalják a p97 szerkezetéről és funkciójáról, valamint számos betegségben betöltött szerepéről szóló jelenlegi ismereteket (Ye és munkatársai). A p97 két AAA+ doménnel rendelkezik, amelyeket egy rövid linker köt össze. Van egy N-terminális doménje is, amely a különböző adaptorfehérjékkel való kölcsönhatásait közvetíti. A szerzők részletesen tárgyalják a p97 szerkezetét és a nukleotidok hatását a különböző konformációira. Ezek a vizsgálatok olyan technikák alkalmazásán alapulnak, mint az EM, a röntgenkrisztallográfia és a nagysebességű atomerő-mikroszkópia. A szerzők ezután tárgyalják ennek az erősen konzervált fehérjének a multicelluláris funkcióit, beleértve az ER-asszociált fehérjebontásban (ERAD), a mitokondrium-asszociált lebontásban (MAD) a polipeptidek mitokondriális külső membránból való kivonásával, valamint a riboszóma-asszociált lebontásban (RAD) betöltött szerepét. Végül Ye és munkatársai összefoglalják a p97 mutációit, amelyek számos emberi betegséghez vezetnek, mint például az IBMPFD (Inclusion Body Myopathy associated with Paget’s disease of the bone and Frontotemporal Dementia)], FALS (familial amyotrophic lateral sclerosis), CMT2Y (Charcot-Marie-Tooth disease, type 2Y), herediter spastic paraplegias (HSP), Parkinson-kór (PD) és Alzheimer-kór (AD).
“A kofaktor-interakciók és poszttranszlációs módosítások kölcsönhatása a p97 AAA+ ATPáz szabályozásában” című, a p97-ről szóló áttekintésükben Hänzelmann és Schindelin azt tárgyalják, hogy a különböző kofaktorok hogyan modulálják a p97 ATPáz aktivitását (Hanzelmann és Schindelin). Kiemelik, hogy a p97 azon képessége, hogy számos sejtfolyamatban részt vesz, a fehérjével kölcsönhatásba lépő kofaktorok nagy számának köszönhető. A p97 kofaktorok három különböző osztályát tárják fel, nevezetesen: (ii) szubsztrát-feldolgozó kofaktorok, mint az UBA-UBX fehérjék és az UFD1-NPL4, (iii) szabályozó kofaktorok, mint az UBX fehérjék, amelyek szekvenálhatják vagy újrahasznosíthatják a p97 hexamereket. A szerzők kitérnek a poszttranszlációs módosítások szerepére is a p97 aktivitásában, valamint a kofaktorokkal és szubsztrátokkal való kölcsönhatásaira.
AAA+ Proteins of the Proteasome
Az “AAA-ATPases in Protein Degradation,” Yedidi et al. áttekintik az Rpt1, Rpt2, Rpt3, Rpt4, Rpt5 és Rpt6 aktivitását, amelyek az eukarióta proteaszóma AAA+ ATPázai, valamint néhány bakteriális rokonuk, mint a PAN, Mpa és VAT (Yedidi et al.). Új technológiákra összpontosítanak, hogy megértsék, hogyan működnek ezek az AAA+ ATPázok azáltal, hogy a kibontott polipeptideket a proteáz proteolitikus kamrájába transzlokálják (Yedidi és mtsai.). Úgy tűnik, hogy az AAA+ gyűrűn és a szomszédos kamrás proteázon belüli konformációs változások perisztaltikus pumpáló mechanizmust hoznak létre a szubsztrátoknak a lebontáshoz való szállítására (Yedidi et al.).
A “The Proteasomal ATPases Use a Slow but Highly Processive Strategy to Unfold Proteins” című kutatási cikkükben Snoberger et al. megállapítják, hogy a proteaszomális AAA+ fehérjék egy alacsony sebességű, de nagymértékben processzív motoros mechanizmust alkalmaznak a szubsztrátoknak a proteaszóma proteolitikus üregébe történő szállítására (Snoberger et al.). Ez a mechanizmus ellentétben áll a ClpX-szel, amely nagy sebességű, de kevésbé processzív motoros mechanizmust használ a szubsztrátoknak a ClpP-proteázhoz történő szállítására lebontás céljából. Ezek a motoros mechanizmusbeli különbségek a specifikus klienskörük eltérő igényeire adott válaszként fejlődhettek ki.
Rubisco-aktivázok
A Rubisco-aktivázok című áttekintésükben: AAA+ Chaperones Adapted to Enzyme Repair” című cikkében Bhat et al. tárgyalja a Rubisco aktiváz (Rca) egyedülálló funkcióját a Rubisco átalakításában (Bhat et al.). Az Rca egy AAA+ chaperon, amely a fotoszintetikus szervezetekben a baktériumoktól a magasabb rendű növényekig nagymértékben konzerválódott. A Rubisco a ribulóz-1,5-biszfoszfát-karboxiláz/oxigenáz enzim, amely a fotoszintézis során a légköri CO2 megkötésében vesz részt. Ez a Földön a legnagyobb mennyiségben előforduló fehérje, és a bolygón található összes szerves anyag szintézisének kulcsenzime. A Rubisco azonban gyenge enzim, és könnyen gátolják a katalitikus reakcióinak melléktermékei vagy egyes növények által alacsony fényviszonyok között szintetizált vegyületek. Az Rca feladata, hogy enyhítse vagy “kigyógyítsa” a Rubisco-t az ilyen problémás gátlásokból. A szerzők tárgyalják a különböző fajokból származó Rca szerkezetét és működésének lehetséges mechanizmusait.
Dr. Mueller-Cajar áttekintést nyújt “The Diverse AAA+ Machines that Repair Inhibited Rubisco Active Sites” (Mueller-Cajar) címmel. Tárgyalja a Rubisco-aktivázok (Rcas) három evolúciósan különböző osztályának jelenlétét: (1) zöld és (2) vörös típusú Rcas, amelyek főként a zöld és vörös plasztidvonalba tartozó fotoszintetikus eukariótákban találhatók, illetve (3) a kemoautotróf baktériumokban jelen lévő CbbQO. Tárgyalja ezen aktivázok evolúcióját és lehetséges felhasználásukat a szintetikus biológiában a Rubisco aktivitás fokozására a növényekben.
Torsin
A Torsin ATP-ázok című perspektivikus cikkükben: Harnessing Dynamic Instability for Function” című cikkében Chase és munkatársai a torsinokat tárgyalják, amelyek filogenetikai rokonságban állnak az élesztő Hsp104 NBD2-ével is (Chase és munkatársai). A torsinok az egyetlen AAA+ ATPázok, amelyek az ER és a kapcsolódó magburkon belül lokalizálódnak (Chase et al.). Érdekes módon a TorsinA mutációi okozzák a DYT1 dystoniát, egy neurológiai rendellenességet az emberben (Chase és mtsai.). A torsinok gyenge ATPáz-aktivitást mutatnak, amelyet a LAP1 és a LULL1 specifikus járulékos kofaktorokkal való koasszimiláció révén aktívhely-kiegészítéssel fokoznak (Chase és mtsai.). Chase és munkatársai szerint a Torsin/kofaktor-komplexek dinamikus össze- és szétszerelése fontos szerepet játszik a nukleáris forgalomban és a nukleáris pórus-komplex összeszerelésében betöltött funkciójukban (Chase és munkatársai).
Pontin és Reptin
Mao és Houry “A Pontin és Reptin szerepe a sejtfiziológiában és a rák etiológiájában” című terjedelmes áttekintésükben tárgyalják az erősen konzervált Pontin és Reptin AAA+ ATP-ázok sokrétű funkcióit (Mao és Houry). Ez a két fehérje jellemzően együtt, komplexként működik, de egymástól függetlenül is működhet. A szerzők kiemelik a Pontin és a Reptin szerepét a kromatin átalakításában. Kitérnek arra is, hogy a Pontin és a Reptin hogyan modulálja számos proto-onkogén, például a MYC és a β-katenin transzkripciós aktivitását. Mao és Houry megvilágítják, hogy a Pontin és a Reptin szükségesnek bizonyult a PIKK jelátviteli komplexek, valamint a telomeráz, a mitotikus orsó, az RNS-polimeráz II és a snoRNP-k összeszereléséhez. A szerzők végezetül áttekintik a Pontin és Reptin gátlóinak azonosítására irányuló jelenlegi erőfeszítéseket, amelyeket új rákellenes szerekként kívánnak kifejleszteni.
Záró megjegyzések
Ez a 21 cikkből álló gyűjtemény a fehérjék javításában és lebontásában részt vevő AAA+ fehérjék számos fontos szerkezeti és mechanikai aspektusára világít rá. Izgatottan várjuk, hogyan fog tovább fejlődni a terület a folyamatban lévő krio-EM forradalom során (Egelman, 2016). Arra számítunk, hogy a cryo-EM lehetővé teszi majd annak mélyebb megértését, hogy ezek a lenyűgöző molekuláris gépek hogyan működnek különböző helyzetekben (Gates et al., 2017; Puchades et al., 2017; Ripstein et al., 2017; Zehr et al., 2017).
A szerzők hozzájárulása
A felsorolt szerzők mindegyike jelentősen, közvetlenül és intellektuálisan hozzájárult a munkához, és jóváhagyta annak közzétételét.
Érdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
A köszönetnyilvánítás
A WH laboratóriumában ezen a területen végzett munkát a Canadian Institutes of Health Research Project Grant (PJT-148564) finanszírozza. JS munkáját az NIH R01GM099836 számú ösztöndíja támogatja.
Egelman, E. H. (2016). A krio-EM jelenlegi forradalma. Biophys. J. 110, 1008-1012. doi: 10.1016/j.bpj.2016.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Erzberger, J. P., and Berger, J. M. (2006). Az AAA+ fehérjék evolúciós kapcsolatai és szerkezeti mechanizmusai. Annu. Rev. Biophys. Biomol. Struct. 35, 93-114. doi: 10.1146/annurev.biophys.35.040405.101933
PubMed Abstract | CrossRef Full Text | Google Scholar
Finn, R. D., Attwood, T. K., Babbitt, P. C., Bateman, A., Bork, P., Bridge, A. J., et al. (2017). InterPro 2017-ben – a fehérjecsalád és a domén annotációkon túl. Nucleic Acids Res. 45, D190-D199. doi: 10.1093/nar/gkw1107
PubMed Abstract | CrossRef Full Text | Google Scholar
Gates, S. N., Yokom, A. L., Lin, J., Jackrel, M. E., Rizo, A. N., Kendsersky, N. M., et al. (2017). Az AAA+ dezaggregáz Hsp104 AAA+ polipeptid transzlokációs mechanizmusa. Science 357, 273-279. doi: 10.1126/science.aan1052
PubMed Abstract | CrossRef Full Text | Google Scholar
Hanson, P. I., and Whiteheart, S. W. (2005). AAA+ fehérjék: van motor, lesz munka. Nat. Rev. Mol.Cell Biol. 6, 519-529. doi: 10.1038/nrm1684
PubMed Abstract | CrossRef Full Text | Google Scholar
Olivares, A. O., Baker, T. A., and Sauer, R. T. (2016). Mechanisztikus betekintés a bakteriális AAA+ proteázok és fehérje-átalakító gépek működésébe. Nat. Rev. Microbiol. 14, 33-44. doi: 10.1038/nrmicro.2015.4
PubMed Abstract | CrossRef Full Text | Google Scholar
Puchades, C., Rampello, A. J., Shin, M., Giuliano, C. J., Wiseman, R. L., Glynn, S. E., et al. (2017). A mitokondriális belső membrán AAA+ proteáz YME1 szerkezete betekintést nyújt a szubsztrátfeldolgozásba. Science 358:eaao0464. doi: 10.1126/science.aao0464
PubMed Abstract | CrossRef Full Text | Google Scholar
Ripstein, Z. A., Huang, R., Augustyniak, R., Kay, L. E., and Rubinstein, J. L. (2017). Egy AAA+ unfoldáz szerkezete a szubsztrát kibontása során. Elife 6:e25754. doi: 10.7554/eLife.25754
PubMed Abstract | CrossRef Full Text | Google Scholar
Snider, J., Thibault, G., and Houry, W. A. (2008). A funkcionálisan változatos fehérjék AAA+ szupercsaládja. Genome Biol. 9:216. doi: 10.1186/gb-2008-9-4-216
PubMed Abstract | CrossRef Full Text | Google Scholar
Zehr, E., Szyk, A., Piszczek, G., Szczesna, E., Zuo, X., and Roll-Mecak, A. (2017). A katanin spirális és gyűrűs struktúrái rávilágítanak a mikrotubulusok leválasztásának erővonalára. Nat. Struct. Mol. Biol. 24, 717-725. doi: 10.1038/nsmb.3448
PubMed Abstract | CrossRef Full Text | Google Scholar