Introduction
Serotonin (5-hydroxytryptamine, 5-HT) 2C receptorok (5-HT2CR) széles körben elterjedtek az agyban, és közvetítik az 5-HT szabályozó hatásait a szorongásra, az alvásra, a hormonális szekrécióra, a táplálkozási viselkedésre, a mozgásszervi aktivitásra, valamint a tanulási és emlékezeti folyamatokra (Bagdy, 1998; Chagraoui et al., 2016). Az 5-HT2CR diszfunkciót patológiás állapotokban, például szorongásban és depresszióban is szerepet játszanak (Chagraoui et al., 2016; Di Giovanni and De Deurwaerdere, 2016). Másrészt számos antidepresszáns, anxiolitikum és antipszichotikum rendelkezik affinitással az 5-HT2CR-hez, ami részt vehet e gyógyszerek terápiás hatásaiban (Bagdy és mtsai., 2001; Chagraoui és mtsai., 2016; Di Giovanni és De Deurwaerdere, 2016). Így az 5-HT2CR ígéretes farmakológiai célpontot jelent számos neuropszichiátriai rendellenesség kezelésében (Chagraoui et al., 2016; Di Giovanni és De De Deurwaerdere, 2016).
Az 5-HT2CR-ek stimulációját szorongás kiváltására írták le, és viszont az altípusszelektív 5-HT2CR-antagonisták, mint az SB-242084, kifejezett anxiolitikus hatást fejtettek ki (Dekeyne és mtsai., 2000; Bagdy és mtsai., 2001; Kantor és mtsai., 2005). A szelektív 5-HT2CR-antagonisták, az RS-102221 és az SB-242084 gyorsan fellépő antidepresszáns-szerű hatást fejtettek ki egerekben (Opal és mtsai., 2014). Emellett az 5-HT2CR-antagonizmus potenciálta a fluoxetin, egy szelektív szerotonin visszavétel gátló (SSRI) anxiolitikus és antidepresszáns hatását, ráadásul csökkentette a motoros mellékhatásokat egerekben (Demireva és mtsai., 2018). Fontos, hogy az 5-HT és a dopamin (DA) rendszerek kölcsönhatása feltételezhetően hozzájárul ezekhez a hatásokhoz (De De Deurwaerdere és Di Giovanni, 2017).
Az elektroenkefalogram (EEG) különböző paramétereit mind az ébrenlét, mind az alvás során leírták, amelyek a depresszió és az egyénre szabott antidepresszáns terápia biomarkerei (Steiger és Kimura, 2010). A gammaoszcillációk az EEG viszonylag magas frekvenciájú (>30 Hz) komponensei, amelyek fontos támpontokat nyújtanak a neuronpopuláció dinamikájáról (Buzsaki és Wang, 2012). A gamma-oszcillációkat az érzékszervi és kognitív funkciókkal, valamint a neurális plaszticitással és a memóriával hozták összefüggésbe állatokban és emberekben (Cardin, 2016). Másrészt az abnormális gamma-aktivitás számos pszichiátriai betegségben is szerepet játszik (Cardin, 2016). A gamma aktivitásnak a depresszió patomechanizmusában való részvételére utaló egyre több bizonyíték alapján a gamma oszcillációk változását a közelmúltban a major depresszió új biomarkerének (vagy endofenotípusának) javasolták, sőt az antidepresszáns terápiák nyomon követésére is (Fitzgerald és Watson, 2018). Számos antidepresszánsról kimutatták, hogy megváltoztatja a gammaaktivitást (Fitzgerald és Watson, 2018). Például az SSRI eszcitalopram akut kezelés során csökkentette a gammateljesítményt a gyors szemmozgásos alvás (REMS) során, míg a krónikus eszcitalopram növelte a gammateljesítményt a lassú hullámú alvás szakaszaiban (Papp és mtsai., 2018). Továbbra is nyitott kérdés azonban, hogy a gamma-aktivitás gyógyszer okozta változásai a különböző éberségi szakaszokban a terápiás hatás indikátorai vagy ok-okozati közvetítői, vagy a mellékhatások jelei (Fitzgerald és Watson, 2018).
Tudomásunk szerint az irodalomban hiány van a szelektív 5-HT2CR-antagonisták gamma-oszcillációkra gyakorolt hatásait illetően emberekben és rágcsálókban. Ezért itt azt vizsgáljuk, hogy a gammateljesítmény (30-60 Hz) hogyan változik különböző éberségi szakaszokban (i) a nagy szelektivitású 5-HT2CR-antagonista SB-242084 akut adagolása, (ii) a széles körben használt SSRI eszcitalopram krónikus adagolása, (iii) és ezek kombinációja által.
Módszerek
A kísérletekben a helyi Állattartó telepről (Semmelweis Egyetem, Budapest, Magyarország) vásárolt hím Wistar patkányokat használtunk. Az állatokat ellenőrzött környezeti körülmények között tartottuk (21 ± 1°C, 12/12 órás fény-sötét ciklus, a lámpákat 10 órakor kapcsoltuk be), és szabad hozzáférést biztosítottak standard rágcsálótakarmányhoz és csapvízhez. Minden tartási körülményt és állatkísérletet az EU 2010/63/EU irányelv és a National Institutes of Health “Principles of Laboratory Animal Care” (NIH Publications No. 85-23, revised 1985), valamint a speciális nemzeti jogszabályok (a magyar kormány állatkísérletekről szóló 40/2013-as rendelete) szerint végeztünk. A kísérleteket az Állatkísérletek Országos Tudományos Etikai Bizottsága hagyta jóvá. Minden erőfeszítést megtettünk az állatok fájdalmának és kényelmetlenségének minimalizálására.
Elektroenkefalográfiás (EEG) és elektromiográfiás (EMG) elektródákat ültettünk be 2%-os halotán altatásban, a korábban leírtak szerint (Jakus et al., 2003). A patkányok súlya a műtétkor 250-280 g volt. Az EEG-hez rozsdamentes acélcsavaros elektródákat helyeztünk be epidurálisan a bal frontális kéreg (L: 2,0 mm, A: 2,0 mm a bregmáig), a bal parietális kéreg (L: 2,0 mm, A: 2:0 mm a lambdáig) és a kisagy fölé földelő elektródaként. Az EMG-hez egy pár EMG-elektródát (szilikongumival borított rozsdamentes acél rugós elektródák, Plastics One Inc., Roanoke, VA, USA) helyeztünk a nyaki izomzatba. A regenerálódás után (7 nap) a patkányokat a ketrecek fölé rögzített felvevőkábellel és elektromos forgatókarral csatlakoztattuk az EEG-rendszerhez. Az állatok az egész vizsgálat alatt csatlakoztatva maradtak.
A krónikus előkezeléshez a patkányok 10 mg/kg/nap eszcitalopram-oxalát oldatot (ESC Gedeon Richter Nyrt., Magyarország, 0,3 N HCl desztillált vízben oldva) vagy hordozót (VEH; 0,3 N HCl desztillált vízben oldva) kaptak ozmotikus minipumpán (2ML4, ALZET, 2,5 μl/h, DURECT Corporation, USA) keresztül 21 napon keresztül. A 21. napon a patkányok 1 mg/ttkg SB-242084-et vagy vivőanyagot kaptak intraperitoneális injekcióban 1 ml/kg testtömeg mennyiségben. A patkányokat véletlenszerűen négy csoportra osztották az alábbiak szerint: VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6) és ESC+SB (n = 6).
Az EEG-t, az EMG-t és a motoros aktivitást az injekciók után legalább 3 órán keresztül rögzítettük, a fény kezdetétől kezdve. A jeleket analóg szűrőkkel erősítettük (Coulburn Lablinc System, USA; 0,50 Hz alatti és 100 Hz feletti szűrés 6 dB/oktávval), és analóg-digitális átalakításnak vetettük alá (MVRD-2200 V, Canopus, Japán) 128 Hz-es mintavételi sebességgel. Az adatokat számítógépen tároltuk a további feldolgozáshoz.
A poligráfiás felvételeket a Sleep Sign for Animal (Kissei Comtec America Inc., USA) szoftver automatikus pontozási funkciójával pontoztuk 4 s-os epochákra, majd vizuális felügyeletet végeztünk. A hagyományos kritériumok (Kantor et al., 2004) alapján hat virrasztási szakaszt különböztettünk meg az alábbiak szerint (a reprezentatív nyomvonalakat lásd az 1. kiegészítő ábrán). Aktív ébrenlétben (AW) az EEG-t alacsony amplitúdójú aktivitás jellemzi a béta (14-29 Hz) és alfa (10-13 Hz) frekvenciákon, intenzív EMG és motoros aktivitás mellett. Passzív ébrenlétben (PW) az EEG-mintázat az AW-hez hasonló, viszonylag magas EMG-aktivitással és minimális vagy semmilyen motoros aktivitással kísérve. Könnyű lassú hullámú alvásban (SWS-1) az EEG-t nagy amplitúdójú lassú agykérgi hullámok (0,5-4 Hz) jellemzik, amelyeket orsók (6-15 Hz) szakítanak meg, csökkent EMG-aktivitás és motoros aktivitás nélkül. Mély lassú hullámú alvásban (SWS-2) az EEG-t folyamatos, nagy amplitúdójú lassú agykérgi hullámok uralják, csökkent EMG-tevékenységgel és motoros aktivitás nélkül. Az alvás köztes szakaszában (IS), amely többnyire a REMS előtt vagy után következik be, az EEG-t nagy amplitúdójú orsók és théta (5-9 Hz) hullámok társulása jellemzi. REMS-ben az EEG-t alacsony amplitúdójú és nagyfrekvenciás aktivitás uralja, szabályos théta-hullámokkal, a csendes EMG és az alkalmi izomösszehúzódással (rángással) járó motoros aktivitás mellett. Az artefaktumokkal szennyezett vagy az éberségi szakaszok közötti átmenetet tartalmazó epochákat elvetettük.
A kvantitatív EEG (qEEG) elemzést gyors Fourier-transzformációval (Hanning-ablak, 0,25 Hz frekvenciafelbontás) számítottuk ki egymást követő 4-s epochákra a 0,5-60 Hz frekvenciatartományban. A szomszédos 0,25 Hz-es rekeszeket 1 Hz-es rekeszekké összegeztük, amelyeket felső határukkal jelöltünk. Az AW, PW, SWS-1, SWS-2, IS és REMS epochák teljesítményértékeit külön-külön átlagoltuk az összegzett 3 órában, illetve a kezelések utáni első, második, illetve harmadik órában, hogy teljesítménysűrűségi értékeket kapjunk ezekre az alvás-ébrenlét szakaszokra. Ebben a jelentésben az EEG teljesítményspektrumának 30-60 Hz-es frekvenciatartományára összpontosítottunk. A 49-51 Hz-en belüli adatokat kizártuk az elemzésből, hogy elkerüljük az elektromos hálózatból származó 50 Hz-es interferenciazaj szennyeződését. Minden adatot log-transzformáltunk az elemzés előtt.
A teljesítményspektrum-elemzéshez a csoportok közötti összehasonlításokat kétirányú ANOVA-val végeztük ismételt méréseken, két fő faktorral: kezelés (nem ismételt) és gammafrekvenciás bárok (ismételt), amelyet Bonferroni post hoc teszt követett. A kezelés hatásainak vizsgálatához minden egyes h-ban az összesített 30-60 Hz-es teljesítményadatokat (kivéve a 49-51 Hz-eseket) egyirányú ANOVA-val elemeztük, az AW, PW, SWS-1, SWS-2, IS és REMS tekintetében. A szignifikáns fő kezelési hatás észlelését követően post hoc Newman-Keuls teszteket végeztünk. A statisztikai szignifikanciát akkor fogadtuk el, ha p < 0,05.
Kísérleti elrendezésünkben a kontroll patkányok (VEH+veh) ugyanazoknak az eljárásoknak voltak kitéve, mint a gyógyszerrel kezeltek. Így a gyógyszerrel kezelt csoportok és a kontrollcsoport összehasonlításának célja az injekciók és a minipumpák jelenléte által okozott distressz minimalizálása, ami lehetővé teszi a gyógyszerek hatásainak vizsgálatát. A spektrális grafikonok esetében a jobb láthatóság érdekében (mivel az EEG-teljesítményadatok a frekvenciák növekedésével csökkenő tendenciát követnek) a gyógyszerrel kezelt patkányok teljesítményértékeit a kontrollcsoport (VEH+veh csoport) átlagos teljesítményspektrális értékeire normalizáltuk, így relatív adatokat mutattunk. Az abszolút adatokat az oszlopdiagramokon összegzett teljesítményértékek formájában mutatjuk be. Az adatokat csoportonként hat állat átlaga ± SEM-ben fejeztük ki.
Eredmények
A gyógyszerek (akut SB-242084, krónikus eszcitalopram és ezek kombinációja) qEEG-re gyakorolt hatását a 30-60 Hz-es gamma-tartományban a hat virrasztási szakaszra külön-külön értékeltük a passzív fázis első 3 órájának teljesítményadatainak átlagolásával (1. ábra). Az elemzés kimutatta, hogy az összes gyógyszer vigilanciafázis-függő változásokat okozott ebben a frekvenciatartományban, tendenciaszerű emelkedéssel minden egyes fázisban, a VEH+veh csoporthoz képest.
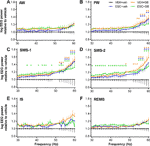
1. ábra EEG teljesítményváltozások a gamma frekvenciatartományban (30-60 Hz) az akut SB-242084 (VEH+SB), a krónikus eszcitalopram (ESC+veh) és ezek kombinációja (ESC+SB) adását követően a passzív fázis első 3 órájában. A teljesítményspektrumokat a következő hat éberségi szakaszban mutatjuk be: (A) aktív (AW) és (B) passzív ébrenlét (PW), (C) könnyű (SWS-1) és (D) mély lassú hullámú alvás (SWS-2), (E) köztes szakasz (IS) és (F) gyors szemmozgásos alvás (REMS). Az EEG-teljesítményadatok átlag ± SEM-ben vannak feltüntetve, a VEH+veh kontrollcsoporthoz viszonyítva (n = 6 állat csoportonként). *Szignifikáns post hoc eredmények a kontrollhoz képest, p < 0,05.
Az AW alatt az ANOVA eredmények nem mutattak szignifikáns változásokat (kezelés hatása: F3,20 = 1,917, p = 0,1594; kezelés x gyakoriság kölcsönhatás: F81,540 = 1,218, p = 0,1081; 1A ábra). PW alatt azonban mérsékelten emelkedett teljesítményvonal volt megfigyelhető az SB csoportokban, és a magasabb frekvenciákon az ESC+veh csoportban is (kezelés hatása: F3,20 = 2,217, p = 0,1176; szignifikáns kezelés x frekvencia kölcsönhatás: F81,540 = 2,519, p < 0,001; 1B ábra).
A legkiemelkedőbb hatások a lassú hullámú alvási szakaszokban voltak megfigyelhetők, ahol az akut SB-242084, a krónikus eszcitalopram és a kombinált kezelés is teljesítményemelkedést okozott. Ezt támasztották alá a szignifikáns ANOVA eredmények az SWS-1-ben (kezelés hatása: F3,20 = 3,692, p = 0,0290; szignifikáns kezelés x frekvencia kölcsönhatás: F81,540 = 2,693, p < 0,001; 1C ábra), és az SWS-2-ben (szignifikáns kezelési hatás: F3,20 = 4,787, p = 0,0113; szignifikáns kezelés x gyakoriság kölcsönhatás: F81,540 = 1,911, p < 0,001; 1D ábra).
A gammateljesítmény növekedése nem volt szignifikáns az IS alatt (kezelés hatása: F3,20 = 2,349, p = 0,1031, kezelés x frekvencia kölcsönhatás: F81,540 = 1,241, p = 0,0878; 1E ábra). Végül, a REMS alatt sem az akut SB-242084, sem a krónikus eszcitalopram nem befolyásolta az EEG teljesítményét ebben a frekvenciatartományban (kezelés hatása: F3,19 = 2,515, p = 0,0891; kezelés x frekvencia kölcsönhatás: F81,513 = 1,226, p = 0,1014; 1F ábra). Megjegyezzük, hogy az ESC+SB csoportban csak n = 5 állat adatait használtuk fel, mivel egy állat ebben az időintervallumban nem töltött időt REMS-ben.
A fent leírt szignifikáns kétirányú ANOVA eredmények utáni szignifikáns Bonferroni post hoc különbségeket lásd az 1. ábrán az egyes éberségi szakaszokra vonatkozóan. A VEH+SB vs. ESC+veh, VEH+SB vs. ESC+SB, illetve ESC+veh vs. ESC+SB összehasonlítások tekintetében egyik szakaszban sem volt szignifikáns post hoc különbség.
A gyógyszerek alvás-ébrenlét szakaszoktól függő hatásait a teljes gamma teljesítményre óránként elemeztük. Az egyirányú ANOVA kimutatta, hogy bár az SWS-1 első órájában a kezelés hatása még nem volt szignifikáns (F3,20 = 2,544, p = 0,0851), a második (F3,20 = 3,331, p = 0,0403) és harmadik órában (F3,20 = 4,607, p = 0,0131) a teljesítményemelkedések szignifikánsak voltak. Az SWS-2-ben az ANOVA szignifikáns kezelési hatásokat mutatott minden egyes h-ban (F3,18 = 4,062, p = 0,0228; F3,20 = 5,348, p = 0,0072; F3,20 = 4,910, p = 0,0102). Szintén szignifikáns hatást találtunk az IS második órájában (F3,20 = 3,452, p = 0,0360), de nem az első vagy a harmadik órában. Végül, nem találtunk szignifikáns kezelési hatást ezekben az órákban az AW, PW és REMS esetében. A szignifikáns post hoc eredményeket lásd a 2. ábrán az egyes éberségi szakaszokra vonatkozóan.
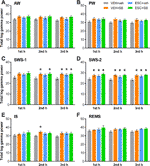
2. ábra Teljes EEG teljesítmény a gamma frekvenciatartományban (30-60 Hz) az akut SB-242084 (VEH+SB), a krónikus eszcitalopram (ESC+veh) és ezek kombinációja (ESC+SB) beadását követően az első, a passzív fázis második és harmadik órájában, (A) aktív (AW) és (B) passzív ébrenlét (PW), (C) könnyű (SWS-1) és (D) mély lassú hullámú alvás (SWS-2), (E) köztes szakasz (IS) és (F) gyors szemmozgásos alvás (REMS) során. Az összesített EEG-teljesítményadatok átlag ± SEM (n = 6 állatból csoportonként). *Szignifikáns post hoc eredmények a kontrollcsoporthoz (VEH+veh) képest, p < 0,05.
Diszkusszió
Ez az első tanulmány, amely a szelektív 5-HT2CR-antagonista SB-242084 akut hatását vizsgálja az EEG spektrum gamma frekvenciasávjára különböző virrasztási szakaszokban. Ezenkívül krónikus SSRI előkezeléssel vagy anélkül is vizsgálták. Itt arról számolunk be, hogy az SWS-2, SWS-1 és PW során az SB-242084, (1 mg / kg, ip.) akut beadását követően patkányokban a gamma-sáv teljesítménye megnövekedett. Az escitaloprammal (10 mg/kg/nap, ozmotikus minipumpa) végzett további 21 napos előkezeléssel kapcsolatos eredményeink azt mutatják, hogy az SB-242084 nem módosította tovább a krónikus antidepresszáns kezelés által megváltoztatott gamma teljesítményt. Sőt, az SB-242084 akut hatása és az eszcitaloprám krónikus hatása a gammateljesítményre nagyon hasonlónak tűnt a legtöbb éberségi szakaszban. A két kezelés kombinációjának hatásait azonban nem tekintették additívnak.
A gammaaktivitással kapcsolatos agyi funkciókat a bevezető részben tárgyaltuk. A gamma-oszcillációkat az agy számos területén leírták, például a neokortexben, az entorhinális kéregben, a hippokampuszban, a talamuszban, az amygdalában, a szaglógumóban és a striatumban. Keletkezésük a periszomatikus gátláshoz kötődik; leginkább a parvalbumin-pozitív interneuronok aktivitásához a gamma-aminovajsav (GABA)A szinapszisokon keresztül (Buzsaki és Wang, 2012). Úgy gondolják, hogy a gamma-oszcillációk fontos szerepet játszanak a depresszióban, amit emberi és állati leletek is alátámasztanak. Ugyanis gamma-rendellenességeket mértek depressziós betegeknél, valamint a depresszió állatmodelljeiben is, ahol a gamma változásait a terápiás gyógyulással hozták összefüggésbe (Khalid és mtsai., 2016; Noda és mtsai, 2017; Fitzgerald és Watson, 2018).
A depresszió különböző farmakológiai (a szerotonin-, noradrenalin-, dopamin- és glutamátrendszereket célzó) és nem farmakológiai kezelésekről kimutatták, hogy megváltoztatják a gammaaktivitást (Fitzgerald és Watson, 2018). Például az eszcitalopram, a szerotonerg rendszerre ható, széles körben alkalmazott SSRI antidepresszáns akut kezeléssel csökkentette a REMS alatti gammateljesítményt, míg krónikus adagolása a lassú hullámú alvás szakaszaiban növelte a gammateljesítményt, patkányoknál (Papp és mtsai., 2018). Fontos, hogy a noradrenerg rendszerre ható antidepresszánsok, mint a reboxetin és a desipramin, akut kezelést követően növelték a gamma (valamint a théta) teljesítményt a septo-hippocampális rendszerben, míg az SSRI fluvoxamin ugyanebben a vizsgálatban nem produkált ilyen hatást (Hajos és mtsai., 2003a). A feltételezett új generációs antidepresszánsok, mint például a ketamin és metabolitja, a (2R,6R)-hidroxinorketamin, antidepresszáns szempontból releváns dózisokban alkalmazva kimagaslóan fokozzák a gammateljesítményt. Ezeket a hatásokat és az antidepresszáns-szerű hatásukat is megakadályozta az α-amino-3-hidroxi-5-metil-4-izoxazol-propionsav receptor (AMPAR) gátlóval történő előkezelés (Zanos és mtsai., 2016). Végül Fitzgerald és Watson nemrégiben azt javasolta, hogy a gamma jelátvitel az összes antidepresszáns osztály antidepresszáns hatásának biomarkere lehet, mivel hipotézisük szerint az antidepresszánsok minden osztályának közös végső hatásai lehetnek a limbikus áramkörökre (Fitzgerald és Watson, 2019).
Ebben a tanulmányban az 5-HT-rendszerre ható gyógyszereket vizsgáltuk, nevezetesen az 5-HT2CR antagonistáját és egy SSRI-t, amelyek fő hatása az 5-HT extracelluláris szintjének növelése az 5-HT szinaptikus visszavételének az 5-HT-transzporteren keresztül történő gátlása révén. Egyre több bizonyíték utal arra, hogy az 5-HT2CR-antagonizmus kedvező hatást fejthet ki a depresszió és a szorongás terápiájában, bár a szelektív 5-HT2CR-antagonisták ezen hatásait klinikai vizsgálatokban még nem tesztelték. Az 5-HT2CR-antagonisták SSRI-okkal való kombinációjának jelentőségét alátámasztja, hogy az SB-242084 vagy RS-102221 szelektív 5-HT2CR-antagonisták SSRI citaloprammal való akut együttes alkalmazása növelte a citalopram által kiváltott 5-HT-szint emelkedést a depressziós zavarok patofiziológiájában szerepet játszó régiókban, egy patkányokon végzett mikrodialízis vizsgálatban (Cremers és mtsai., 2004). Az SB-242084 előkezelés szintén visszafordította a félelemkifejezés akut citalopram által kiváltott fokozódását patkányokban (Burghardt és mtsai., 2007). Továbbá egy nemrégiben megjelent tanulmány kimutatta, hogy a krónikus (21 napos) fluoxetin kezelést követő akut SB-242084 kezelés csökkentette a szorongás- és depresszió-szerű viselkedést, és javította az SSRI által kiváltott mellékhatásokat egerekben (Demireva et al., 2018).
A jelen vizsgálatban 1 mg/kg SB-242084 dózist választottunk a rágcsálókon végzett korábbi viselkedési (Kennett et al., 1997; Martin et al., 2002; Opal et al., 2014) és alvási és/vagy EEG (Popa et al., 2005; Sorman et al., 2011; Bogathy et al., 2019) vizsgálatok alapján. Fontos, hogy Kantor és munkatársai kimutatták, hogy bár a gyógyszer 0,3 és 1,0 mg/kg dózisai hasonló anxiolitikus hatást eredményeztek, csak a nagyobb dózis befolyásolta kiemelkedően az alvás-ébrenlét architektúrát (ébredést elősegítő hatás az SWS-2 csökkenésével), Sprague-Dawley patkányokban (Kantor és munkatársai, 2005). Wistar patkányokban 1 mg/kg dózisban REMS-csökkentő hatást találtak, és az AW és a REMS alatti théta teljesítmény emelkedését is megfigyelték ezt a kezelést követően (Kostyalik és mtsai., 2014).
Az SB-242084 és az eszcitalopram gamma-aktivitásra gyakorolt hatását külön elemeztük az éberségi szakaszokban, mivel az agyi funkciók és a kapcsolódó oszcillációs aktivitás, valamint a neurotranszmitterszintek jellegzetes különbségeket mutatnak a szakaszok között. A gamma-oszcillációk szerepe az ébrenléthez kapcsolódó funkciókban, mint például a fókuszált figyelem, a kogníció és az érzékszervi feldolgozás, jól dokumentált (Cardin, 2016), azonban alvás közbeni funkcionális jelentőségük kevésbé ismert. A REMS alatt a gamma-oszcillációknak (a théta-oszcilláción túl) a memóriakonszolidációban betöltött szerepét feltételezték (Montgomery és mtsai., 2008). Egy nemrégiben megjelent tanulmány azt javasolta, hogy a megnövekedett gamma teljesítmény a fázisos REMS mikroállapotban bizonyos területeken az érzelmi feldolgozáshoz kapcsolódik, emberekben (Simor et al., 2019). A nem REMS során a gamma oszcillációk a lassú oszcillációk során a neurális aktivitás fázisos növekedéséhez kapcsolódhatnak (Valderrama et al., 2012). Egy mikroelektród-vizsgálat majmokon és embereken tovább hangsúlyozta a gamma (és béta) oszcillációk szerepét a nem-REMS során, nevezetesen a magas oszcillációs koherencia azt sugallja, hogy a gamma hozzájárulása hozzájárulása a memória konszolidációhoz a memória konszolidációhoz a nem-REMS során (Quyen et al., 2016).
Megállapítottuk, hogy az SB-242084 egyszeri dózisa megemelte a gamma teljesítményét az SWS-2, SWS-1 és – kisebb mértékben – a PW alatt, de nem a REMS, IS és AW alatt.
Az 5-HT neuronok az ébrenlét alatt tüzelnek a legaktívabban, aktivitásuk csökken a lassú hullámú alvás alatt, és elhallgat a REMS alatt. Az 5-HT rendszert ezért az alvás-ébrenlét viselkedés (Monti, 2011) és az agyi oszcillációk kulcsfontosságú modulátorának tekintik, bár az ezekben a folyamatokban részt vevő sejtmechanizmusok és receptorok összetettek és kevéssé ismertek (Puig és Gener, 2015). Úgy találták, hogy az 5-HT önmagában befolyásolja a gamma-aktivitást a patkány prefrontális kéregben az 5-HT1AR-okon és az 5-HT2AR-okon keresztül, de nem az 5-HT2CR-eken keresztül, ami az amplitúdó általános csökkenését eredményezi altatott patkányokban (Puig és mtsai., 2010). Továbbá egyre több bizonyíték támasztja alá a DA-rendszer fontosságát a gyorsan tüskésedő interneuronok szinkronizálásában, ezáltal a gamma-oszcillációk generálásában/szabályozásában (Furth et al., 2013).
Az 5-HT2CR feltehetően az 5-HT receptor altípusa, amely a legelterjedtebb eloszlással rendelkezik az agyban. Számos régióban leírták a GABAerg interneuronokon, és a DA neuronok is expresszálják. Ezt a receptor altípust azonban az 5-HT és a noradrenerg (NA) neuronok nem fejezik ki. Az 5-HT2CR-ek szerepét a monoaminerg és érdekes módon a DA rendszerek modulációjában számos preklinikai vizsgálat hangsúlyozta (Di Giovanni és De De Deurwaerdere, 2016; De De Deurwaerdere és Di Giovanni, 2017). Az 5-HT2CR-ek lokális stimulálása specifikus agyterületeken régiófüggő módon szorongást váltott ki, és viszont az altípus-szelektív 5-HT2CR-antagonisták, mint az SB-242084, kifejezett anxiolitikus hatást fejtettek ki (Bagdy és mtsai., 2001; Di Giovanni és De De Deurwaerdere, 2016). Számos anxiolitikum és antidepresszáns rendelkezik 5-HT2CR-antagonista tulajdonságokkal, például számos triciklikus antidepresszáns, mianserin, mirtazapin, trazodon, nefazodon, fluoxetin és agomelatin (Martin et al., 2014). Másrészt a szelektív 5-HT2CR antagonistákat preklinikai vizsgálatok alapján feltételezett gyorsan ható antidepresszánsokként javasolták (Opal és mtsai., 2014).
Az 5-HT2CR antagonisták, és különösen az SB-242084 minőségi (az alvás-ébrenlét architektúrát befolyásoló) és mennyiségi (a teljesítményspektrumot, azaz az oszcillációkat befolyásoló) alvás-ébrenlét hatásairól néhány tanulmányt publikáltak. Kantor és munkatársai patkányokban vizsgálták az SB-242084 dózisfüggő hatását a szorongásra, az éberségre és a 30 Hz alatti EEG spektrumokra. Ébrenléti állapotban megnövekedett théta teljesítményt találtak (ami egy lehetséges kognitív javító hatásra utal, mivel a théta aktivitás a tanulási és memóriafolyamatokhoz kapcsolódik) már 0,1 mg/kg dózisban is. Ezzel szemben a gyógyszer csak 1 mg/kg dózisnál növelte az ébrenlétet és elnyomta az SWS-2-t a passzív fázis első órájában. Ami a delta, alfa vagy béta frekvenciasávokat illeti az ébrenlét, a REMS, az SWS-1 vagy az SWS-2 során, nem számoltak be szignifikáns változásról (Kantor és mtsai., 2005). Kostyalik és munkatársai leírták, hogy az SB-242084 megemelte a PW időtartamát, és elnyomta a REMS-t, amely hatást krónikus ESC előkezeléssel enyhítették patkányokban. A qEEG tekintetében fokozott théta teljesítményt találtak az AW és a REMS alatt is, amelyet a krónikus eszcitalopram előkezelés nem módosított tovább (Kostyalik és mtsai., 2014). Az 5-HT2CR-antagonista théta-erősítő hatását és így az 5-HT2CR szerepét a théta-aktivitás szabályozásában Hajos és munkatársai (2003b) is alátámasztották.
Az escitalopram és más SSRI-k alvás-ébrenlét architektúrára és EEG-paraméterekre gyakorolt hatását embereken és rágcsálókon szélesebb körben vizsgálták (Wilson és Argyropoulos, 2005; Vas és mtsai., 2013; Fitzgerald és Watson, 2019). Nemrégiben beszámoltunk a gammateljesítmény változásáról patkányok akut (REMS alatti csökkenés) és krónikus (SWS-1 és SWS-2 alatti emelkedés) beadását követően (Papp et al., 2018).
Érdekes, hogy az SB-242084 akut hatásai hasonlóak voltak a krónikus escitalopram által okozott hatásokhoz, más szóval az 5-HT2CR szelektív antagonizmusa hasonló hatásokat eredményezett a gammaaktivitásra, mint az 5-HT-transzporter krónikus blokkolása és az escitalopram által kifejtett további hatások. Ebben az esetben feltételezzük, hogy az 5-HT hatásai, nevezetesen az 5-HT1AR (és valószínűleg az 5-HT2AR) deszenzitizációja magyarázhatja a gammateljesítmény növekedését ezekben a szakaszokban, ahogy azt korábbi tanulmányunkban javasoltuk (Papp és mtsai., 2018).
Eredményeink magyarázatához figyelembe kell vennünk, hogy az 5-HT2CR-ek képesek modulálni az 5-HT, NA, és ami fontos, a DA neuronális aktivitást (Di Giovanni és De De Deurwaerdere, 2016). Az 5-HT2CR-ek konstitutív aktivitása a jelentések szerint gátló kontrollt gyakorol a DA neuronok aktivitására, amelyet az 5-HT2CR antagonisták szisztémás beadásával visszafordítottak. Az SB-242084 és az SB-206553 jelentősen fokozta a bazális DA felszabadulást a patkányagy DA-vel innervált területein. Az SB-242084 által kiváltott DA felszabadulás azonban kicsi volt, és az SB-206553-hoz képest maximumot ért el (De De Deurwaerdere et al., 2004). Érdekes módon az SSRI-ket is kapcsolatba hozták a DAerg jelátvitel szabályozásával (ami a két vizsgált gyógyszer lehetséges közös tulajdonságára utalhat), bár a rendelkezésre álló irodalmi adatok nem egyértelműek. Míg az akut escitalopramról azt jelentették, hogy növeli a ventrális tegmentális terület neuronjainak tüzelési sebességét és kitörését (Schilstrom et al., 2011), egy másik vizsgálat kimutatta, hogy az escitalopram kéthetes adagolása csökkentette ezen neuronok tüzelési sebességét és kitörését, altatott patkányokban (Dremencov et al., 2009).
A vizsgálat eredményeit néhány korlátozással összefüggésben kell értelmezni. Az SB-242084-et csak egy dózisban adtuk be, és nem vizsgáltuk, hogy a gyógyszer gammafokozó hatása dózisfüggő-e. Ezenkívül elemzésünk a névleges mintavételi sebesség által meghatározott Nyquist-korlát miatt maximum 60 Hz-re korlátozódott, így további munkára van szükség a gyorsabb gammafrekvenciák, valamint a nagyfrekvenciás oszcillációk (HFO) és a hullámzás vizsgálatához.
Eredményeink összességében hasonló hatást mutatnak az akut SB-242084 és a krónikus eszcitalopram gammaaktivitására, ami alátámasztja a preklinikai (és közvetett klinikai) bizonyítékokat, hogy az 5-HT2CR-antagonisták akut vagy rövid távú kezelése antidepresszáns hatású lehet. Így munkánk további bizonyítékot szolgáltathat arra, hogy az 5-HT2CR-antagonisták előnyösek lehetnek a depresszió és/vagy a szorongás kezelésében. Az, hogy a gamma-aktivitás változásai a terápiás gyógyszerhatás markerei vagy a terápiás hatás közvetítői, továbbra is megoldatlan kérdés, amely további vizsgálatokat igényel.
Adatok elérhetőségi nyilatkozata
A jelen vizsgálat során létrehozott és elemzett adatkészletek a jövőbeni publikálás céljából folyamatban lévő elemzés miatt nem nyilvánosak, de indokolt kérésre a megfelelő szerzőtől elérhetőek.
Etikai nyilatkozat
Minden tartási körülmény és állatkísérlet az EU 2010/63/EU irányelvének és a National Institutes of Health “Principles of Laboratory Animal Care” (NIH Publications No. 85-23, revised 1985), valamint a speciális nemzeti jogszabályoknak (a magyar kormány állatkísérletekről szóló 40/2013-as rendelete) megfelelően történt. A kísérleteket az Állatkísérletek Országos Tudományos Etikai Bizottsága jóváhagyta, és a kormány engedélyezte (Központi Mezőgazdasági Hivatal Élelmiszerlánc-biztonsági és Állategészségügyi Igazgatóság, 22.1/1375/7/2010. számú engedély).
Author Contributions
GB és TK tervezte a kísérleteket. DK, SV és PP végezték a kísérleti eljárásokat. GB, DK, SV és NP hozzájárult az adatok elemzéséhez. NP, SK, SV és GB értelmezte az eredményeket. NP, SK és GB írta a kézirat első tervezetét. A végleges kéziratot minden szerző elolvasta és jóváhagyta.
Finanszírozás
Ezt a munkát a Nemzeti Fejlesztési Ügynökség (KTIA_NAP_13-1-2013-0001) Magyar Agykutatási Program (Grant No. KTIA_13_NAP-A-II/14), NAP 2.0 (Grant No. 2017-1.2.1-NKP-2017-00002); ITM/NKFIH Tematikus Kiválósági Program, Semmelweis Egyetem; és az EMMI SE-Neurológia FIKP ösztöndíja.
Érdekütközés
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
Köszönjük Kátai Zitának és Bogáthy Emesének a kísérletekben és/vagy az adatok elemzésében nyújtott segítségüket.
Kiegészítő anyagok
A cikkhez tartozó kiegészítő anyagok online elérhetők a következő címen: https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G., Graf, M., Anheuer, Z. E., Modos, E. A., Kantor, S. (2001). Az akut fluoxetin, szertralin vagy m-CPP kezelés által kiváltott szorongásszerű hatásokat az SB-242084 5-HT2C receptor antagonistával történő előkezelés visszafordítja, de az 5-HT1A receptor antagonista WAY-100635 nem. Int. J. Neuropsychopharmacol. 4 (4), 399-408. doi: 10.1017/S1461145701002632
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagdy, G. (1998). Szerotonin, szorongás és stresszhormonok. Fókuszban az 5-HT receptor altípusok, fajok és nemek közötti különbségek. Ann. N. Y. Acad. Sci. 851, 357-363. doi: 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L., Vas, S., Bagdy, G. (2019). Az 5-HT2C és a CB1 receptor blokkolásának additív hatása az alvás-ébrenlét ciklus szabályozására. BMC Neurosci. 20 (1), 14. doi: 10.1186/s12868-019-0495-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., LeDoux, J. E. (2007). Az akut szelektív szerotonin visszavétel gátlók növelik a kondicionált félelem kifejeződését: blokkolás 5-HT(2C) receptor antagonistával. Biol. Psychiatry 62 (10), 1111-1118. doi: 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X. J. (2012). A gamma oszcillációk mechanizmusai. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
PubMed Abstract | CrossRef Full Text | Google Scholar
Cardin, J. A. (2016). Pillanatképek az agyról működés közben: helyi áramköri műveletek a gamma-oszcillációk lencséjén keresztül. J. Neurosci. 36 (41), 10496-10504. doi: 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). Az 5-HT2C receptorok a pszichiátriai rendellenességekben: áttekintés. Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi: 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A., et al. (2004). Az 5-HT(2C) receptorok inaktiválása potenciálja a szerotonin visszavétel blokkolásának következményeit. Neuropsychopharmacology 29 (10), 1782-1789. doi: 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
De De Deurwaerdere, P., Di Giovanni, G. (2017). A mezencephalicus dopaminerg rendszerek aktivitásának szerotonerg modulációja: terápiás következmények. Prog. Neurobiol. 151, 175-236. doi: 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W. P., Spampinato, U. (2004). A szerotonin2C receptor konstitutív aktivitása gátolja az in vivo dopamin felszabadulást a patkány striatumban és a nucleus accumbensben. J. Neurosci. 24 (13), 3235-3241. doi: 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M. J. (2000). A citalopram csökkenti a szociális interakciót patkányokban a szerotonin (5-HT) (2C) receptorok aktiválásával. Neuropharmacology 39 (6), 1114-1117. doi: 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al. (2018). Az 5-HT2C receptor blokkolás visszafordítja az SSRI-hez társuló bazális ganglionok diszfunkcióját és potenciálja a terápiás hatékonyságot. Mol. Psychiatry. doi: 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., Deurwaerdere, P. (2016). Az 5-HT2C receptor ligandumok új terápiás lehetőségei a neuropszichiátriai rendellenességekben. Pharmacol. Ther. 157, 125-162. doi: 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). A tartós szerotonin visszavétel gátlás hatása a dopamin neuronok tüzelésére a patkány ventrális tegmentális területén. J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). A gamma-oszcillációk mint a major depresszió biomarkere: egy feltörekvő téma. Transl. Psychiatry 8 (1), 177. doi: 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). Az antidepresszáns gyógyszerek hatásának in vivo elektrofiziológiai felvételei. Exp. Brain Res. 237 (7), 1593-1614. doi: 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth, K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). Dopamin, kognitív funkciók és gamma oszcillációk: a D4 receptorok szerepe. Front. Cell Neurosci. 7, 102. doi: 10.3389/fncel.2013.00102
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Robinson, D. D., Yu, J. H., Hajos-Korcsok, E. (2003a). A noradrenalin, de nem a szerotonin visszavétel gátlók fokozzák a septo-hippokampális rendszer théta és gamma aktivitását. Neuropsychopharmacology 28 (5), 857-864. doi: 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Weaver, R. J. (2003b). A septo-hippokampális aktivitás szabályozása 5-hidroxi-triptamin(2C) receptorok által. J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi: 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., et al. (2003). Az 5-HT2C receptorok gátolják és az 5-HT1A receptorok aktiválják a spike-hullám kisülések generálását az absence epilepszia genetikai patkánymodelljében. Exp. Neurol. 184 (2), 964-972. doi: 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Balogh, B., Benko, A., Bagdy, G. (2004). Fokozott éberség, motoros aktivitás és csökkent théta aktivitás az 5-HT2B receptornak az SB-215505 altípus-szelektív antagonistával történő blokkolása után. Br. J. Pharmacol. 142 (8), 1332-1342. doi: 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Molnar, E., Gyongyosi, N., Toth, A., Detari, L., et al. (2005). A hasonló anxiolitikus potenciál ellenére az 5-hidroxi-triptamin 2C receptor antagonista SB-242084 indolin] és a klórdiazepoxid eltérő hatást fejtett ki az elektroenkefalogram teljesítményspektrumára. J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi: 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G. A., Wood, M. D., Bright, F., Trail, B., Riley, G., Holland, V., et al. (1997). SB 242084, egy szelektív és agyi penetráns 5-HT2C receptor antagonista. Neuropharmacology 36 (4-5), 609-620. doi: 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung, K. H., Chu, K., et al. (2016). A funkcionális agyi hálózatok gamma-oszcillációja részt vesz a krónikus korlátozó stressz által kiváltott depressziós viselkedés spontán remissziójában egerekben. BMC Neurosci. 17, 4. doi: 10.1186/s12868-016-0239-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E., et al. (2014). A krónikus eszcitalopram-kezelés disszociatív adaptációt okozott a szerotonin (5-HT) 2C receptor antagonista által kiváltott hatásokban a REM alvásban, az ébrenlétben és a théta-hullám aktivitásban. Exp. Brain Res. 232 (3), 935-946. doi: 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., Higgins, G. A. (2002). Az 5-HT2C receptor antagonista, SB-242084 hatása a szorongás tesztjeiben. Pharmacol. Biochem. Behav. 71 (4), 615-625. doi: 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, C. B., Hamon, M., Lanfumey, L., Mongeau, R. (2014). Viták az 5-HT(2C) receptorok szerepéről az antidepresszáns gyógyszerek hatásmechanizmusában. Neurosci. Biobehav. Rev. 42, 208-223. doi: 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008). A hippokampusz-hálózatok théta és gamma koordinációja ébrenléti és gyors szemmozgásos alvás során. J. Neurosci. 28 (26), 6731-6741. doi: 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). Az alvás-ébrenlét viselkedés szerotonin kontrollja. Sleep Med. Rev. 15 (4), 269-281. doi: 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). Nyugalmi állapotú EEG gamma teljesítmény és théta-gamma csatolás fokozódása a nagyfrekvenciás bal dorsolaterális prefrontális rTMS-t követően depressziós betegeknél. Clin. Neurophysiol. 128 (3), 424-432. doi: 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D., et al. (2014). A szerotonin 2C receptor antagonisták gyorsan fellépő antidepresszáns hatásokat indukálnak. Mol. Psychiatry 19 (10), 1106-1114. doi: 10.1038/mp.2013.144
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018). Az akut és a krónikus escitalopram eltérően változtatja meg az EEG gamma-oszcillációkat: relevancia a terápiás hatások szempontjából. Eur. J. Pharm. Sci. 121, 347-355. doi: 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P., et al. (2005). Az 5-HT2 receptor altípusok hozzájárulása az alvás-ébrenléthez és a légzésszabályozáshoz, valamint funkcionális adaptációk az 5-HT2A receptorokat hiányzó knock-out egerekben. J. Neurosci. 25 (49), 11231-11238. doi: 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). A prefronto-hippokampális ritmusok szerotonin modulációja egészségben és betegségben. ACS Chem. Neurosci. 6 (7), 1017-1025. doi: 10.1021/cn500350e
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Watakabe, A., Ushimaru, M., Yamamori, T., Kawaguchi, Y. (2010). A szerotonin az 5-HT1A és 5-HT2A receptorokon keresztül modulálja a patkány prefrontális kéreg gyors tüskés interneuron és szinkron aktivitását. J. Neurosci. 30 (6), 2211-2222. doi: 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M. L. V., Muller, L. E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al. (2016). Magas frekvenciájú oszcillációk az emberi és majom neokortexben az ébrenléti-alvási ciklus alatt. Proc. Natl. Acad. Sci. U. S. A. 113 (33), 9363-9368. doi: 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M., et al. (2011). Az S-citalopram, citalopram és R-citalopram hatása a ventrális tegmentális terület dopamin neuronjainak tüzelési mintázatára, az N-metil-D-aszpartát receptor által közvetített átvitelre a mediális prefrontális kéregben és a kognitív funkcióra patkányban. Synapse 65 (5), 357-367. doi: 10.1002/syn.20853
PubMed Abstract | CrossRef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Kovacs, I. (2019). A gyors szemmozgásos alvás paradoxona az oszcillációs aktivitás és az agykérgi szinkronizáció fényében a fázisos és tónusos mikroállapotok során. Neuroimage 202, 116066. doi: 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D., Hajos, M., Kocsis, B. (2011). A hippokampusz théta ritmusának szerotonin általi szabályozása: az 5-HT2c receptorok szerepe. Neuropharmacology 61 (3), 489-494. doi: 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). Az ébrenléti és alvási EEG biomarkereket szolgáltat a depresszióban. J. Psychiatr. Res. 44 (4), 242-252. doi: 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C., et al. (2012). Emberi gamma-oszcillációk a lassú hullámú alvás során. PloS One 7 (4), e33477. doi: 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P., et al. (2013). A REM alvás latenciájának, a köztes szakasznak és a théta teljesítményének differenciált adaptációja az escitalopram krónikus kezelés után. J. Neural Transm. (Bécs) 120 (1), 169-176. doi: 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). Antidepresszánsok és alvás: a szakirodalom minőségi áttekintése. Drugs 65 (7), 927-947. doi: 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P. J., Georgiou, P., Fischell, J., Elmer, G. I., et al. (2016). A ketamin metabolitok NMDAR-gátlás-független antidepresszáns hatásai. Nature 533 (7604), 481-486. doi: 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar