- Bevezetés
- Anyagok és módszerek
- Vizsgálati populáció
- Vizsgálati változók
- Eredmények
- Az AB0/Rh vércsoport megoszlása a PCa-s betegek körében
- No Significant Differences in Clinicopathologic Characteristics among PCa Patients According to AB0/Rh Blood Groups
- Nincs szignifikáns prognosztikai értéke a vércsoportnak a BCR-mentes túlélésre RP után
- Diszkusszió
- Informált beleegyezés
- Etikai nyilatkozat
- Autor Contributions
- Enyilatkozat az összeférhetetlenségről
Bevezetés
A prosztatarák (PCa) a leggyakoribb malignitás a nyugati országokban és a második vezető oka a férfiak rákos halálozásának (1). A PCa kialakulásának legelismertebb kockázati tényezői a növekvő életkor, az etnikai származás és a családi anamnézis (2). A családi hajlam a betegség örökletes genetikai komponensére utal (3), de csak a PCa-esetek kisebbségét (5-10%) teszi ki. Ennek következtében a legtöbb beteg esetében a hajlamosító környezeti és genetikai tényezők még mindig ismeretlenek (4, 5). Az AB0 vércsoport olyan öröklött tulajdonság, amelyet számos rosszindulatú daganat előfordulási gyakoriságával és prognózisával hoztak összefüggésbe (6-8). Az AB0 vércsoport és a rákkockázat között megfigyelt összefüggés magyarázatára számos plauzibilis mechanizmust javasoltak, beleértve a gyulladást, a rosszindulatú sejtek immunfelügyeletét, a sejtek közötti adhéziót és a membránszignálokat.
Az AB0 vércsoport antigének (ABH) a vörösvértestek felszínén kifejeződő glikoproteinek. A fenotípusos A- és B-antigének terminális szénhidrátok, amelyek specifikus glikoziltranszferázok sorozata által katalizált egyes cukrok addíciójával szintetizálódnak. A 0 fenotípust az A és B glikoziltranszferázok hiánya jellemzi, így csak egy fehérje gerinc, a H antigén van jelen. A vörösvérsejt-antigéneknek különböző funkciói vannak, többek között a membránszerkezeti integritás, a molekulák membránokon keresztüli szállítása és az adhézió (9). A vörösvérsejteken való expressziójuk mellett az ABH antigének számos hámsejtben is kifejeződnek, beleértve az urothelt, a gasztrointesztinális nyálkahártyát és a tüdőt. Számos tanulmány kimutatta az ABH expressziós mintázatának változását a rákos sejtekben a tumor fokozata és a betegség progressziója szerint, ami az AB0 vércsoport és egyes epithelialis malignitások kockázata közötti lehetséges összefüggésre utal (8, 10). A közelmúltban végzett vizsgálatok kimutatták, hogy az A, AB vagy B vércsoportú egyéneknél a hasnyálmirigyrák előfordulása megnövekedett a 0 vércsoportúakhoz képest, míg a legmagasabb kockázatot a B vércsoporthoz kapcsolódónak találták (8). Hasonlóképpen, az A vércsoportú szerotípusról azt jelentették, hogy a gyomor-, emlő- és petefészekrák magasabb kockázatával jár együtt (11). Másrészt a 0 vércsoport a legmagasabb kiújulási és progressziós rátával korrelált a transzurethrális hólyagreszekciót követően, és így rosszabb prognózissal járt együtt a nem izominváziós hólyagrákos urothelialis karcinómában szenvedő betegeknél (6).
A vércsoport számos malignus betegségben betöltött prediktív szerepének jelenlegi bizonyítékai alapján feltételeztük, hogy a vércsoport típusa további paraméterként használható, amely megkönnyíti a kockázatok felmérését és segít a PCa-ban szenvedő betegek műtét utáni prognózis becslésében. A jelenlegi szakirodalomban csak korlátozott számú klinikai bizonyíték áll rendelkezésre a vércsoport és a PCa vonatkozásában általában, amelyek ellentmondásos eredményeket mutattak (12-14) Ezenkívül jelenleg csak egyetlen olyan tanulmány létezik, amely kifejezetten a vércsoportnak a radikális prosztatektómiát (RP) követő betegek kimenetelére gyakorolt hatására összpontosít (13). A szerzők 555, RP-n átesett PCa-s beteg felhasználásával kimutatták, hogy az AB0 vércsoport a biokémiai kiújulás (BCR) független előrejelzője volt a többváltozós elemzésben, de az egyváltozós elemzésben nem.
Ezért a jelen tanulmány célja az volt, hogy a folyamatban lévő vitához további információkat adjon az AB0/Rh vércsoport és a PCa-s betegeken belüli eloszlásának, a tumor patológiájának, a kiújulásnak és a mortalitásnak az összefüggését elemezve a RP-n átesett lokalizált PCa-s betegeknél egy nagy, egyetlen központból származó, 3574 betegből álló adathalmaz felhasználásával.
Anyagok és módszerek
Vizsgálati populáció
A vizsgálatot az intézményi felülvizsgálati bizottság jóváhagyta. Összesen 3582 klinikailag lokalizált PCa-val rendelkező beteget szűrtek ki a vizsgálatba való bevonás céljából, akik 2009 és 2010 között intézményünkben RP-n estek át. A hiányos adatsorokkal és hiányzó nyomon követéssel rendelkezőket kizártuk (n = 8), így 3574 beteg állt rendelkezésre az elemzéshez.
A radikális prosztatektómiát nyílt retropubikus megközelítéssel (n = 3220) vagy robotizált laparoszkópos megközelítéssel (n = 354) végeztük, a korábban leírtak szerint (15). A nyirokcsomó-dissectiót D’Amico közepes és magas kockázatú betegeknél az Európai Urológiai Társaság (EAU) PCa-ra vonatkozó irányelvei szerint végeztük (16). A műtéti mintákat a standard szövettani eljárásoknak megfelelően dolgozták fel, és tapasztalt uropatológusok értékelték egy nagy volumenű központban (>2 000 prosztatektómia-minta évente). A daganatokat az American Joint Committee on Cancer 2007-es TNM stádiumbeosztási rendszere szerint stádiumba sorolták, a szövettani osztályozást pedig a Gleason-rendszer szerint végezték (17).
Az RP előtt minden résztvevő szerológiai vizsgálaton esett át. Az AB0 és Rh vércsoport laboratóriumi megerősítését a Hamburg-Eppendorfi Egyetemi Kórház Transzfúziós Orvosi Osztályától kapták. Kontrollként a német populáció AB0 referenciaeloszlását használták (18).
Vizsgálati változók
A vizsgálati változók közé tartozott az AB0/Rh vércsoport, az életkor, a műtét előtti prosztataspecifikus antigén (PSA), a prosztata térfogata (transzrektális ultrahang), a Gleason-pontszám (minta), a pT-stádium, a pN-státusz, a műtéti margó, a BCR és a halálozás az RP után. A betegek követése az RP-t követő első 2 évben 3-6 havonta végzett PSA-vizsgálatból állt, a BCR-t ≥0,2 ng/ml PSA-szintként definiálták.
Az AB0 vércsoport és a klinikopatológiai változók közötti kapcsolatot chi-négyzet-tesztekkel és t-tesztekkel értékelték. A Cox-regressziós többváltozós elemzésben (log-rank tesztek) a vércsoport, a preoperatív PSA, a Gleason-pontszám, a pT-stádium, a pN-státusz és a műtéti margó hatását vizsgáltuk a BCR-mentes túlélésre a túlélésre vonatkozó prognosztikai értékek értékelése érdekében. A BCR-mentes túlélés valószínűségét a 0, A, B és AB csoportokban Kaplan-Meier-analízis és log-rank teszt segítségével hasonlítottuk össze.
Minden teszt kétpontos volt, és a <0,05 p-értékeket statisztikailag szignifikánsnak tekintettük. A statisztikai elemzéseket a JMP v9.0.2 szoftverrel végeztük (SAS Institute, Inc, Cary, NC, USA) és az R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Eredmények
A végleges elemzésekre összesen 3574 klinikailag lokalizált PCa-val rendelkező beteg volt alkalmas, a műtétkor a medián életkor 65 év (tartomány: 38-80), a medián követési idő 36,9 hónap volt (1. táblázat).

1. táblázat. Az AB0 vércsoport és a Rhesus faktor összefüggése a radikális prosztatektómiával kezelt 3574 beteg klinikopatológiai jellemzőivel.
Az AB0/Rh vércsoport megoszlása a PCa-s betegek körében
Az AB0 vércsoport megoszlása a PCa-s betegek körében a RP előtt a következő volt: A betegek 83%-a Rh-pozitív volt (1. táblázat). A német lakosságra vonatkozó referenciaeloszlás a következő (18): 0 41%-ban; A 43%-ban; B 11%-ban; AB 5%-ban; Rhesus pozitív: 85%. Az AB0, valamint az Rh vércsoportok általános megoszlása a vizsgált kohorszban megegyezett a német férfi populációban megfigyelt megoszlással.
No Significant Differences in Clinicopathologic Characteristics among PCa Patients According to AB0/Rh Blood Groups
A betegek többsége klinikailag lokalizált PCa volt, közepes kockázati profillal. A leggyakrabban jelentett Gleason-pontszám 3 + 4 volt (66,9%), és a betegek 63,3%-ának preoperatív PSA-szintje a 4-10 ng/ml tartományba esett. 68,7%-ban pT2 tumort észleltek, és a betegek 81,3%-ában negatív margint értek el. A prosztata medián térfogata 40 ml volt, és 224 (6,3%) betegnél diagnosztizáltak nyirokcsomó érintettséget (1. táblázat). A különböző AB0 vércsoportú betegek között nem volt szignifikáns különbség a klinikopatológiai jellemzőkben. Az AB vércsoportú betegeknél a 0, A és B vércsoportúakhoz képest kissé nagyobb arányban fordult elő előrehaladott tumorstádium (≥pT3b) (16,1, 12,6, 9,9, illetve 13,7%, p = 0,033). Az AB vércsoportú betegpopulációban a többi vércsoporthoz (16,9%, p = 0,01) képest mérsékelten emelkedett a negatív Rh-faktor aránya is (21,8%) (1. táblázat).
Nincs szignifikáns prognosztikai értéke a vércsoportnak a BCR-mentes túlélésre RP után
A többváltozós cox-regressziós elemzés szerint a műtét előtti PSA, a Gleason-pontszám, a pT-stádium, a pN-státusz és a műtéti margó szignifikánsan és függetlenül korrelált a BCR-mentes túléléssel (mindegyik p < 0,05) (2. táblázat). Az AB0 vércsoportnak a BCR-arányra gyakorolt hatását azonban nem tudtuk megfigyelni (1. ábra). Tovább vizsgáltuk a 0 vércsoport prognosztikai értékét a nem-0 vércsoportokhoz képest, valamint az alternatív A/B/AB vércsoportokon belül, de nem szignifikáns eredményekkel (2. táblázat). Még akkor is jelentéktelen maradt az AB0/Rh hatása a BCR-re, ha csak a pozitív vagy negatív marginalizációs státuszú betegekkel végeztünk alanalízist (2A,B ábra). Ezenkívül a betegek Rhesus-faktor státusza sem volt hatással a BCR-mentes túlélésre (p = 0,74).
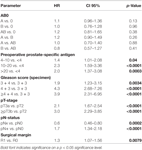
Táblázat. Az AB0 és a standard prognosztikai tényezők többváltozós cox regressziós modelljei a biokémiai recidívamentes túlélésre vonatkozóan.
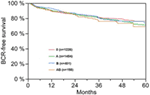
1. Ábra. Biokémiai kiújulás (BCR)-mentes túlélés radikális prosztatektómia után az AB0 vércsoportok szerint rétegezve (p = 0,572).
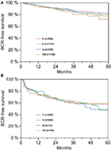
2. ábra. (A,B) Biokémiai recidíva (BCR)-mentes túlélés radikális prosztatektómia után AB0 vércsoportok szerint rétegezve a negatív és pozitív műtéti margóstátuszú betegeknél.
Diszkusszió
Az AB0 vércsoport és egyes epiteliális malignitások, köztük a hasnyálmirigy-, vastagbél- és gyomorrák kockázata közötti lehetséges összefüggésekről gyakran beszámoltak (19, 20). Ráadásul az AB0/Rh vércsoport a legtöbb beteg esetében már a műtéti beavatkozás előtt rendelkezésre áll, így ideális kiegészítő markernek javasolt, további laboratóriumi feldolgozási lépések nélkül.
Múlt évtizedekkel ezelőtt immunhisztokémiai vizsgálatok jelezték, hogy a betegből származó PCa sejtek az ABH expressziójának más mintázatát mutatják, mint a normális/benignus prosztata sejtek (21). Mivel mind az AB0 vércsoportról, mind a szöveti antigén expressziójáról beszámoltak, hogy számos malignitásban összefüggésbe hozható az incidenciával, a betegség progressziójával és kimenetelével (8, 22, 23), az ABH antigén ilyen megváltozott expressziója a prosztataszövetben a vércsoportnak a prosztata sejtek rosszindulatú átalakulására gyakorolt lehetséges befolyására utalt.
A Markt és munkatársai (14) által nemrég közzétett tanulmány az AB0 vércsoport és az agresszív PCa hordozásának kockázata közötti kapcsolatot elemezte. A szerzők 2774 agresszív PCa-s betegből és 4443 PCa nélküli betegből álló adathalmazt elemeztek kontrollként. Ezen adatok felhasználásával nem tudtak szignifikáns összefüggést kimutatni az AB0 vércsoport vagy az A vagy B allélok “dózisa” és az agresszív PCa kockázata között. Bár a szerzők a vércsoportok szerint rétegzett rák-specifikus és általános halálozásról is beszámoltak, a tanulmány nem tartalmazott információt a PCa kezeléséről. Ráadásul csak az agresszív daganatos betegeket vonták be, ami elfedheti a különböző vércsoportok lehetséges hatását.
Ezek az eredmények összhangban vannak a Kvist és munkatársai által lefuttatott vizsgálattal, amely nem mutatott összefüggést az AB0 vércsoport és a figyelmes kivárással kezelt PCa-s betegek túlélése között. Ezt a vizsgálatot elsősorban a kis esetszám (n = 279) korlátozta (12). Érdekes módon az egyetlen, RP utáni betegekre összpontosító, 555 japán beteget magában foglaló vizsgálat nemrégiben arról számolt be, hogy a 0 vércsoport szignifikánsan összefüggött a BCR csökkent kockázatával RP után a többváltozós, de nem az egyváltozós elemzésben (13). A negatív műtéti margóval rendelkező betegek alelemzésében az 5 éves BCR-mentes arány a 0 vércsoportban szignifikánsan magasabb volt, mint az A csoportban (91,2 vs. 71,0%; p = 0,026). Ebben a vizsgálati kohorszban a betegek 46,3%-ának volt pozitív a műtéti margó státusza annak ellenére, hogy a betegek 74,2%-ánál a klinikai stádium T1c volt. A patológiai stádiumot (pT) nem említették.
A mi 3574 klinikailag lokalizált PCa-s betegből álló retrospektív kohorszunk az eddigi legnagyobb elemzett kohorsz, amelynek célja az AB0 és Rh vércsoport lehetséges hatásának meghatározása a tumor jellemzőire és az RP utáni kimenetelre. Jelen vizsgálatban a betegek többségének pT2-es tumora volt (68,7%), és 18,6%-uknak pozitív margóstátusa volt. Ezen adatok felhasználásával nem tudtuk kimutatni az AB0/Rh vércsoportok szignifikáns hatását a klinikopatológiai jellemzőkre (preoperatív PSA, Gleason-pontszám, prosztata térfogata, pT stádium, pN státusz és műtéti margó) és a BCR-mentes túlélésre a kuratív RP után. Sőt, amikor csak a pozitív vagy negatív margóstátuszú betegekkel végzett alanalízist, az AB0/Rh hatása a BCR-re jelentéktelen maradt. Ezért nem tudtuk reprodukálni a japán tanulmány eredményeit (13). Más rosszindulatú daganatokkal, például a hasnyálmirigy- vagy hólyagrákkal ellentétben az AB0/Rh vércsoport nem nyújtott prognosztikai értéket PCa esetén.
Vizsgálatunknak több fontos korlátja is van. Az első és legfontosabb a retrospektív elemzésekkel járó korlátok és a kontrollcsoport hiánya. Továbbá, vizsgálati kohorszunk túlnyomórészt alacsony és közepes kockázati profillal rendelkező lokalizált PCa-t tartalmaz (Gleason-pontszám 3 + 4 66,9%-ban, 4-10 ng/ml preoperatív PSA 63,3%-ban, pT2 68,7%-ban és negatív margó 81,3%-ban), ami lehetővé teszi a kedvező prognózisú betegek előzetes kiválasztását. Ezenkívül az AB általános megoszlása – a többi vércsoporttal ellentétben – általában alacsony (4,9%). Néhány megfigyelés, mint például a negatív Rh-faktor mérsékelten megnövekedett aránya (21,8%) az AB-s betegeknél a többi vércsoporthoz képest (16,9%, p = 0,01), valószínűleg az Rh-negatív AB típus ritkasága miatt fokozható, ami megakadályozza az összefüggés statikailag szignifikáns kimutatását ebben az alcsoportban. Végül, az adott vércsoport genotípusára vonatkozó információ hiányzott.
A fent említett jellemzők mellett a környezeti, földrajzi és faji szempontokat sem szabad elhanyagolni az AB0 vércsoport és a rák összefüggéseinek tárgyalásakor. A faji és etnikai különbségek a vércsoportok, valamint a PCa tekintetében jól ismertek (24, 25). Európában, ahol a PCa a leggyakoribb rosszindulatú daganatos betegség és a második vezető rákos halálozási ok a férfiak körében (1), a leggyakoribb vércsoport az A és a 0, amely nyugatról kelet felé haladva a B allél felé növekszik. Ezzel szemben a PCa legalacsonyabb incidenciájával és alacsony fokozatával rendelkező ázsiai országokat a B típus magas előfordulása és a 0 relatív alacsony gyakorisága, valamint a negatív Rh-faktorral rendelkező kisebb népesség jellemzi (26). E tekintetben eredményeink eltérnek a jelenlegi tanulmánytól a japán betegeknél, akiknél a kuratív RP után viszonylag magas volt a pozitív margóstátusz és a BCR (13).
Más mechanizmusokat javasoltak annak magyarázatára, hogy a vércsoport hogyan befolyásolja a rák előfordulását és progresszióját; ezek azonban még mindig tisztázatlanok. A hólyagrák esetében kromoszóma-rendellenességet feltételeztek, mivel az AB0 gén a 9q34 kromoszómán található, egy olyan területen, amely a hólyagrákban gyakran megváltozik (27). Mivel az AB0 gén valójában glikoziltranszferázokat kódol, amelyek katalizálják a cukrok átvitelét a H antigénre (0), a hólyagrák előfordulása potenciálisan korrelál a 0 vércsoporttal. Ezzel szemben arról számoltak be, hogy a nem 0 vércsoportú (A, AB és B) egyéneknél megnövekedett a gyomorrák kialakulásának kockázata, ami a vércsoport rák-specifikus szerepére utal.
A PCa tekintetében számos törekvés van folyamatban a vércsoportnak a terápia utáni túlélésben játszott szerepének tisztázására. Már beszámoltak arról, hogy a nem-0 vércsoportú betegeknek fokozott vénás tromboembólia-kockázattal kell számolniuk az RP után, ami befolyásolhatja a kimenetelt (28). Még egy nemrégiben közzétett tanulmány is kimutatta, hogy az A vércsoporttal szembeni szérumantitestek előre jelzik a túlélést a PROSTVAC-VF (egy poxvírus alapú terápiás rákvakcina, amely III. fázisú klinikai vizsgálatokban van az előrehaladott PCa kezelésére) esetében, és a PROSTVAC-VF új, potenciálisan előrejelző biomarkernek kell tekinteni (29). Bár vizsgálatunkban nem figyeltünk meg egyértelmű összefüggést az AB0/Rh vércsoport és a tumor patológiája és kimenetele között, ezek a bizonyítékok mégis a vércsoport prediktív szerepére utalnak a PCa epidemiológiájában és klinikai kimenetelében, különösen a terápiás válasz tekintetében.
A jelen, 3574 beteget vizsgáló tanulmány az eddigi legnagyobb, amely az AB0 vagy Rh vércsoportok hatását elemzi az RP utáni patológiára és kimenetelre, és fontos ismeretekkel egészíti ki az irodalmat.
Összefoglalva, adataink arra utalnak, hogy az AB0/Rhesus vércsoportnak nincs releváns kapcsolata a kedvezőtlen klinikopatológiai tumorjellemzőkkel vagy a műtét utáni onkológiai kimenettel, ellentétben számos más malignitással. Mindazonáltal további kutatások indikáltak a vércsoport genotípusa vagy a PCa-szöveten történő antigén-expressziója és a prognózis közötti lehetséges összefüggés felmérésére a különböző terápiás csoportokon belül, beleértve a magas fokú vagy előrehaladott PCa-t, amely a mi vizsgálati csoportunkban nem tükröződött kellőképpen.
Informált beleegyezés
A vizsgálatba bevont valamennyi egyéni résztvevőtől tájékozott beleegyezést kaptunk.
Etikai nyilatkozat
Az emberi résztvevőkkel végzett vizsgálatokban végzett valamennyi eljárás összhangban volt az intézményi és/vagy nemzeti kutatóbizottság etikai normáival, valamint az 1964-es Helsinki Nyilatkozattal és annak későbbi módosításaival vagy hasonló etikai normákkal.
Autor Contributions
SO, DT és TS: lényeges hozzájárulás a munka koncepciójához vagy tervezéséhez, a munka szerkesztéséhez, a publikálandó változat végleges jóváhagyásához. PM: jelentős hozzájárulás a munka koncepciójához vagy tervezéséhez, a munka szerkesztéséhez, a publikálandó változat végső jóváhagyásához. FC: a munka adatainak beszerzése, elemzése vagy értelmezése, a munka kritikus átdolgozása a fontos szellemi tartalom szempontjából, a publikálandó változat végső jóváhagyása. PT: a munka adatainak beszerzése, elemzése vagy értelmezése, a munka kritikus átdolgozása fontos szellemi tartalom miatt, a publikálandó változat végső jóváhagyása. SP: a munka adatainak beszerzése, elemzése vagy értelmezése, a munka kritikus felülvizsgálata a fontos szellemi tartalom szempontjából, a publikálandó változat végleges jóváhagyása. JLH, JH és MG: a munka adatainak beszerzése, elemzése vagy értelmezése, kritikus átdolgozása a fontos szellemi tartalom szempontjából, a publikálandó változat végleges jóváhagyása. Minden szerző vállalta, hogy a munka minden aspektusáért felelősséget vállal annak biztosításában, hogy a munka bármely részének pontosságával vagy integritásával kapcsolatos kérdéseket megfelelően kivizsgálják és megoldják.
Enyilatkozat az összeférhetetlenségről
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
A kezelőszerkesztő több szerzővel (FC, SP, JH és DT) közös kapcsolatról, bár egyéb együttműködésről nem nyilatkozott.
1. Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. A prosztatarák kockázati tényezői. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Az örökletes prosztatarák genetikai etiológiája. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported family history of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohors of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impact of ABO blood type on outcomes in patients with primary nonmuscle invasive bladder cancer. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034.
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. Az I-es vércsoport antigént kódoló gén: egy szem I-es áttekintése. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Az A, B és H vércsoport antigének expressziója a karcinómaszövetben korrelál a vastagbélrákos betegek rossz prognózisával. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO vércsoport és az epithelialis petefészekrák előfordulása. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Prognosztikai változók prosztatarákos betegeknél: az ABO (H) vércsoport, a Rhesus rendszer, az életkor, a differenciálódás, a tumor stádiuma és az áttétek hatása. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associations between ABO blood groups and biochemical recurrence after radical prostatectomy. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO vércsoport allélok és a prosztatarák kockázata: a mell- és prosztatarákos kohorsz konzorcium (BPC3) eredményei. Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerv sparing frequency and reduce positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. A prosztata adenokarcinóma prognózisának előrejelzése kombinált szövettani osztályozással és klinikai stádiumbeosztással. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blood group determinates incidence for pancreatic cancer in Germany. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO vércsoportok és a rák. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. Az ABO és Lewis vércsoportrendszer. Immunkémia, genetika és kapcsolat az emberi betegségekkel. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Vércsoport antigének kimutatása a prosztata hám fagyasztott metszeteiben. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Az ABH/Lewis-related antigének expressziója mint prognosztikai tényezők emlőrákos betegeknél. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. A vércsoport ABO gén átirata lefelé szabályozott humán hólyagtumorokban és növekedés-stimulált urotheliális sejtvonalakban. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. A prosztatarák összehasonlító vizsgálatai Japánban és az Egyesült Államokban. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Model-based patterns in prostate cancer mortality worldwide. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO és Rh(D) fenotípus gyakorisága különböző faji/etnikai csoportokban az Egyesült Államokban. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Az ABO(H) histoblood csoport genotípusos és fenotípusos jellemzése primer hólyagtumorokban. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Prosztatarák: a nem-O vércsoport VTE kockázati tényező radikális prosztatektómia után. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Az A vércsoporttal szembeni szérum antitestek előrejelzik a PROSTVAC-VF túlélést. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar
.