| Ed Davis, Ph.D. |
Bevezetés
A lentivírusok és az Adeno-asszociált vírusok (AAV) felbecsülhetetlen értékűnek bizonyultak a genetikai anyag emlőssejtekbe történő bevitelére, akár tenyészetben, akár egész állatokban. Mindkét rendszer kiválóan alkalmas számos alapkutatási alkalmazásra, például fehérje-túlkifejezésre, antitestek előállítására és génkiütésre, és mindkettő ígéretes a génterápiában. Mindegyik vírusos rendszernek megvannak azonban a maga egyedi előnyei és hátrányai, az alkalmazástól függően. A GeneCopoeia kiterjedt termékcsaládokat kínál mind a lentivírus, mind az AAV esetében, így hatékony és rugalmas lehetőségeket kínál a DNS sejtekbe juttatásához. Ebben a technikai jegyzetben ismertetjük a GeneCopoeia Lentifect™ lentivírus és AAVPrime™ AAV termékcsaládok mögött álló technológiákat, és megvitatjuk az egyes technológiák előnyeit a különböző alkalmazásokhoz, hogy segítsünk kiválasztani, melyik rendszer felel meg leginkább az Ön igényeinek.
Miért használunk vírusokat DNS-szállításra?
A DNS sejtekbe juttatásának egyik leggyakoribb módja a plazmid alapú transzfekció, amelyben a sejteket kémiai vegyületekkel, például kalcium-foszfáttal, vagy lipid alapú reagensekkel kezelik. A plazmid transzfekció azonban nem mindig kívánatos vagy praktikus. Például néhány sejtet nagyon nehéz vagy lehetetlen transzfektálni, míg a legtöbb tenyésztett sejt támogatja a lentivírussal vagy AAV-val történő fertőzést (más néven transzdukciót). Másodszor, a plazmid transzfekció nem használható in vivo DNS-szállításra, de a vírusos transzdukció igen. Mind a lentivírus, mind az AAV számos alkalmazáshoz használható, például nyílt olvasókeretekből (ORF) származó fehérjék expressziójára, rövid hajtű RNS (shRNS) által közvetített RNS-interferenciával (RNSi) történő génkiütésre, luciferáz és más riportergén vizsgálatokra, valamint a klaszterezett, rendszeresen interspacolt, rövid palindromos ismétlődések-Cas9 (CRISPR-Cas9) rendszer által közvetített génkiütésre. A vírusvektorok számos ilyen alkalmazását sikeresen hajtották végre tenyésztett immortalizált emlőssejtvonalakon, primer sejtkultúrákban, állatmodellekben és humán betegeken végzett génterápiában.
A “lentivírus” kifejezés a retrovírusok azon osztályára utal, amelybe a humán immundeficiencia vírus (HIV) tartozik, és valójában a legtöbb jelenleg használt lentivirális rendszer a HIV-től származik (áttekintve: Mátrai, et al, 2010; Sakuma, et al., 2012). A transzgéneket hordozó lentivírusok a fertőzéskor integrálódnak a genomba, és így stabil expressziót tesznek lehetővé osztódó és nem osztódó sejtekben egyaránt.
A lentivirális rendszereket a HIV-ből több generáción keresztül nagymértékben módosították, hogy biztonságos legyen a kezelésük és hasznosak legyenek az alkalmazásokban. A GeneCopoeia a 3. generációs lentivirális rendszert használja (Dull, et al. 1998), amely négy különálló plazmidot igényel a fertőző vírusrészecskék (virionok) előállításához. Egy GeneCopoeia lentivirális plazmid csak az expresszálandó gént (GOI), egy antibiotikum-szelekciós gént és a csomagolási jelszekvenciákat hordozza. Néha a klón egy fluoreszcens riportergént is tartalmaz. A GOI-t tartalmazó plazmid a szelektálható markerrel és a riportergénnel együtt körülbelül 5-6 kb-ig terjedő inzerteket képes befogadni. (1. ábra), bár a vírustiterek drámaian csökkennek, ha az inzertek mérete meghaladja a körülbelül 4 kb-t.
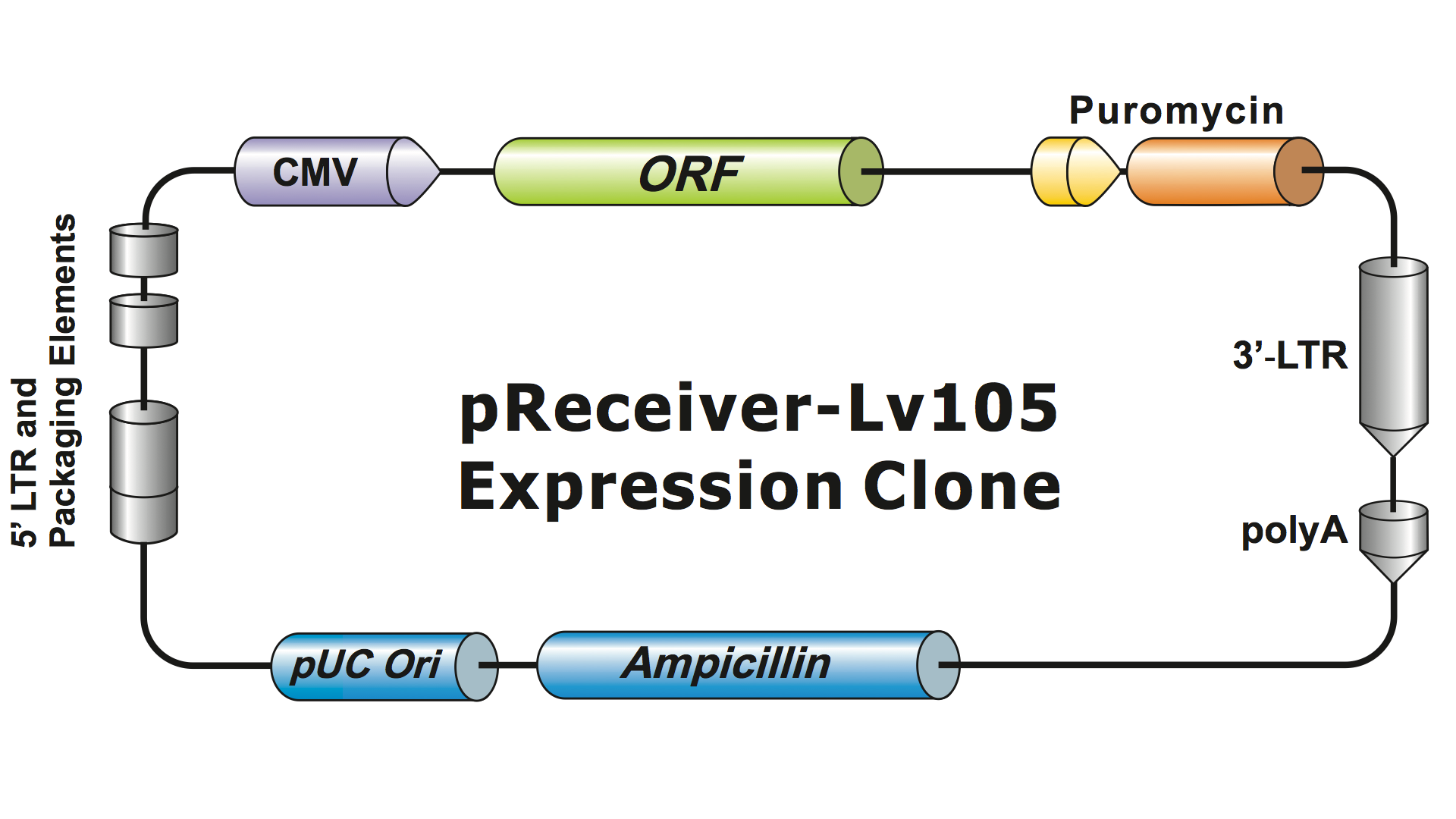 |
1. ábra. Példa egy GeneCopoeia lentivirális expressziós klónra |
A további plazmidok a csomagoláshoz és integrációhoz szükséges retrovírus elemeket (gag, pol, env, Rev) expresszálják. Ha mind a négy plazmidot csomagoló sejtekben expresszáljuk, a GOI RNS beépül a részecskékbe. Mivel a retrovírusfehérjék csak a csomagolás során expresszálódnak, a fertőzött sejtek nem képesek fertőző vírust termelni. Ezenkívül a GeneCopoeia Lentifect™ lentivirális részecskéi deléciót tartalmaznak az LTR-ek U3 régiójában, ami öninaktiválóvá (SIN) teszi őket. A SIN deléció megakadályozza a lentivírus replikációját abban a ritka esetben, ha mind a négy plazmid rekombinálódik, hogy egyetlen aktív vírus plazmidot hozzon létre. Ezért a lentivirális részecskék biztonságosan kezelhetők, és gyakorlatilag kizárt, hogy patogén vírus keletkezzen.
A fokozott biztonsági módosítások mellett a GeneCopoeia Lentifect™ lentivirális részecskéi a vad típusú HIV env gén helyett a vesicular stomatitis virus G (VSV-G) glikoproteint hordozzák, ami megváltoztatja a vírus szöveti tropizmusát a CD4+ T-sejtekről gyakorlatilag bármely emlőssejttípusra. Mint ilyenek, a lentivírusok széles körben használt rendszer emlőssejtkultúrákban, állatmodellekben és génterápiás alkalmazásokban.
Mivel a lentivirális vektorokat ilyen módon módosították, a GeneCopoeia Lentifect™ lentivirális rendszerei fokozott biztonsággal rendelkeznek, és az alábbi jellemzőkkel rendelkeznek, amelyek rendkívül hasznossá teszik őket DNS-szállításra:
- Majdnem minden emlőssejttípust megfertőznek
- Viszonylag nagy DNS-szekvenciák – akár 5-6 kb hosszúságú – szállítására is alkalmasak
- Sztabil sejtvonalak létrehozására, vagy stabil génexpresszió irányítására szervekben és szövetekben in vivo, a transzgénnek a genom véletlenszerű helyein történő integrációjának köszönhetően
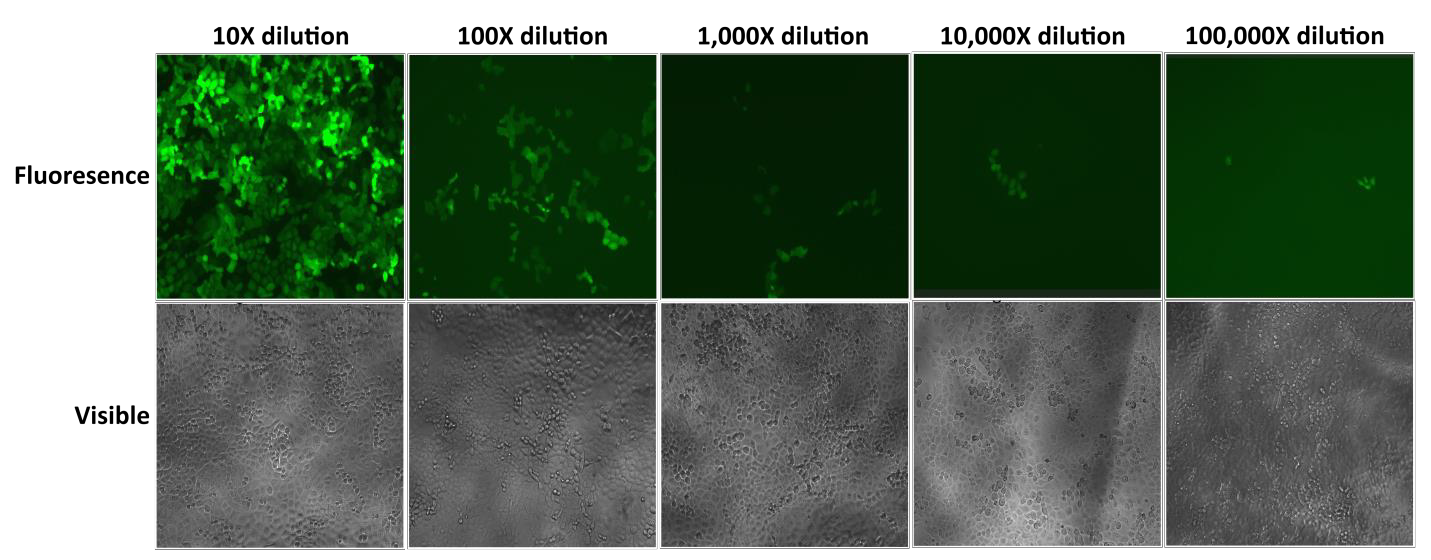
A GeneCopoeia Lentifect™ lentivirális részecskéi magas titereket biztosítanak, lehetővé téve a kutatók számára az érdeklődésre számot tartó gének hatékony expresszióját (2. ábra).
|
2. ábra. A Lentifect™ lentivirális részecskék sorozatos hígításainak vizsgálata. 72 órával a transzdukció után az eGFP fluoreszcenciáját fluoreszcens mikroszkóppal fényképeztük. |
|
A GeneCopoeia az iparág egyik legkiterjedtebb lentivirális termékcsaládját kínálja (1. táblázat).
| Termék/szolgáltatás | leírás |
| Lentivirális klónok és klónozó vektorok | Elkészített és egyedi klónok, amelyek ORF-eket, promótereket, shRNS-eket, miRNS 3′ UTR-eket, prekurzorokat és inhibitorokat, sgRNS-eket és egyebeket hordoznak. Többféle promóterrel, címkével és riporterrel kapható. Vektorok az érdeklődésre számot tartó szekvenciák do-it-yourself klónozásához. |
| Lentifect™ lentivirális részecskék | Előkészített és egyedi csomagolású, felhasználásra kész lentivirális részecskék. A GeneCopoeia kiterjedt, genom-széles körű klóngyűjteményeiből vagy az ügyfél által beküldött klónokból állítják elő. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Teljes reagensrendszer a “csináld magad” lentivirális részecskék előállításához. Tartalmazza a csomagoló plazmidokat, a csomagoló sejtvonalat, a részecskekoncentráló oldatot és a titrálókészletet. |
Táblázat 1. A GeneCopoeia lentivirális termékek és szolgáltatások sora.
AAV-alapú rendszerek
A lentivírusok RNS genomjával ellentétben az AAV egyszálú DNS genommal rendelkezik (Samulski és Muzyczka, 2014). Emellett az AAV nem kórokozótól származik, hanem az adenovírus kontamináns, és nem tulajdonítanak neki patogén körülményeket. A természetesen előforduló AAV a lentivírushoz hasonlóan integrálódik a genomba, de csak a 19. kromoszómán található AAVS1 lókuszon. Ezt a helyet “Safe Harbor”-nak is nevezik, mivel általában a sejtek károsítása nélkül használják transzgének beillesztésére (DeKelver, et al., 2010).
A lentivírushoz hasonlóan az AAV-t is módosították a biztonság és a felhasználhatóság érdekében. Az AAV egy segédvírussal való együttes fertőzést igényel. Az AAV genom 4,7 kb hosszú, és 2 gént tartalmaz, a Rep és a Cap gént, amelyek a vírus replikációjához és integrációjához szükségesek. Az AAVPrime™-ben a Rep és a Cap géneket törölték, így csak a 145 bp 5′ és 3′ invertált terminális ismétlődések (ITR) maradtak meg. A Rep és Cap törlése három célt szolgál: 1) Megszünteti a segédvírus azon képességét, hogy az AAV-fertőzött sejtek új AAV-vírusokat termeljenek; 2) lehetővé teszi a legfeljebb körülbelül 4 kb hosszúságú gének beillesztését (bár a vírustiter csökken a 3 kb-nál hosszabb transzgénekkel); és 3) gyakorlatilag megszünteti az AAV integrációs képességét. Az AAV kis mérete kihívást jelent néhány alkalmazás esetében. Például a CRISPR genomszerkesztéshez a kutatók az S. aureusból származó Cas9 nukleázt használják, mivel ez körülbelül 30%-kal rövidebb, mint az általánosan használt S. pyogenes Cas9 (Ran, et al., 2015).
A csomagoláshoz a Rep és a Cap egy másik plazmidra került, az Adenovírus segédgénjei pedig egy harmadik plazmidra, így az egész csomagolási rendszer biztonságos és segédvírusmentes (3. ábra).
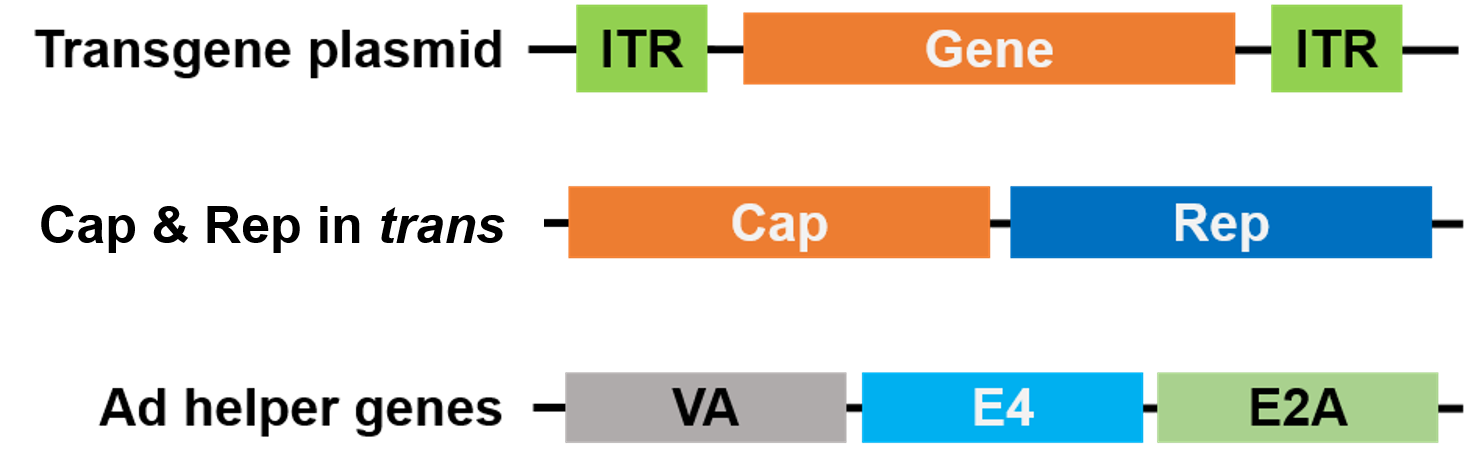 |
3. ábra. Segédvírusmentes AAV. A csomagoláshoz 3 plazmidot használtunk. Az érdeklődésre számot tartó gén plazmid (fent) tartalmazza az invertált terminális ismétlődéseket (ITR). A 2. plazmid (középen) az AAV Cap és Rep génjeit hordozza, a 3. plazmid (alul) pedig az Adenovírusból (Ad) |
Az AAV különböző szerotípusokban létezik, amelyek befolyásolják az AAV-fertőzés szövetspecifikumát. A több szerotípus lehetővé teszi a kutatók számára, hogy a) a gazdasejtek széles körét megfertőzzék; vagy b) a fertőzést egy vagy néhány szövetre korlátozzák. A GeneCopoeia AAVPrime™ AAV-részecskék több szerotípusban állnak rendelkezésre (2. táblázat).
| Serotípus | Primary target tissue | Description |
| AAV-1 | Muscle | Best for cardiac muscle, skeletal muscle, neuronal and glial tissue. |
| AAV-2 | izom, máj, retina | A leggyakrabban használt szerotípus. A legjobb neuronok, izom, máj és agy számára. |
| AAV-3 | Megakaryociták | A legjobb megakaryociták, izom, máj, tüdő és retina számára. |
| AAV-4 | Retina | A legjobb neuronok, izom, agy és retina számára. |
| AAV-5 | Tüdő | A legjobb a tüdő, az idegsejtek, az ízület, a retina és a hasnyálmirigy számára. |
| AAV-6 | izom, tüdő | Legjobb a tüdő, a máj és a szív számára. |
| AAV-7 | Az izom, retina, idegsejtek | Legjobb izom, idegsejtek és máj számára. |
| AAV-8 | Máj | Legjobb izom, agy, máj és retina számára. |
| AAV-9 | Változatos | Legjobb izom, szív, máj, tüdő és agy számára. |
| AAV-10 | Pleura, CNS | Cynomolgusból klónozva, szinte azonos az AAVrh10-el, kivéve 12 aminosavat a VP1-ben. Legjobb tüdőre, izomra, szívre, NCS-re és májra. |
| AAV-DJ | Változatos | 8 természetesen előforduló szerotípus keveréke. Hatékonyan transzdukálja a legkülönbözőbb sejttípusokat in vitro. |
| AAV-DJ/8 | Variáns | Az AAV-DJ egy heparinkötő domén (HBD) mutációval rendelkező változata, amely lehetővé teszi a máj és más szövetek in vivo fertőzését. |
Táblázat 2. A széles körben használt AAV-szerotípusok listája
AAVPrime™ AAV-részecskék a következő tulajdonságokkal rendelkeznek, amelyek rendkívül hasznossá teszik őket DNS-szállításra:
- Magas titerek. A tisztított részecskék titere akár 10^14 GC/ml (genom kópia/ml)
- Sokoldalúság. Több szerotípus lehetővé teszi a felhasználást a gazdasejtek széles vagy korlátozott körében
- Alacsony toxicitás. Nem integrálódik a gazdaszervezet genomjába.
- Alacsony immunogenitás. Minimális gazdaszervezeti immunválasz.
- Biztonságos. Nem hozható kapcsolatba semmilyen humán betegséggel
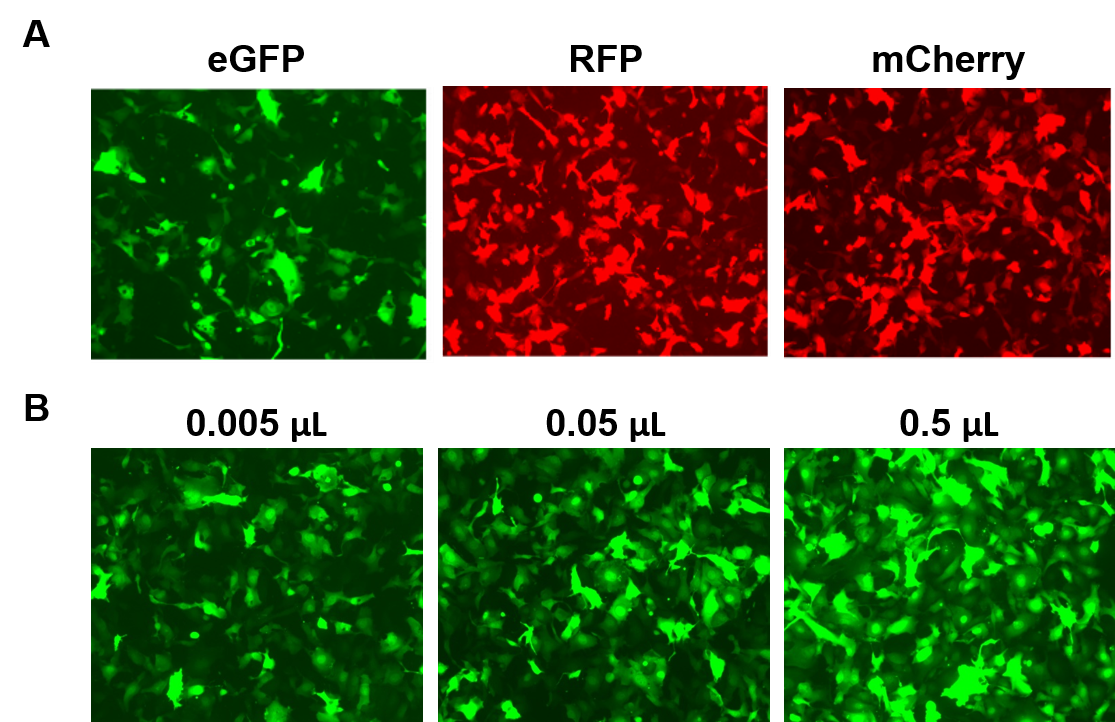
AAVPrime™ részecskék humán és egér ORF-ekhez 3 kb-ig, többféle szerotípusban és promóter opcióban, standard tisztaságban (csak in vitro használatra) vagy tisztítva (in vivo használatra) állnak rendelkezésre. A vásárlók rendelhetnek plazmidklónokat, egyedi generált részecskéket az őket érdeklő génekhez, vagy választhatnak előre elkészített, például fluoreszcens riportereket expresszáló génekkel rendelkező opciók közül (4. ábra).
|
4. ábra. A GeneCopoeia AAVPrime™ részecskék teljesítménye. A. HT1080 sejtek 24 lyukú lemezekben, amelyeket 0,5 µl standard tisztaságú, fokozott GFP-t (eGFP), vörös fluoreszcens fehérjét (RFP) és monomer Cherry-t (mCherry) expresszáló AAV-val transzdukáltak. B. HT1080 sejteket 24 lyukú lemezekben különböző mennyiségű eGFP-t expresszáló tisztított AAV-val transzdukáltunk. A sejteket fluoreszcens mikroszkóppal vizualizáltuk (expozíciós idő: 400 ms). |
|
Melyiket válasszam: Lentivírus vagy AAV?
A lentivírus és az AAV közötti választás számos tényezőtől függ. Például az a tény, hogy a lentivírusok integrálódnak a genomba, előny és hátrány is lehet, attól függően, hogy milyen igényeink vannak. A döntéshez segítséget nyújt az alábbi táblázat:
| Nagyobb inzertek | Stabil integráció | Nem. integráció | sejt/szövet specifitás | in vivo biztonságosság | |
| Lentivírus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Ha többet szeretne megtudni a GeneCopoeia vírusos rendszereiről és megrendelni, látogasson el weboldalunkra (https://www.genecopoeia.com/product/lentiviral-system/)
Következtetések
A GeneCopoeia-nál arra törekszünk, hogy a funkcionális genomika és sejtbiológia számára a legmagasabb minőségű, csúcstechnológiájú termékeket kínáljuk Önnek. A termékek széles skáláját kínáljuk az ORF-ekhez, génpromóterekhez, miRNS-ekhez, shRNS-ekhez és CRISPR-hez tartozó plazmid DNS-klónok genom-szintű készleteitől kezdve a nagy teljesítményű készleteken és reagenseken át a fluoreszcens sejtszerkezeti szondákhoz, a nukleinsav-kvantitációhoz és a jelölt antitestekhez szükséges termékekig. Ha többet szeretne megtudni, kérjük, látogasson el weboldalunkra, a www.genecopoeia.com, vagy lépjen kapcsolatba velünk a [email protected] címen.
DeKelver, et al. (2010). Funkcionális genomika, proteomika és szabályozó DNS-analízis izogén környezetben, cink-ujj nukleáz által vezérelt transzgenezissel a humán genom egy biztonságos kikötő lókuszába. Genome Res 20, 1133.
Dull, et al. (1998). Harmadik generációs lentivírusvektor feltételes csomagolási rendszerrel. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo genomszerkesztés Staphylococcus aureus Cas9 segítségével. Nature 526, 186.
Sakuma, et al. (2012). Lentivirális vektorok: az alaptól a transzlációig. Biochem. J. 443, 603.
Samulski és Muzyczka (2014). AAV-mediált génterápia kutatási és terápiás célokra. Annu. Rev. Virol. 1, 427.