A: Definire la costante di acidità
Sai senza dubbio che alcuni acidi sono più forti di altri. L’acidità relativa di diversi composti o gruppi funzionali – in altre parole, la loro capacità relativa di donare un protone a una base comune in condizioni identiche – è quantificata da un numero chiamato costante di acidità, abbreviato Ka. La base comune scelta per il confronto è l’acqua.
Consideriamo l’acido acetico come primo esempio. Se facciamo una soluzione diluita di acido acetico in acqua, si verifica una reazione acido-base tra l’acido (donatore di protoni) e l’acqua (accettore di protoni).
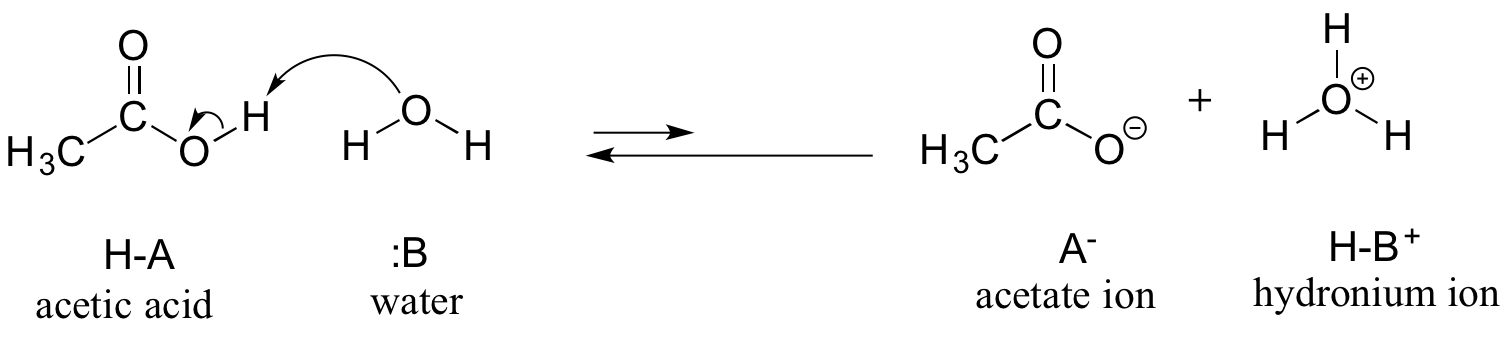
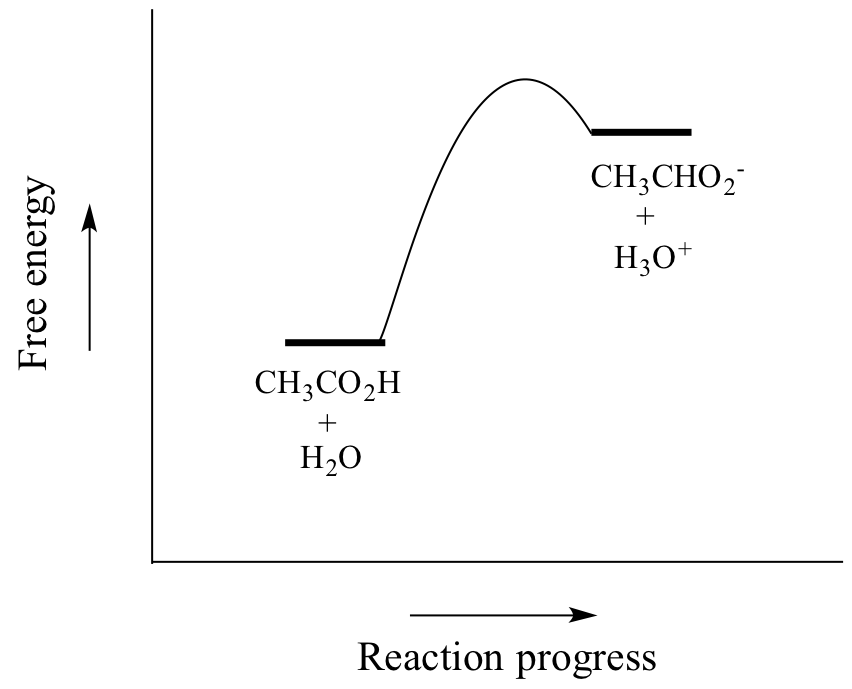
L’acido acetico è un acido debole, quindi l’equilibrio favorisce i reagenti sui prodotti – è termodinamicamente “in salita”, come indicato nella figura sopra dalla lunghezza relativa delle frecce di reazione in avanti e inversa, e nel diagramma delle coordinate di reazione qui sotto in cui i prodotti hanno un’energia maggiore dei reagenti.
Come sapete, la costante di equilibrio Keq è definita come:
![]()
Ogni espressione di costante di equilibrio è in realtà un rapporto delle attività di tutte le specie coinvolte nella reazione. Per evitare l’uso delle attività, e per semplificare le misure sperimentali, la costante di equilibrio delle concentrazioni approssima le attività dei soluti e dei gas nelle soluzioni diluite con le loro rispettive molarità. Tuttavia, le attività dei solidi, dei liquidi puri e dei solventi non sono approssimate con le loro molarità. Invece queste attività sono definite per avere un valore uguale a 1 (uno).
Quindi, se riconosciamo che l’attività dell’acqua in una soluzione diluita è approssimata con il valore dell’unità (1), possiamo dividere per 1 per ottenere la forma comune dell’espressione per Ka, la costante acida per l’acido acetico:
}{(1)} = \dfrac{}{}
In effetti, per una soluzione acquosa diluita, l’attività dell’acqua è approssimata con il valore di 1, quindi la costante di dissociazione generica per un dato acido HA o HB+ è espressa come:
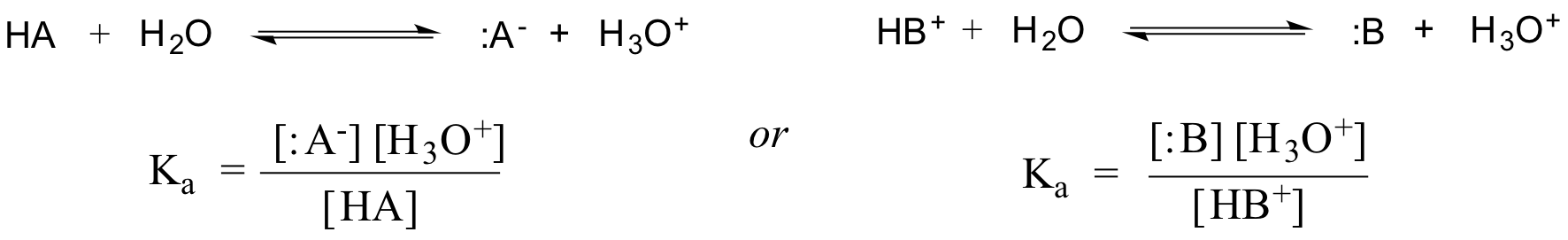
Il valore di Ka per l’acido acetico è 1.75 x 10-5 – molto meno di 1, indicando che c’è molto più acido acetico in soluzione all’equilibrio che acetato e ioni idronio.
Al contrario, l’acido solforico, con una Ka di circa 109, o l’acido cloridrico, con una Ka di circa 107, subiscono entrambi una dissociazione essenzialmente completa in acqua: sono acidi molto forti.
Un numero come 1,75 x 10-5 non è molto facile da dire, ricordare o visualizzare, così i chimici di solito usano un termine più conveniente per esprimere l’acidità relativa. Il valore pKa di un acido è semplicemente il log (base 10) del suo valore Ka.
pKa = -log Ka Ka = 10-pKa
Facendo i conti, troviamo che il pKa dell’acido acetico è 4,8. Il pKa dell’acido solforico è -10, e dell’acido cloridrico è -7. L’uso dei valori pKa ci permette di esprimere l’acidità relativa dei composti comuni e dei gruppi funzionali su una scala numerica di circa -10 (per un acido molto forte) a 50 (per un composto che non è affatto acido). Più basso è il valore pKa, più forte è l’acido.
I gruppi funzionali ionizzabili (che donano o accettano protoni) rilevanti per la chimica organica biologica hanno generalmente valori pKa che vanno da circa 5 a circa 20. I più importanti di questi sono riassunti qui sotto, con valori pKa molto approssimativi per le forme acide coniugate. Gruppi più acidi con valori di pKa vicini allo zero sono anche inclusi per riferimento.
Valori pKa approssimativi da conoscere
Ione idronio (H3O+): 0
alcool protonato: 0
carbonile protonato: 0
acidi carbossilici: 5
immine protonate: 7
ammine protonate: 10
fenoli: 10
tioli: 10
acqua: 14
alcoli: 15-18
acidi alfa-carbonio*: 20
*gli acidi alfa-carbonio saranno discussi più avanti in questo capitolo
Si raccomanda vivamente di memorizzare questi valori approssimativi ora – poi se hai bisogno di un valore più preciso, puoi sempre cercarlo in una tabella pKa.
Attenzione! pKa non è lo stesso di pH!
È importante capire che il pKa non è la stessa cosa del pH: il primo è una proprietà intrinseca di un composto o di un gruppo funzionale, mentre il secondo è una misura della concentrazione di ioni idronio in una data soluzione acquosa:
pH = -log
Conoscere i valori di pKa non solo ci permette di confrontare la forza degli acidi, ma anche quella delle basi. L’idea chiave da ricordare è questa: più forte è l’acido coniugato, più debole è la base coniugata. Possiamo determinare che lo ione idrossido è una base più forte dell’ammoniaca (NH3), perché lo ione ammonio (NH4+, pKa = 9,2) è un acido più forte dell’acqua (pKa = 14,0).
Esercizio 7.2.1
Qual è la base più forte, CH3O- o CH3S-? Ione acetato o ammoniaca? Ione idrossido o ione acetato?
Soluzione
Utilizziamo la nostra comprensione del concetto di pKa nel contesto di una molecola più complessa. Per esempio, qual è il pKa del composto qui sotto?
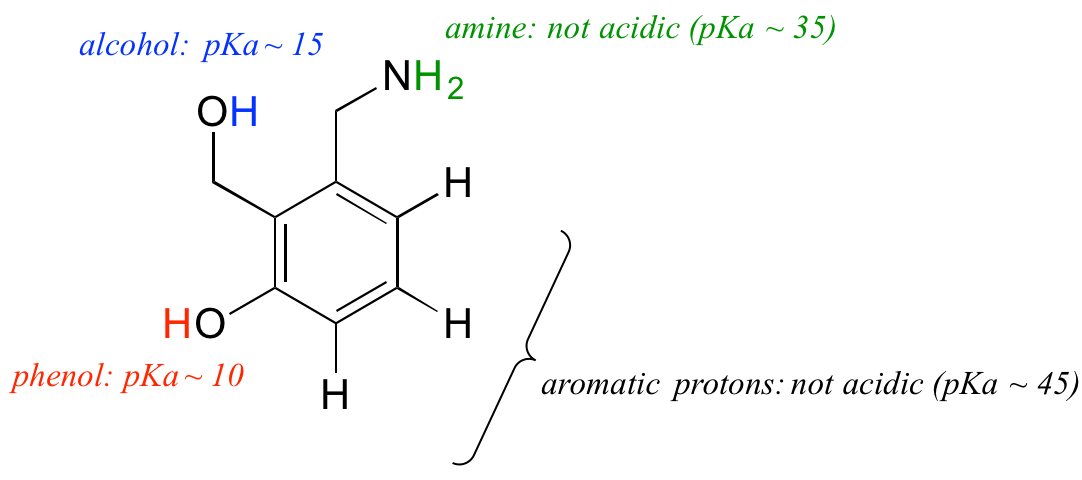
Dobbiamo valutare l’acidità potenziale di quattro diversi tipi di protoni sulla molecola, e trovare il più acido. I protoni aromatici non sono tutti acidi – il loro pKa è circa 45. Anche il gruppo amminico non è acido, il suo pKa è circa 35. (Ricorda, le ammine senza carica sono basiche: sono le ammine protonate con carica positiva, con valori pKa intorno a 10, che sono debolmente acide). Il protone dell’alcool ha un pKa di circa 15, e il protone del fenolo ha un pKa di circa 10: così, il gruppo più acido sulla molecola qui sopra è il fenolo (assicurati di poter riconoscere la differenza tra un fenolo e un alcool – ricorda, in un fenolo il gruppo OH è legato direttamente all’anello aromatico). Se questa molecola dovesse reagire con un equivalente molare di una base forte come l’idrossido di sodio, è il protone del fenolo che verrebbe donato per formare un anione fenolato.
Esercizio 7.2.2
Identificare il gruppo funzionale più acido su ciascuna delle molecole seguenti, e dare il suo pKa approssimativo.

Soluzione