La definizione Brønsted-Lowry di acidità e basicità
Iniziamo la nostra discussione sulla chimica acido-base con un paio di definizioni essenziali. La prima di queste fu proposta nel 1923 dal chimico danese Johannes Brønsted e dal chimico inglese Thomas Lowry, ed è conosciuta come la definizione Brønsted-Lowry di acidità e basicità. Un acido, secondo la definizione Brønsted-Lowry, è una specie che agisce come donatore di protoni, mentre una base è un accettore di protoni. Abbiamo già discusso nel capitolo precedente uno degli esempi più familiari di una reazione acido-base di Brønsted-Lowry, tra l’acido cloridrico e lo ione idrossido:
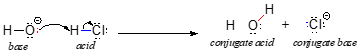
In questa reazione, un protone è trasferito da HCl (l’acido, o donatore di protoni) allo ione idrossido (la base, o accettore di protoni). Come abbiamo imparato nel capitolo precedente, le frecce curve rappresentano il movimento degli elettroni in questo processo di rottura e formazione dei legami.
Dopo che un acido di Brønsted-Lowry dona un protone, ciò che rimane è chiamato base coniugata. Lo ione cloruro è quindi la base coniugata dell’acido cloridrico. Al contrario, quando una base di Brønsted-Lowry accetta un protone, si trasforma nella sua forma di acido coniugato: l’acqua è quindi l’acido coniugato dello ione idrossido.
Ecco una reazione organica acido-base, tra acido acetico e metilammina:
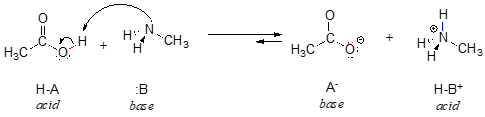
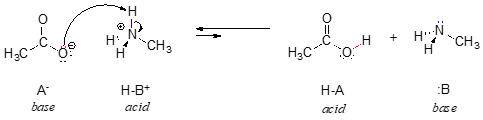
Nell’inverso di questa reazione, lo ione acetato è la base e lo ione metilammonio (metilammina protonata) è l’acido.
Cosa rende un composto acido (probabile che doni un protone) o basico (probabile che accetti un protone)? Rispondere a questa domanda è uno dei nostri compiti principali in questo capitolo, e ci richiederà di mettere in pratica molto di ciò che abbiamo imparato sulla struttura organica nei primi due capitoli, così come le idee sulla termodinamica che abbiamo rivisto nel capitolo 6.
Per ora, consideriamo solo una proprietà comune delle basi: per agire come base, una molecola deve avere una coppia reattiva di elettroni. In tutte le reazioni acido-base che vedremo in questo capitolo, la specie basica ha un atomo con una coppia solitaria di elettroni. Quando la metilammina agisce come base, per esempio, la coppia solitaria di elettroni sull’atomo di azoto è usata per formare un nuovo legame con un protone.
E’ chiaro che lo ione metilammonio non può agire come base – non ha una coppia reattiva di elettroni con cui accettare un protone.
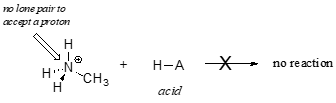
Più tardi, nel capitolo 14, studieremo le reazioni in cui una coppia di elettroni in un legame di un alchene o di un anello aromatico agisce in modo basico – ma per ora, ci concentreremo sulla basicità degli elettroni non leganti (coppia solitaria).
Esercizio \(\PageIndex{1})
Completa le reazioni qui sotto – in altre parole, disegna le strutture degli acidi coniugati e delle basi coniugate mancanti che risultano dalle frecce curve fornite.