Definizione della costante di acidità
Sai senza dubbio che alcuni acidi sono più forti di altri. L’acidità relativa di diversi composti o gruppi funzionali – in altre parole, la loro capacità relativa di donare un protone a una base comune in condizioni identiche – è quantificata da un numero chiamato costante di acidità, abbreviato \(K_a\). La base comune scelta per il confronto è l’acqua.
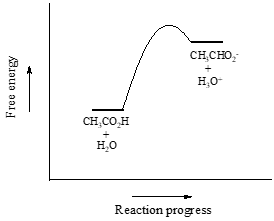
Consideriamo l’acido acetico come primo esempio. Se facciamo una soluzione diluita di acido acetico in acqua, si verifica una reazione acido-base tra l’acido (donatore di protoni) e l’acqua (accettore di protoni).

L’acido acetico è un acido debole, quindi l’equilibrio favorisce i reagenti sui prodotti – è termodinamicamente “in salita”. Questo è indicato nella figura sopra dalla lunghezza relativa delle frecce di reazione in avanti e inversa.
La costante di equilibrio \(K_eq}\ è definita come:
}{} = \frac{}{}]
Ricorda che questa è una soluzione acquosa diluita: abbiamo aggiunto una piccola quantità di acido acetico ad una grande quantità di acqua. Pertanto, nel corso della reazione, la concentrazione di acqua (circa 55,6 mol/L) cambia molto poco, e può essere trattata come una costante.
Se spostiamo il termine costante per la concentrazione di acqua sul lato sinistro dell’espressione della costante di equilibrio, otteniamo l’espressione per \(K_a\), la costante acida per l’acido acetico:
\ = \frac{}{}]
In termini più generali, la costante di dissociazione per un dato acido HA o HB+ è espressa come:
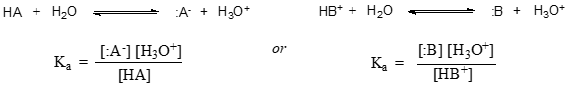
Il valore di \(K_a\) per l’acido acetico è \(1.75 volte 10^{-5} – molto meno di \(1\), indicando che c’è molto più acido acetico in soluzione all’equilibrio che acetato e ioni idronio.
Inversamente, l’acido solforico, con una \(K_a\) di circa \(10^9\), o l’acido cloridrico, con una \(K_a\) di circa \(10^7\), entrambi subiscono una dissociazione essenzialmente completa in acqua: sono acidi molto forti.
Un numero come \(1,75 volte 10^{- 5}} non è molto facile da dire, ricordare o visualizzare, così i chimici di solito usano un termine più conveniente per esprimere l’acidità relativa. Il valore \(pK_a\) di un acido è semplicemente il log (base 10) del suo valore \(K_a\).
Facendo i conti, troviamo che il \(pK_a\) dell’acido acetico è \(4.8\). Il \(pK_a\) dell’acido solforico è -10, e dell’acido cloridrico è -7. L’uso dei valori \(pK_a\) ci permette di esprimere l’acidità relativa dei composti comuni e dei gruppi funzionali su una scala numerica di circa -10 (per un acido molto forte) a 50 (per un composto che non è affatto acido). Più basso è il valore \(pK_a\), più forte è l’acido.
I gruppi funzionali ionizzabili (che donano o accettano protoni) rilevanti per la chimica organica biologica hanno generalmente valori \(pK_a\) che vanno da circa 5 a circa 20. I più importanti di questi sono riassunti qui sotto, con valori \(pK_a\) molto approssimativi per le forme acide coniugate. Altri gruppi acidi con valori \(pK_a\) vicini allo zero sono anche inclusi come riferimento.
Valori \(pK_a\) tipici
| gruppo | approssimativo \(pK_a\) |
|---|---|
| Ione idronio | 0 |
| alcool protonico | 0 |
| carbonile protonico | 0 |
| acidi carbossilici | 5 |
| imine protonate | 7 |
| ammine protonate | 10 |
| fenoli | 10 |
| tioli | 10 |
| alcoli acqua | 15 |
| acidi (\alfa)-carbonici * | 20 |
* acidi (\alfa)-carbonici sarà spiegato nella sezione 7.6A
Si raccomanda vivamente di memorizzare questi valori approssimativi ora – poi se avete bisogno di un valore più preciso, potete sempre cercarlo in una tabella \(pK_a\) più completa. L’appendice di questo libro contiene una tabella più dettagliata dei valori tipici di \(pK_a\), e tabelle molto più complete sono disponibili in risorse come l’Handbook of Chemistry and Physics.
(pK_a\) vs. \È importante rendersi conto che \(pK_a\) non è la stessa cosa di \(pH\): il primo è una proprietà intrinseca di un composto o gruppo funzionale, mentre il secondo è una misura della concentrazione di ioni idronio in una data soluzione acquosa:
\\]
Conoscere i valori di \(pK_a\) non solo ci permette di confrontare la forza degli acidi, ma anche quella delle basi. L’idea chiave da ricordare è questa: più forte è l’acido coniugato, più debole è la base coniugata. Possiamo determinare che lo ione idrossido è una base più forte dell’ammoniaca (\(NH_3\)), perché lo ione ammonio (\(NH4^+\), \(pK_a = 9.2\)) è un acido più forte dell’acqua (\(pK_a = 15.7\)).
Esercizio \(\PageIndex{1})
Qual è la base più forte, \(CH_3O^-\) o \(CH_3S^-\)? Ione acetato o ammoniaca? Ione idrossido o ione acetato?
Utilizziamo la nostra comprensione del concetto di \(pK_a\) nel contesto di una molecola più complessa. Per esempio, qual è il \(pK_a\) del composto qui sotto?

Dobbiamo valutare l’acidità potenziale di quattro diversi tipi di protoni sulla molecola, e trovare il più acido. I protoni aromatici non sono tutti acidi – il loro \(pK_a\) è circa 45. Anche il gruppo amminico non è acido, il suo \(pK_a\) è circa 35. (Ricorda, le ammine senza carica sono basiche: sono le ammine protonate con carica positiva, con valori di \PK_a\ intorno a 10, che sono debolmente acide). Il protone dell’alcool ha un \(pK_a\) di circa 15, e il protone del fenolo ha un \(pK_a\) di circa 10: così, il gruppo più acido sulla molecola qui sopra è il fenolo (assicurati di poter riconoscere la differenza tra un fenolo e un alcool – ricorda, in un fenolo il gruppo \(OH\) è legato direttamente all’anello aromatico). Se questa molecola dovesse reagire con un equivalente molare di una base forte come l’idrossido di sodio, è il protone del fenolo che verrebbe donato per formare un anione fenolato.
Esercizio \(\PageIndex{2})
Identificare il gruppo funzionale più acido su ciascuna delle molecole seguenti, e dare il suo \(pK_a\) approssimativo.