- Introduzione
- Risultati
- L’accumulo di cellule e l’attaccamento al minerale richiedono geni di chemiotassi e trasporto extracellulare di elettroni in S. oneidensis MR-1
- Caratterizzazione della congregazione intorno a IEA in altri ceppi di Shewanella
- Discussione
- Materiali e metodi
- Coltivazione e ceppi
- Sintesi minerale
- Esperimenti di accumulo di cellule dopo photo-bleaching (CAAP) time-lapse
- Microscopia cattura dei movimenti delle cellule
- Analisi del nuoto
- Contributi Autore
- Dichiarazione di conflitto di interessi
- Riconoscimenti
- Materiale supplementare
Introduzione
Alla fine degli anni ’80, Shewanella oneidensis MR-1 (Myers e Nealson, 1988a) e successivamente diverse specie di Geobacter (Lovley et al., 1993; Champine et al, 2000) hanno dimostrato di essere capaci di trasferire elettroni ad accettatori di elettroni insolubili (IEA), come ossidi metallici insolubili e/o elettrodi carichi: un processo chiamato trasporto extracellulare di elettroni (EET) (Myers e Nealson, 1988b; Venkateswaran et al., 1999; Bond e Lovley, 2003). Questa capacità ha attirato un notevole interesse per quanto riguarda il ciclo biogeochimico, il biorisanamento, la corrosione, la lavorazione di nano-materiali e la produzione di energia (Bretschger et al., 2007; Kan et al., 2011; Hsu et al., 2012). Mentre diversi gruppi di microbi sono noti per essere capaci di EET, importanti studi meccanicistici sono stati fatti con solo due sistemi modello, Shewanella (Fredrickson et al., 2008; Shi et al., 2009), e Geobacter (Lovley et al, Finora, più di 100 altri ceppi di Shewanella sono stati isolati da un’ampia varietà di habitat, tra cui colonne d’acqua aperte, scisti arenari, sedimenti marini e d’acqua dolce, oleodotti, salamoia e persino comunità algali in cima al ghiaccio antartico (Hau e Gralnick, 2007). I genomi di più di 20 di queste specie sono stati completamente sequenziati (Fredrickson et al., 2008). Molte di queste specie hanno dimostrato di essere capaci di EET a IEA, tra cui S. oneidensis MR-1, Shewanella putrefaciens CN32, S. sp. ANA-3, S. sp. W3-18-1, Shewanella amazonensis SB2B, Shewanella frigidimarina NCIMB 400, e Shewanella loihica PV-4 (Fredrickson et al., 1998; Venkateswaran et al., 1998; Gao et al., 2006; Bretschger, 2008). Altri membri del genere Shewanella come Shewanella baltica OS217 e Shewanella denitrificans OS155 (Tabella 1) non sono capaci di EET (Brettar et al., 2002). Di tutti questi ceppi, la congregazione in risposta a IEA è stata studiata solo per MR-1.

Tabella 1. Confronto genetico di Shewanella spp. e del loro habitat originale.
Nel genere Shewanella, il meccanismo EET di MR-1 è stato il più ampiamente caratterizzato. MR-1 impiega diversi approcci per la riduzione degli AIE insolubili: (1) EET diretta attraverso i citocromi multime extracellulari (Beliaev e Saffarini, 1998; Myers e Myers, 2001, 2002; Meyer et al., 2004; Mitchell et al., 2012; Kracke et al., 2015) (Figura 1A); (2) EET mediata utilizzando navette elettroniche solubili legate a citocromi di membrana (Lovley et al., 1996; Marsili et al., 2008; Li et al., 2012; Kotloski e Gralnick, 2013; Okamoto et al, 2014); (3) EET mediata utilizzando estensioni di membrana esterna conduttiva che contengono citocromi (Gorby et al., 2006; El-Naggar et al., 2010); e (4) matrici extracellulari conduttive contenenti minerali conduttivi e semiconduttivi (Kato et al., 2010). Diversi geni sono stati identificati nel ceppo MR-1 e dimostrato di essere essenziale per EET (Figura 1A e Tabella 2), tra cui il citocromo tetrame c cymA (SO_4591) e la combinazione di mtrBC/omcA (SO_1776, SO_1778, e SO_1779) che codifica per il componente decaheme citocromo c e tetraheme citocromo c necessario per la riduzione di diversi accettori di elettroni anaerobici, tra cui ossidi di metallo (Myers e Myers, 2001, 2002; Schwalb et al., 2003). Poiché tutti questi meccanismi si basano sulla vicinanza delle cellule alla IEA per l’EET, è importante capire il rilevamento delle cellule e la migrazione netta di nuoto verso la IEA. Per quanto riguarda la congregazione, redox taxis o energy taxis, molti studi sono stati condotti su MR-1 a causa della sua versatile utilizzazione dell’accettore di elettroni (Bencharit e Ward, 2005; Baraquet et al., 2009; Harris et al., 2010). La tassazione energetica è un termine che comprende ampiamente l’aerotassi, la fototassi, la tassazione redox, la tassazione verso accettori di elettroni alternativi e la chemiotassi verso substrati ossidabili (Alexandre et al., 2004).
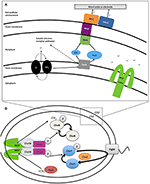
Figura 1. (A) Il trasporto extracellulare di elettroni (EET) in Shewanella oneidensis MR-1 costruisce la forza motrice protonica (pmf). In condizioni anaerobiche membri del genere Shewanella può trasportare elettroni dalla membrana interna, periplasma, membrana esterna, e un elettrodo attraverso una catena di citocromi e menachinoni (MQ) conosciuto collettivamente come trasporto extracellulare di elettroni (EET). L’espressione dei citocromi EET può fluttuare in base all’accettore di elettroni disponibile nell’ambiente. Il numero di gruppi eme di tipo c contenenti ferro è indicato all’interno (parentesi). I flussi di elettroni dai donatori di elettroni, come il lattato, per ridurre i chinoni (Q), che contemporaneamente trasferiscono H+ nel periplasma, costruendo pmf, mentre passano anche gli elettroni a CymA. In assenza di accettori di elettroni solubili, gli elettroni sono trasferiti al complesso di membrana esterna MtrCAB. Questo complesso MtrCAB può donare elettroni direttamente all’accettore di elettroni terminale, sia all’elettrodo minerale o anodico, o attraverso molecole di flavina. Il pmf guida la produzione di ATP e la rotazione del flagello polare. “Self-sensing” proteine metil-accettanti chemiotassi (MCPs) controllo rotazione flagello tramite il sistema di trasduzione del segnale chemiotassi (B) e può rilevare i cambiamenti nella concentrazione di H + durante la riduzione del metallo. (B) Probabile via di trasduzione del segnale di chemiotassi in Shewanella. In risposta alla stimolazione, la struttura di MCP si sposta come un pistone, causando l’autofosforilazione di CheA per rallentare o fermare. CheY e CheB non sono, quindi, fosforilati, e questa mancanza di CheY-P permette un nuoto regolare. Questa stimolazione ha anche un altro effetto: CheB è inattivo senza fosforilazione (non può funzionare come metilesterasi) e questo permette alla proteina CheR (una metiltrasferasi continuamente attiva) di superare la concorrenza e metilare liberamente la regione dimerica di MCP (dominio HAMP). Questa metilazione del MCP agisce per aumentare il tasso di auto-fosforilazione del residuo di istidina CheA. Pertanto, il sistema di trasduzione del segnale ha il controllo sulla frequenza di inversione flagellare in presenza di stimoli aumentati o diminuiti, portando ad una serie di nuoto “run-and-reversal”.

Tabella 2. Geni di MR-1 descritti nel testo.
E’ ben documentato che l’accumulo di cellule MR-1 in risposta ad accettori di elettroni solubili è una forma di taxi energetico, che dipende dal flusso di H+ e dall’instaurazione di una forza motrice protonica (Baraquet et al., 2009) (Figura 1). Una parte di questa risposta include un nuoto più rapido, come si è visto anche con navette di elettroni come la riboflavina o l’antrachinone 2,6-disolfonato (AQDS) (Bencharit e Ward, 2005; Harris et al., 2010; Li et al., 2012). Al contrario, l’accumulo di cellule intorno alla IEA, che è stato chiamato congregazione (Nealson et al., 1995), comporta sia un aumento della velocità di nuoto al contatto con la IEA (chiamata elettrocinesi), sia un aumento delle inversioni di nuoto al diminuire del PMF. Le inversioni di nuoto permettono molteplici incontri transitori cellula-IEA (della durata di 1-100 ms), e il tasso al quale le cellule che nuotano passano all’attaccamento irreversibile alla IEA durante la congregazione non è ancora stato quantificato.
Il meccanismo o i meccanismi che le cellule utilizzano per localizzare le IEA rimangono poco chiari (Nealson et al., 1995; Bencharit e Ward, 2005; Harris et al., 2010). I primi rapporti hanno proposto che l’altro organismo modello studiato, Geobacter, si accumula intorno alle AIE percependo un gradiente di ioni metallici ridotti (Childers et al., 2002), tuttavia, gli ioni metallici ridotti non sono coinvolti nel meccanismo di rilevamento utilizzato da MR-1 (Bencharit e Ward, 2005). La congregazione batterica in risposta agli elettrodi in bilico è stata recentemente descritta, indicando il rilevamento redox, piuttosto che il rilevamento di ioni metallici, come l’innesco della risposta (Harris et al., 2010). I potenziali positivi applicati all’elettrodo (200-600 mV contro Ag/AgCl) hanno causato la congregazione di MR-1 simile a quella vista con gli ossidi metallici (Harris et al., 2012). I potenziali redox dei minerali contenenti MnO2 variano tra 400 e 600 mV vs. Ag/AgCl e accettano elettroni più facilmente dei minerali Fe(OH)3, che portano l’equivalente potenziale in bilico di 100-300 mV vs. Ag/AgCl (Burdige, 1993). In uno studio precedente, si è ipotizzato che il caratteristico nuoto di MR-1 intorno a IEA fosse regolato da due recettori di chemiotassi autosensibili, le proteine metil-accettanti (MCP) con dominio Cache (Ca+ channel chemotaxis receptor) (SO_2240) e domini Per/Arnt/Sim (PAS) (SO_1385), e dalla chemotaxis signal transduction protein kinase CheA-3 (SO_3207) per permettere alla cellula di campionare il potenziale redox, o la capacità di accettare elettroni di una superficie (Tabella 2 e Figura 1B) (Harris et al., 2012). Prima di questo studio, i geni responsabili dell’attaccamento guidato dalla motilità delle cellule su e intorno alla IEA erano sconosciuti.
In questo rapporto, studiamo il meccanismo di congregazione di diversi ceppi di Shewanella monitorando i modelli di nuoto e gli attacchi cellulari a MnO2 e Fe(OH)3. Oltre allo screening del WT e di diversi mutanti di delezione di MR-1, sono state esaminate altre specie di Shewanella (vedi tabella 1). Molti ceppi hanno dimostrato di essere in grado di conglobare sia MnO2 che FeOH3, mentre altri hanno risposto selettivamente a MnO2 (SB2B) o Fe(OH)3 (W3-18-1). Quando l’attaccamento delle cellule alle superfici minerali è stato monitorato, abbiamo osservato una forte correlazione tra la capacità della cellula di congregarsi e l’attaccamento delle cellule alla superficie IEA. Abbiamo quindi confrontato i genomi di queste specie per trovare i geni candidati coinvolti nel nuoto di congregazione, nell’accumulo e nei fenotipi di attaccamento delle cellule in risposta a specifiche superfici IEA.
Risultati
L’accumulo di cellule e l’attaccamento al minerale richiedono geni di chemiotassi e trasporto extracellulare di elettroni in S. oneidensis MR-1
La maggior parte dei primi studi sull’energia dei taxis in MR-1 hanno utilizzato un metodo di saggi su piastra a sciame (Nealson et al., 1995; Baraquet et al., 2009; Li et al., 2012). Qui, offriamo una caratterizzazione più approfondita di questi meccanismi di energia ancora sconosciuti taxi utilizzando un metodo quantitativo di monitoraggio del nuoto delle singole cellule attraverso mezzi liquidi in risposta a IEA e l’accumulo di cellule dopo photo-bleaching (CAAP) per misurare il tasso di attaccamento delle cellule (Li et al., 2010). CAAP utilizza l’irradiazione da un microscopio confocale laser UV per scurire irreversibilmente (spegnere la fluorescenza di) cellule marcate GFP su e intorno a un dato IEA. Quantificando le cellule fluorescenti mentre si muovono nella zona oscurata, i tassi di accumulo e di attaccamento possono essere quantificati, e ceppi diversi confrontati. Per essere considerata attaccata, la posizione della cellula mobile è verificata analizzando un’immagine 3D del campo visivo. Se la cellula si ferma sulla superficie minerale, allora la cellula è considerata “attaccata”. La forza dei legami tra le cellule MR-1 stazionarie e le superfici è stata misurata con pinzette ottiche in uno studio separato (Gross e El-Naggar, 2015). Questo metodo permette di distinguere tra l’attaccamento diretto delle cellule e l’attaccamento elettrostatico casuale.
Come mostrato nella Figura 2, le cellule WT MR-1 attaccate alla superficie minerale dopo 30 minuti con qualche grande deviazione nel numero, 2.655 ± 1.352 cellule/mm2. Durante questo tempo, le cellule mostrano “toccare e andare” nuoto, facendo contatto transitorio con la superficie minerale MnO2. Dopo 2 h, il numero di nuove cellule attaccate alla superficie minerale è aumentato a 4.300 ± 584 cellule/mm2 di superficie minerale, mentre ulteriori cellule mobili hanno continuato a riunirsi (Video S1, S2, e S17). Mutanti con delezioni triple in chiave EET geni mtrBC/omcA (SO_1776, SO_1778, SO_1779), delezione singola di cymA (SO_4591) e il principale chemorecettore energia fiscale MCP Cache (SO_2240) sono stati precedentemente collegati al fenotipo congregazione nuoto (Harris et al., 2012). Mutanti di delezione (ΔcymA, Δmcp_cache, e ΔmtrBC / omcA) erano tutti mobili e in grado di invertire la direzione di nuoto, ma erano incapaci di congregazione e ha mostrato poco o nessun attaccamento a MnO2 durante l’esperimento (Figura 2C e figure S1A, B). WT accumulo in zona sbiancata a t = 2 h medie 4.300 ± 584 cellule / mm2 mentre Δmcp_cache, e ΔmtrBC / omcA mutanti si accumulano in numeri trascurabili (Figura 2C e S1CD).
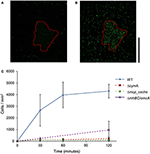
Figura 2. Nuoto MR-1 può migrare verso minerali insolubili accettore di elettroni e allegare. Immagine rappresentativa di microscopia a fluorescenza confocale di cellule WT MR-1 a t = 0 e t = 120 min (A,B). Nuoto WT MR-1 cellule GFP sono stati introdotti alla particella MnO2 (contorno rosso punteggiato) in anaerobica capillare sigillato. A t = 0 tutte le cellule sono state irreversibilmente foto-biancato in un 250 da 250 micron area intorno particella (A). Cellule fluorescenti dall’esterno della zona sbiancata che nuotano in cornice e allegare alla superficie minerale sono stati poi contati. La barra nera della scala verticale sulla destra rappresenta 100 μm. Grafico (C) confronta WT MR-1 attaccamento sulla particella MnO2 oltre 120 min con chemiotassi e trasferimento di elettroni extracellulare mutanti deletion (MR-1 Δmcp_cache, ΔcymA, e ΔmtrBC / omcA). Le barre di errore includono 2 deviazioni std.
Caratterizzazione della congregazione intorno a IEA in altri ceppi di Shewanella
Nove ceppi di Shewanella sono stati testati per la loro capacità di congregarsi intorno alle superfici minerali di MnO2 e Fe(OH)3 con il saggio di serie temporale di attaccamento delle cellule al minerale (Tabella 3 e Video S3-S14). Come con MR-1, tutti i nove ceppi esaminati avevano un singolo flagello polare e l’inversione della direzione di nuoto è stata realizzata tramite l’inversione della rotazione flagellare (dati non mostrati). Le tracce di nuoto all’interno dello stesso esperimento sono stati ordinati in due gruppi separati in base al percorso di nuoto (Tabella 3): quelli che hanno contattato superficie di ossido di metallo insolubile (nuotato entro 2 um) rispetto a quelli che non hanno contatto (nuotato > 2 um). Contatto nuotatori che hanno dimostrato un aumento significativo della frequenza di inversione e velocità di nuoto rispetto al gruppo senza contatto (P < 0.05) sono classificati come positivo per il comportamento congregazione come indicato con lettere apice (Tabella 3).

Tabella 3. Batteri velocità di nuoto e frequenza di inversione intorno a minerali di ossido di metallo.
Strains ANA3, CN32, e PV-4, oltre a MR-1, erano positivi per la congregazione intorno sia MnO2 e Fe(OH)3 (Tabella 3, Figura 3; Video S1-S8). Hanno mostrato i massimi tassi di inversione quando si trovavano tra 5 e 40 μm dalla superficie delle particelle MnO2 o FeOH3 (Figura 3). Tre ceppi: OS217, NCIMB400, e OS155 non erano mobili al tempo t = 30 min-in risposta a Fe (OH) 3 o minerali MnO2 (Tabella 3). Per esempio, la frequenza di inversione delle cellule MR-1 nuoto contatto MnO2 era 0,94 ± 0,53 inversioni / s, mentre la frequenza di inversione delle cellule non a contatto era 0,62 ± 0,73 inversioni / s. Anche la velocità è aumentata nel gruppo a contatto di MR-1 da 19,26 ± 11,2 μm/s nel gruppo senza contatto a 24,37 ± 6 μm/s nel gruppo a contatto. Poiché c’era sia un aumento statisticamente significativo della velocità di nuoto che delle inversioni in modo da permettere alle cellule di rimanere vicino alla particella di ossido di metallo, questo ceppo è stato detto essere positivo alla congregazione.
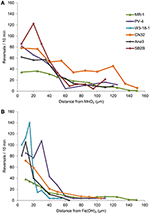
Figura 3. (A,B) Frequenza di inversione (asse y) di nuoto cellule Shewanella vs. distanza (asse x) da particelle IEA. Le frequenze medie di inversione di singole cellule di nuoto tracciati sono divisi in bidoni di 5 micron lungo l’asse x per gli esperimenti con MnO2 (A) o Fe (OH) 3 particella (B).
Shewanella spp. nuoto tracce (30 s) che ha dimostrato una preferenza per minerali di ossido di metallo sono evidenziati in figure 4A-F. Figura SB2B cellule visualizzate nessuna risposta di nuoto a Fe (OH) 3 (Figura 4D) mentre esibendo congregazione attiva intorno a particelle MnO2 (Figura 4A). Al contrario, W3-18-1 cellule congregati intorno Fe (OH) particelle 3 (Figura 4C), ma ha mostrato nuoto significativamente diminuita e inversione di attività intorno MnO2 (Figura 4F; Video S9, S14).
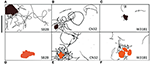
Figura 4. (A-F) Pannello di tre Shewanella spp. tracce di nuoto (30 s) ha dimostrato una preferenza per i minerali di ossido di metallo. Il comportamento di nuoto di tre Shewanella spp. mobili in risposta a MnO2 (fila superiore – particella di colore nero) e Fe(OH)3 (fila inferiore – particella di colore arancione) è stato studiato. Congregazione si verifica in condizioni anaerobiche, tracce di nuoto sono mostrati in nero. SB2B (sinistra), CN32 (centro), e W3181 (destra). Il nuoto delle cellule è stato tracciato a mano. La barra della scala in alto a sinistra = 50 μm. La forma di colore marrone rappresenta MnO2 e l’arancione rappresenta Fe(OH)3. Quando non sono state rilevate cellule mobili, ciò è indicato dall’assenza di linee nere.
Discussione
I membri del genere Shewanella sono composti da aerobi eterotrofi e facoltativi capaci di utilizzare una vasta gamma di sostanze organiche e inorganiche come fonti di energia. Molti ceppi di Shewanella sono stati isolati dalla colonna d’acqua e dagli habitat dei sedimenti in tutto il mondo. Oltre agli accettori di elettroni solubili, molti di questi organismi possono respirare un ampio assortimento di ossidi metallici insolubili presenti in natura in condizioni anossiche.
Nel nostro studio del comportamento di congregazione in otto specie Shewanella, abbiamo usato il monitoraggio delle cellule con l’analisi del computer e il saggio di serie temporale di attaccamento delle cellule a MnO2 o Fe (OH)3 per dimostrare che cinque su otto shewanellae erano in grado di questo comportamento CN32, ANA-3, W3-18-1, SB2B, e PV-4) e che alcuni ceppi (W3-18-1, SB2B) mostrano una preferenza per un ossido di metallo rispetto all’altro in queste condizioni (Figura 4). Tali risultati sono coerenti con la nozione che questi batteri si sono adattati all’accettore di elettroni insolubile prevalente trovato nell’habitat da cui sono stati isolati. Inoltre, tre ceppi di Shewanella che sono stati isolati dalla colonna d’acqua non si sono riuniti in risposta all’IEA. Se queste differenze derivano dall’assenza di geni coinvolti in EET (come nel OS217) o altre ragioni sarà un punto per studi futuri.
In altri studi, la crescita notturna dei ceppi Shewanella confrontando i tassi di riduzione di vari ossidi di metallo in confronto testa a testa, hanno dimostrato di ridurre l’ossido di metallo preferenzialmente dalla loro nicchia ambientale (Bretschger et al., 2007). I risultati qui presentati sono coerenti con l’ipotesi che le specie Shewanella hanno evoluto una congregazione e comportamento di attaccamento coerente con gli ambienti da cui sono stati isolati (Tabella 3). Per esempio, W3-18-1 sembra rivelare una significativa inclinazione per la congregazione in presenza e l’attaccamento ai minerali Fe(OH)3 nativi della piattaforma continentale del Pacifico (Harris et al., 2012) mentre SB2B preferisce MnO2 (Venkateswaran et al, 1998) simile a quello del sedimento del Rio delle Amazzoni.
Il confronto genomico in Tabella 1 suggerisce che la presenza del citocromo ottame (SO_4142) può essere importante per il nuoto in risposta a potenziali redox relativamente “bassi” (100-300 mV vs Ag/AgCl) di Fe(OH)3. Mentre mtrF (SO_1780) potrebbe essere necessario per la risposta a potenziali redox relativamente “alti” di MnO2 (tra 400 e 600 mV vs. Ag/AgCl). Questa ipotesi potrebbe poi essere testata con mutanti di delezione in MR-1. Questo lavoro completa il lavoro precedente di Harris et al. (2012), rivelando che i geni coinvolti con l’effetto netto del comportamento motilità verso minerali IEA o elettrodi è cumulativo attraverso scale temporali rilevanti di 1-30 min (Figura 2) (Harris et al., 2012). I nostri risultati con la tecnica di microscopia confocale CAAP, hanno dimostrato che la congregazione porta ad una lenta migrazione delle cellule verso i minerali IEA con eventuale attaccamento. Così, questo comportamento è opportunamente chiamato congregazione, in quanto descrive la raccolta o l’accumulo di batteri mobili intorno a IEA. Abbiamo dimostrato qui che i geni mcp cache e mtrBC/omcA sono essenziali per l’accumulo e fenotipo di attaccamento in MR-1, oltre ad essere responsabile per i modelli caratteristici di nuoto di aumento della velocità e il comportamento di tipo run-and-reversal che è stato identificato in precedenza (Harris et al., 2012).
I risultati degli esperimenti con i mutanti ΔcymA, ΔmtrBC/omcA, e Δmcp_cache in MR-1 mostrano un’inibizione di accumulo, attaccamento e comportamento di congregazione in risposta a tutte le AIE. Pertanto, si può ipotizzare che la presenza di geni EET omologhi (cymA, mtrB, mtrC, omcA), e il gene della chemiotassi accettante metile (mcp_cache) determina le risposte fenotipiche che vediamo in altre Shewanella spp. (Tabella 3). Il confronto genetico dei ceppi che potrebbero rispondere a un potenziale redox “più basso” IEA, indica che i citocromi dell’ottame della membrana esterna periferica (come SO_4142) possono avere un ruolo nella risposta a un potenziale redox “più basso” IEA. Quindi queste osservazioni sul nuoto sostenuto intorno a minerali specifici corrispondeva con genotipi specifici delle diverse specie.
Durante molti MFC (Kotloski e Gralnick, 2013) e metallo riducendo esperimenti di cultura batch, extracellulare trasferimento di elettroni-mediata energia taxi, o capacità di congregazione, non è stato misurato (Kotloski e Gralnick, 2013). Nei saggi di riduzione dell’ossido di metallo la distribuzione 3D delle cellule e la motilità cellulare potrebbe influenzare notevolmente la riduzione del metallo a causa della velocità di agitazione dell’incubatore, dimensioni del pallone di coltura, o la miscelazione. Il comportamento di congregazione influenza direttamente l’attaccamento delle cellule alle AIE. La relazione tra congregazione e formazione di appendici simili a nanofili è ancora sconosciuta (Pirbadian et al., 2015), anche se i parametri di motilità e congregazione sono raramente monitorati in questi studi (Gorby et al., 2005; Reguera et al., 2005). Trasformare questi geni di congregazione di base (cymA, mtrB, mtrA, omcA, mcp_pas, e mcp_cache) in altre specie di batteri, con singolo flagello polare, potrebbe un giorno migliorare le capacità di biorimedio, essendo in grado di indurre l’attaccamento batterico e la colonizzazione di superfici che altrimenti sarebbe difficile o impossibile.
Materiali e metodi
Coltivazione e ceppi
MR-1 e diversi mutanti di delezione originati da MR-1 sono stati esaminati in questo studio (Tabella 2) (Beliaev e Saffarini, 1998; Myers e Myers, 2002). I ceppi sono stati inoculati da stock di glicerolo conservati a -80°C su piastre Luria-Bertani (LB) e coltivati per una notte a 30°C. Le singole colonie sono state selezionate e inoculate in 5 mL di terreno minimo definito (M1) (Bretschger et al., 2007) integrato con 18 mM di lattato come fonte di energia (Bretschger et al., 2007) in tubi da 15 mL (VWR International LLC, Randor, Pennsylvania, USA) e incubate orizzontalmente in un agitatore (180 rpm) per 48 ore a 30 °C. La densità ottica è stata misurata con uno spettrofotometro (Unico 1100RS spectrophotometer, Dayton, New Jersey, USA). Le cellule sono state campionate a una OD600 di 0,5 ± 0,2 (dopo ~ 48 h). Negli esperimenti di nuoto, le colture da cinque millilitri sono state campionate quando le cellule hanno raggiunto una OD di 0,4, mescolate con ossidi di manganese o di ferro, e introdotte in un capillare di vetro (0,02 × 0,20 mm) (Vitrocom, Mountain Lakes, New Jersey, USA) che è stato poi sigillato con grasso sotto vuoto come descritto in precedenza (Harris et al, 2010).
Sintesi minerale
La soluzione stock di Fe(OH)3 è stata preparata secondo il protocollo di Cornell e Schwertmann e poi verificata mediante defrazione a raggi X (Schwertmann e Cornell, 2008). Questa preparazione di MnO2 colloidale iniziato con 8 g KMnO4 sciolto in 200 mL, mentre utilizzando tutte le precauzioni di sicurezza possibili. La soluzione è stata continuamente mescolata con una barra di agitazione magnetica ad alta e riscaldata al di sotto della temperatura di ebollizione. Poi, 5 mL di idrossido di sodio 10 M sono stati aggiunti per neutralizzare l’acido prodotto dalla reazione. In un pallone separato, 15 g di cloruro di manganese sono stati sciolti in 75 mL di acqua distillata. Infine, la soluzione è stata mescolata lentamente con la soluzione di permanganato (in una cappa chimica) per 75 minuti. Dopo il raffreddamento, la soluzione è stata lavata per centrifugazione e risciacquata con acqua deionizzata (DI) (18 Meg-Ohm cm) per cinque volte. Il precipitato finale è stato lasciato asciugare da un filtro a vuoto in un banco pulito ed essiccato per 36 ore. I minerali risultanti sono stati analizzati tramite diffrazione a raggi X per confermare la produzione di Fe(OH)3 e MnO2 (Bretschger et al., 2007; Salas et al., 2010).
Le particelle minerali sospese sono state mescolate con la cultura ad una concentrazione finale di 300 mg/mL di MnO2 o Fe(OH)3. Le cellule sono state poi immerse per capillarità in tubi capillari rettangolari (0,02 × 0,20 mm) (Vitrocom, Mountain Lakes, New Jersey, USA). I tubi sono stati sigillati con grasso Silicon vacuum (Dow Corning, Midland, Milwaukie, USA) e osservati con microscopia a luce, microscopia a fluorescenza e microscopia confocale.
Esperimenti di accumulo di cellule dopo photo-bleaching (CAAP) time-lapse
Tutti i ceppi con etichetta fluorescente (GFP) sono stati trasformati come precedentemente descritto (McLean et al, 2008) e poi coltivati aerobicamente su un terreno minimo definito con 25 μg/ml di kanamicina e 18 mM di lattato per 48 ore a 30°C. Cinque millilitri di colture sono stati campionati quando le cellule hanno raggiunto una OD di 0,4, mescolato con manganese o ossidi di ferro, e introdotto in un capillare di vetro (0,02 × 0,20 mm) (Vitrocom, Mountain Lakes, New Jersey, USA) che è stato poi sigillato con grasso vuoto come descritto in precedenza (Harris et al., 2010). GFP etichettato WT MR-1, ΔcymA, Δmcp_cache, e ΔmtrBC / omcA cellule sono state sbiancate utilizzando le impostazioni massima intensità della luce con lenti 60X, di un microscopio confocale invertito Leica TCS SPE (Wetzlar, Germania) per 15 min. Per garantire che lo sbiancamento si è verificato, time-lapse catturato una zona dello schermo (250 × 250 micron area selezionata) ogni minuto fino a quando le cellule originali è apparso scuro e le cellule circostanti è rimasto brillantemente fluorescente. Le immagini sono state poi catturate utilizzando 588 nm di eccitazione e 530 nm di emissione. Un video time-lapse dell’intera sezione del tubo è stato catturato utilizzando il software Leica Imaging e la funzione “auto focus” per le prossime 3 ore. Le cellule sono state osservate anche in modalità luce trasmessa per verificare che le cellule sbiancate erano mobili e intatte. Un controllo negativo separato, con GFP etichettato Δmcp_cache, è stato catturato per 3 h. Nessuna cella è stata vista accumularsi nella zona scura in questo controllo negativo, né le cellule sbiancate recuperare la fluorescenza GFP. La risposta di tutto il capillare (altezza di 30 micron) è stato catturato utilizzando la fotografia time-lapse e la somma delle cellule in tutte le 20 pile asse z è stato determinato (utilizzando il metodo di analisi del computer di seguito) per ogni punto di tempo.
Microscopia cattura dei movimenti delle cellule
I metodi per il monitoraggio batterico e l’analisi erano identici a studi precedenti utilizzati per la Figura 3 e registrato nella tabella 3 (Harris et al., 2012). Sia il computer e manuale tracce di nuoto batterica sono stati standardizzati utilizzando un righello scala (100 um). Da ogni esperimento, l’attività complessiva di nuoto all’interno del telaio video-equivalente ad un 107 × 193 μm campo di vista-è stato registrato e il video è stato tempo-normalizzato per dare velocità di nuoto in μm / s. Diversi parametri sono stati misurati per ogni traccia di nuoto batterico come la distanza totale spostata, il tempo di traccia da quando i batteri prima appaiono e scompaiono, il numero di inversioni, la distanza tra ogni inversione e l’ossido di metallo, e la distanza tra l’ossido di metallo e l’inizio della traccia batteri.
Analisi del nuoto
Le cellule sono state tracciate a mano da dati video (30 frame/s), frame per frame, e misurato da ImageJ software di analisi delle immagini. Gli input di dati includono la velocità di nuoto, la posizione iniziale dei batteri rispetto alla superficie IEA più vicina e la posizione di ogni evento di inversione batterica è stato identificato e registrato rispetto alla distanza dalla superficie IEA più vicina (Figura 3 e Tabella 3). Per determinare l’attività di nuoto dopo il contatto con IEA, le cellule di nuoto sono state divise in due gruppi per l’analisi: le cellule che hanno nuotato entro 2 μm di una particella sono state considerate “in contatto” e quelle che non hanno nuotato entro 2 μm dalla superficie della particella sono state considerate “senza contatto”. Oltre ai metodi di tracciamento della mano descritti sopra, i dati sperimentali sono stati poi ordinati al computer e analizzati da un algoritmo precedentemente descritto per produrre i dati di nuoto calcolati (Crocker e Grier, 1996; Harris et al., 2012; Harris, 2013). Per produrre le figure 3, 4, tutti i dati sperimentali da quattro distinti replicati biologici sono stati combinati, raggruppati e mediati in bins secondo la distanza dalla particella IEA. Perché questi dati sono stati raggruppati in distanze, barre di errore sono sovrapposti; nessun confronto della frequenza di inversione, ad una data distanza può essere fatto tra i ceppi, come questo metodo di visualizzazione preclude identificatori esperimento.
Contributi Autore
HH: progettato ed eseguito gli esperimenti; HH e IS-A: scritto e rivisto carta; ES, ME-N, e JM: ha contribuito a progettare esperimenti; WT: aiutato a eseguire l’analisi dei dati; JM e KN: rivisto il manoscritto.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Un ringraziamento speciale a Mandy J. Ward e Gijs Kuenen per i consigli sulla ricerca e la progettazione degli esperimenti. Ringraziamo Meaghan Sullivan per le sue analisi manuali di tracciamento. Ringraziamo Cecile Jourlin-Castelli, Samantha Reed, Jun Li, e David Culley per la fornitura del Δmcp_cache, ΔmtrBC/omcA, e ΔcymA mutanti. Il finanziamento di questo lavoro è stato fornito da un premio dell’Air Force Office of Scientific Research. La ricerca IS-A è stata supportata dalla NASA Planetary Biology Internship fellowship.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fmicb.2017.02568/full#supplementary-material
Alexandre, G., Greer-Phillips, S., and Zhulin, I. B. (2004). Ruolo ecologico dei taxi energetici nei microrganismi. FEMS Microbiol. Rev. 28, 113-126. doi: 10.1016/j.femsre.2003.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Baraquet, C., Théraulaz, L., Iobbi-Nivol, C., Méjean, V., e Jourlin-Castelli, C. (2009). Chemorecettori inaspettati mediano energia taxi verso accettori di elettroni in Shewanella oneidensis. Mol. Microbiol. 73, 278-290. doi: 10.1111/j.1365-2958.2009.06770.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Beliaev, A. S., e Saffarini, D. A. (1998). Shewanella putrefaciens mtrB codifica una proteina di membrana esterna necessaria per Fe (III) e Mn (IV) riduzione. J. Bacteriol. 180, 6292-6297.
PubMed Abstract | Google Scholar
Bencharit, S., e Ward, M. J. (2005). Risposte chemiotattica ai metalli e accettori di elettroni anaerobici in Shewanella oneidensis MR-1. J. Bacteriol. 187, 5049-5053. doi: 10.1128/JB.187.14.5049-5053.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Bond, D. R., and Lovley, D. R. (2003). Produzione di energia elettrica da Geobacter sulfurreducens attaccato agli elettrodi. Appl. Environ. Microbiol. 69, 1548-1555. doi: 10.1128/AEM.69.3.1548-1555.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bowman, J. P., McCammon, S. A., Nichols, D. S., Skerratt, J. H., Rea, S. M., Nichols, P. D., et al. Shewanella gelidimarina sp. nov. e Shewanella frigidimarina sp. nov., nuove specie antartiche con la capacità di produrre acido eicosapentaenoico (20:5ω3) e crescere anaerobicamente mediante riduzione dissimilatoria del Fe(III). Int. J. Syst. Bacteriol. 47, 1040-1047. doi: 10.1099/00207713-47-4-1040
PubMed Abstract | CrossRef Full Text | Google Scholar
Bretschger, O. (2008). Capacità di trasferimento di elettroni e processi metabolici del genere Shewanella con applicazioni all’ottimizzazione delle celle a combustibile microbiche. University of Southern California, ProQuest Dissertations Publishing, 3325185.
Google Scholar
Bretschger, O., Obraztsova, A., Sturm, C. A., Chang, I. S., Gorby, Y. A., Reed, S. B., et al. (2007). Produzione di corrente e riduzione di ossido di metallo da Shewanella oneidensis MR-1 wild type e mutanti. Appl. Environ. Microbiol. 73:7003. doi: 10.1128/AEM.01087-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Brettar, I., Christen, R., e Höfle, M. G. (2002). Shewanella denitrificans sp nov., un batterio vigorosamente denitrificante isolato dall’interfaccia oxic-anoxic del Gotland Deep nel Mar Baltico centrale. Int. J. Syst. Evol. Microbiol. 52, 2211-2217. doi: 10.1099/00207713-52-6-2211
PubMed Abstract | CrossRef Full Text | Google Scholar
Burdige, D. J. (1993). La biogeochimica della riduzione del manganese e del ferro nei sedimenti marini. Earth Sci. Rev. 35, 249-284. doi: 10.1016/0012-8252(93)90040-E
CrossRef Full Text | Google Scholar
Champine, J. E., Underhill, B., Johnston, J. M., Lilly, W. W., and Goodwin, S. (2000). Trasferimento di elettroni nel batterio dissimilatore ferro-riduttore Geobacter metallireducens. Anaerobe 6, 187-196. doi: 10.1006/anae.2000.0333
CrossRef Full Text | Google Scholar
Childers, S. E., Ciufo, S., and Lovley, D. R. (2002). Geobacter metallireducens accede insolubile Fe (III) ossido da chemiotassi. Natura 416, 767-769. doi: 10.1038/416767a
PubMed Abstract | CrossRef Full Text | Google Scholar
Coursolle, D., e Gralnick, J. A. (2010). Modularità del percorso respiratorio Mtr di Shewanella oneidensis ceppo MR-1. Mol. Microbiol. 77, 995-1008. doi: 10.1111/j.1365-2958.2010.07266.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Crocker, J. C., e Grier, D. G. (1996). Metodi di video microscopia digitale per studi colloidali. J. Colloid Interface Sci. 179, 298-310. doi: 10.1006/jcis.1996.0217
CrossRef Full Text | Google Scholar
El-Naggar, M. Y., Wanger, G., Leung, K. M., Yuzvinsky, T. D., Southam, G., Yang, J., et al. (2010). Trasporto elettrico lungo nanofili batterici da Shewanella oneidensis MR-1. Proc. Natl Acad. Sci. U.S.A. 107, 18127-18131. doi: 10.1073/pnas.1004880107
PubMed Abstract | CrossRef Full Text | Google Scholar
Fredrickson, J. K., Romine, M. F., Beliaev, A. S., Auchtung, J. M., Driscoll, M. E., Gardner, T. S., et al. (2008). Verso la biologia dei sistemi ambientali di Shewanella. Nat. Rev. Microbiol. 6, 592-603. doi: 10.1038/nrmicro1947
PubMed Abstract | CrossRef Full Text | Google Scholar
Fredrickson, J. K., Zachara, J. M., Kennedy, D. W., Dong, H., Onstott, T. C., Hinman, N. W., et al. Mineralizzazione biogenica del ferro che accompagna la riduzione dissimilatoria dell’ossido ferrico idrico da parte di un batterio delle acque sotterranee. Geochim. Cosmochim. Acta 62, 3239-3257. doi: 10.1016/S0016-7037(98)00243-9
CrossRef Full Text | Google Scholar
Gao, H., Obraztova, A., Stewart, N., Popa, R., Fredrickson, J. K., Tiedje, J. M., et al. (2006). Shewanella loihica sp. nov., isolata da tappeti microbici ricchi di ferro nell’Oceano Pacifico. Int. J. Syst. Evol. Microbiol. 56, 1911-1916. doi: 10.1099/ijs.0.64354-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Gorby, Y. A., Beveridge, T. J., and Wiley, W. R. (2005). “Composizione, reattività e regolazione delle strutture extracellulari di riduzione dei metalli (nanofili) prodotte da batteri dissimilatori di riduzione dei metalli”, in Annual NABIR PI Meeting (Warrenton, VA).
Google Scholar
Gorby, Y. A., Yanina, S., McLean, J. S., Rosso, K. M., Moyles, D., Dohnalkova, A., et al. (2006). Elettricamente conduttivi nanofili batterici prodotti da Shewanella oneidensis ceppo MR-1 e altri microrganismi. Proc. Natl. Acad. Sci. U.S.A. 103, 11358-11363. doi: 10.1073/pnas.0604517103
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, B. J., e El-Naggar, M. Y. (2015). Una piattaforma combinata elettrochimica e ottico trapping per misurare i tassi di respirazione singola cella alle interfacce degli elettrodi. Rev. Sci. Instrum. 86:064301. doi: 10.1063/1.4922853
PubMed Abstract | CrossRef Full Text | Google Scholar
Harris, H. W. (2013). Identificazione di un nuovo meccanismo di rilevamento batterico: Caratterizzazione di batteri Insolubili Electron Acceptor Sensing. University of Southern California.
Google Scholar
Harris, H. W., El-Naggar, M. Y., Bretschger, O., Ward, M. J., Romine, M. F., Obraztsova, A. Y., et al. (2010). Elettrocinesi è un comportamento microbico che richiede il trasporto extracellulare di elettroni. Proc. Natl. Acad. Sci. U.S.A. 107, 326-331. doi: 10.1073/pnas.0907468107
PubMed Abstract | CrossRef Full Text | Google Scholar
Harris, H. W., Naggar, M. Y., e Nealson, K. H. (2012). Shewanella oneidensis MR-1 proteine chemiotassi e componenti della catena di trasporto di elettroni essenziali per la congregazione vicino accettatori di elettroni insolubili. Biochem. Soc. Trans. 40, 1167-1177. doi: 10.1042/BST20120232
PubMed Abstract | CrossRef Full Text | Google Scholar
Hau, H. H., e Gralnick, J. A. (2007). Ecologia e biotecnologia del genere Shewanella. Annu. Rev. Microbiol. 61, 237-258. doi: 10.1146/annurev.micro.61.080706.093257
PubMed Abstract | CrossRef Full Text | Google Scholar
Hsu, L., Masuda, S. A., Nealson, K. H., e Pirbazari, M. (2012). Valutazione della cella a combustibile microbica Shewanella biocathodes per il trattamento della contaminazione da cromato. R. Soc. Chem. Adv. 2, 5844-5855. doi: 10.1039/c2ra20478a
CrossRef Full Text | Google Scholar
Kan, J., Hsu, L., Cheung, A. C. M., Pirbazari, M., e Nealson, K. H. (2011). Produzione di corrente da parte di comunità batteriche in celle a combustibile microbiche arricchite da fanghi di acque reflue con diversi donatori di elettroni. Environ. Sci. Technol. 45, 1139-1146. doi: 10.1021/es102645v
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, S., Nakamura, R., Kai, F., Watanabe, K., e Hashimoto, K. (2010). Interazioni respiratorie dei batteri del suolo con minerali di ossido di ferro (semi)conduttivi. Environ. Microbiol. 12, 3114-3123. doi: 10.1111/j.1462-2920.2010.02284.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotloski, N. J., e Gralnick, J. A. (2013). Navette elettrone Flavina dominare il trasferimento di elettroni extracellulare da Shewanella oneidensis. MBio 4:e00553. doi: 10.1128/mBio.00553-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Kracke, F., Vassilev, I., e Krömer, J. O. (2015). Trasporto microbico di elettroni e conservazione dell’energia – la base per l’ottimizzazione dei sistemi bioelettrochimici. Front. Microbiol. 6:575. doi: 10.3389/fmicb.2015.00575
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Go, A. C., Ward, M. J., e Ottemann, K. M. (2010). La chimica-in-plug test chemiotassi batterica è incline a false risposte positive. BMC Res. Notes 3:77. doi: 10.1186/1756-0500-3-77
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Romine, M. F., e Ward, M. J. (2007). Identificazione e analisi di un cluster di geni per la chemiotassi altamente conservati nelle specie Shewanella. FEMS Microbiol. Lett. 273, 180-186. doi: 10.1111/j.1574-6968.2007.00810.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, R., Tiedje, J. M., Chiu, C., e Worden, R. M. (2012). Navette di elettroni solubili possono mediare taxi di energia verso accettori di elettroni insolubili. Environ. Sci. Technol. 46, 2813-2820. doi: 10.1021/es204302w
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovley, D. R., Coates, J. D., Blunt-Harris, E. L., Phillips, E. J. P., e Woodward, J. C. (1996). Sostanze umiche come accettori di elettroni per la respirazione microbica. Nature 382, 445-448. doi: 10.1038/382445a0
CrossRef Full Text | Google Scholar
Lovley, D. R., Giovannoni, S. J., White, D. C., Champine, J. E., Phillips, E. J., Gorby, Y. A., et al. (1993). Geobacter metallireducens gen. nov. sp. nov., un microrganismo capace di accoppiare la completa ossidazione dei composti organici alla riduzione del ferro e di altri metalli. Arch. Microbiol. 159, 336-344. doi: 10.1007/BF00290916
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovley, D. R., Holmes, D. E., e Nevin, K. P. (2004). Dissimilatoria Fe (III) e Mn (IV) riduzione. Adv. Microb. Physiol. 49, 219-286. doi: 10.1111/j.1462-2920.2004.00593.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Marsili, E., Baron, D. B., Shikhare, I. D., Coursolle, D., Gralnick, J. A., Bond, D. R., et al. Shewanella secerne flavine che mediano il trasferimento di elettroni extracellulare. Proc. Natl. Acad. Sci. U.S.A. 105, 3968-3973. doi: 10.1073/pnas.0710525105
PubMed Abstract | CrossRef Full Text | Google Scholar
McLean, J. S., Majors, P. D., Reardon, C. L., Bilskis, C. L., Reed, S. B., Romine, M. F., et al. Indagini di struttura e metabolismo all’interno Shewanella oneidensis MR-1 biofilm. J. Microbiol. Methods 74, 47-56. doi: 10.1016/j.mimet.2008.02.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Meyer, T. E., Tsapin, A. I., Vandenberghe, I., de Smet, L., Frishman, D., Nealson, K. H., et al. (2004). Identificazione di 42 possibili geni del citocromo C nel genoma di Shewanella oneidensis e caratterizzazione di sei citocromi solubili. Omics 8, 57-77. doi: 10.1089/153623104773547499
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitchell, A. C., Peterson, L., Reardon, C. L., Reed, S. B., Culley, D. E., Romine, M. R., et al. Ruolo dei citocromi di tipo c della membrana esterna MtrC e OmcA nella produzione di cellule Shewanella oneidensis MR-1, accumulo e distacco durante la respirazione su ematite. Geobiologia 10, 355-370. doi: 10.1111/j.1472-4669.2012.00321.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Murray, A. E., Lies, D., Li, G., Nealson, K., Zhou, J., e Tiedje, J. M. (2001). DNA / DNA ibridazione a microarray rivela gene-specifiche differenze tra strettamente correlati genomi microbici. Proc. Natl. Acad. Sci. U.S.A. 98, 9853-9858. doi: 10.1073/pnas.171178898
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Myers, J. M. (1997). Clonazione e sequenza di cymA, un gene che codifica un tetracromo c richiesto per la riduzione del ferro (III), fumarato e nitrato da Shewanella putrefaciens MR-1. J. Bacteriol. 179, 1143-1152. doi: 10.1128/jb.179.4.1143-1152.1997
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Myers, J. M. (2002). MtrB è richiesto per la corretta incorporazione dei citocromi OmcA e OmcB nella membrana esterna di Shewanella putrefaciens MR-1. Appl. Environ. Microbiol. 68, 5585-5594. doi: 10.1128/AEM.68.11.5585-5594.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Nealson, K. H. (1988a). Riduzione batterica del manganese e crescita con l’ossido di manganese come unico accettore di elettroni. Scienza 240, 1319-1321. doi: 10.1126/science.240.4857.1319
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., e Nealson, K. H. (1988b). Riduzione microbica degli ossidi di manganese: Interazioni con ferro e zolfo. Geochim. Cosmochim. Acta 52, 2727-2732. doi: 10.1016/0016-7037(88)90041-5
CrossRef Full Text | Google Scholar
Myers, J. M., e Myers, C. R. (2001). Ruolo dei citocromi di membrana esterna OmcA e OmcB di Shewanella putrefaciens MR-1 nella riduzione del biossido di manganese. Appl. Environ. Microbiol. 67, 260-269. doi: 10.1128/AEM.67.1.260-269.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Nealson, K. H., Moser, D. P., and Saffarini, D. A. (1995). Chemiotassi anaerobica dell’accettore di elettroni in Shewanella putrefaciens. Appl. Environ. Microbiol. 61, 1551-1554.
PubMed Abstract | Google Scholar
Okamoto, A., Kalathil, S., Deng, X., Hashimoto, K., Nakamura, R., e Nealson, K. H. (2014). Cell-secreted flavine legati a citocromi di membrana dettare reazioni di trasferimento di elettroni a superfici con carica diversa e pH. Sci. Rep. 4:5628. doi: 10.1038/srep05628
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirbadian, S., Barchinger, S. E., Leung, K. M., Byun, H. S., Jangir, Y., Bouhenni, R. A., et al. (2015). Nanofili batterici di Shewanella oneidensis MR-1 sono estensioni di membrana esterna e periplasmatica dei componenti extracellulari di trasporto di elettroni. Biophys. J. 108:368a. doi: 10.1016/j.bpj.2014.11.2016
CrossRef Full Text | Google Scholar
Reguera, G., McCarthy, K. D., Mehta, T., Nicoll, J. S., Tuominen, M. T., Lovely, D. R., et al. (2005). Trasferimento extracellulare di elettroni tramite nanofili microbici. Natura 435, 1098-1101. doi: 10.1038/nature03661
PubMed Abstract | CrossRef Full Text | Google Scholar
Salas, E. C., Berelson, W. M., Hammond, D. E., Kampf, A. R., e Nealson, K. H. (2010). L’impatto del ceppo batterico sui prodotti di riduzione dissimilatoria del ferro. Geochim. Cosmochim. Acta 74, 574-583. doi: 10.1016/j.gca.2009.10.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Saltikov, C. W., Cifuentes, A., Venkateswaran, K., e Newman, D. K. (2003). Il sistema di disintossicazione ars è vantaggioso ma non richiesto per As (V) respirazione dal ceppo di specie Shewanella geneticamente trattabile ANA-3. Appl. Environ. Microbiol. 69, 2800-2809. doi: 10.1128/AEM.69.5.2800-2809.2003
CrossRef Full Text | Google Scholar
Schwalb, C., Chapman, S. K., e Reid, G. A. (2003). Il citocromo tetraedrico CymA è richiesto per la respirazione anaerobica con dimetilsolfossido e nitrito in Shewanella oneidensis. Biochimica 42, 9491-9497. doi: 10.1021/bi034456f
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwertmann, U., e Cornell, R. M. (2008). Ossidi di ferro in laboratorio. Weinheim: John Wiley & Sons.
Google Scholar
Shi, L., Richardson, D. J., Wang, Z., Kerisit, S. N., Rosso, K. M., Zachara, J. M., et al. (2009). I ruoli dei citocromi di membrana esterna di Shewanella e Geobacter nel trasferimento extracellulare di elettroni. Environ. Microbiol. Rep. 1, 220-227. doi: 10.1111/j.1758-2229.2009.00035.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Venkateswaran, K., Dollhopf, M. E., Aller, R., Stackebrandt, E., e Nealson, K. H. (1998). Shewanella amazonensis sp. nov., un nuovo anaerobo facoltativo metallo-riduttore dai fanghi della piattaforma amazzonica. Int. J. Syst. Bacteriol. 48, 965-972.
PubMed Abstract | Google Scholar
Venkateswaran, K., Moser, D. P., Dollhopf, M. E., Lies, D. P., Saffarini, D. A., MacGregor, B. J., et al. (1999). Tassonomia polifasica del genere Shewanella e descrizione di Shewanella oneidensis sp. nov. Int. J. Syst. Bacteriol. 49, 705-724. doi: 10.1099/00207713-49-2-705
PubMed Abstract | CrossRef Full Text | Google Scholar
Ziemke, F., Höfle, M. G., Lalucat, J., and Rossellö-Mora, R. (1998). Riclassificazione del gruppo genomico II di Shewanella putrefaciens Owen come Shewanella baltica sp. nov. Int. J. Syst. Bacteriol. 48, 179-186. doi: 10.1099/00207713-48-1-179
PubMed Abstract | CrossRef Full Text | Google Scholar