- Introduzione
- Materiali e metodi
- Materiali e prodotti chimici
- Preparazione della linea cellulare
- Preparazione di zebrafish
- Saggio di vitalità cellulare e osservazione morfologica
- Analisi dell’apoptosi tramite colorazione DAPI e citometria a flusso
- Saggio su animali xenotrapiantati
- Analisi della PCR in tempo reale (qPCR)
- Analisi Western Blot (WB)
- Analisi statistica
- Risultati
- Effetto antiproliferativo di TF
- effetto pro-apoptotico di TF
- In Vivo Effetto di TF su Xenograft Zebrafishes
- Azione molecolare di TF su espressioni mRNA in cellule A375
- Azione molecolare di TB sulle espressioni delle proteine nelle cellule A375
- Discussione
- Conclusione
- Data Availability Statement
- Dichiarazione etica
- Contributi degli autori
- Finanziamento
- Conflitto di interessi
- Abbreviazioni
Introduzione
Il melanoma è un tipo fatale di cancro della pelle, con alto potenziale metastatico e intrattabilità (Yang et al., 2018). I pazienti con melanoma a stadi avanzati sono sempre non resecabili e hanno una prognosi peggiore (Leonardi et al., 2018). La chemioterapia è un pilastro del trattamento clinico del melanoma, ma l’efficacia dei chemioterapici è limitata a causa dei loro effetti collaterali sui tessuti sani (Oliveira Pinho et al., 2019). Recentemente, diverse immunoterapie, tra cui gli inibitori del recettore CTLA-4 o PD-1, sono state sviluppate come nuove opzioni per il trattamento del melanoma, ma la loro efficacia non è affidabile e i loro effetti collaterali sono ancora non trascurabili (Rodríguez-Cerdeira et al., 2017). Pertanto, nuove strategie con efficacia e sicurezza soddisfacenti sono urgentemente necessarie. La medicina tradizionale cinese (MTC) è un approccio complementare ed è stata applicata clinicamente per migliaia di anni, possedendo una certa efficacia e meno effetti collaterali. Secondo la teoria della MTC, il cancro è associato all’accumulo nel corpo di flemma, tossine o infiammazione, e le erbe anti-flegma, anti-tossiche o anti-infiammatorie possono possedere effetti anti-cancro (Wang e Cheng, 2019). La teoria è stata supportata da molti casi. Ad esempio, la curcumina nel Rhizoma Curcumae longae ha esercitato effetti citotossici inducendo l’apoptosi e inibendo l’angiogenesi delle cellule di melanoma (Mirzaei et al., 2016), e la vitexina nel Vitex negundo ha soppresso la crescita delle cellule di melanoma inducendo danni al DNA e aumentando i livelli di ROS (Liu et al., 2018). Pertanto, i componenti di erbe della MTC hanno un grande potenziale per il trattamento dei tumori, come il melanoma.
Il tè è una delle bevande più diffuse nel mondo. È ben noto non solo per il sapore peculiare, ma anche per i benefici per la salute. A causa della differenza di processo, il tè ha tre tipi principali, tra cui il tè verde non fermentato, il tè oolong parzialmente fermentato e il tè nero completamente fermentato o tè pu-erh (Kuo et al., 2005). Le foglie di tè sono state caratterizzate come un’erba della MTC con proprietà anti-flegma e anti-tossiche, indicando il suo potenziale anti-cancro. Studi moderni hanno riportato che la bevanda del tè è efficace nella prevenzione e nel trattamento dei tumori (Jin et al., 2018). Recentemente, i polifenoli del tè sono stati trovati in possesso di attività anticancro, che hanno un effetto superiore alla bevanda del tè (Mao et al., 2019). La teaflavina (TF) è un tale componente polifenolico prodotto dall’ossidazione delle catechine delle foglie di tè durante la fermentazione, agendo come pigmento principale per il colore, il sapore e la bioattività del tè (Roberts et al., 1957). È in grado di indurre l’apoptosi in una varietà di linee cellulari di cancro, come le linee cellulari di carcinoma mammario umano (MCF-7, MDA-MB-231, T47D, e ZR-75-1), le linee cellulari di carcinoma del colon (HCT-15 e HT-29), e le linee cellulari di carcinoma epatico (HCCLM3 e Huh-7), indicando un potenziale anticancro (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Tuttavia, poca attenzione è stata data al suo effetto verso il melanoma ancora.
In considerazione degli effetti pro-apoptotici segnalati di TF su molte linee cellulari di cancro (Lahiry et al., 2008), abbiamo avanzato un’ipotesi che TF esercita effetti pro-apoptotici sulle cellule di melanoma. Per verificare questo, il presente ha eseguito esperimenti in vitro per valutare l’effetto citotossico pro-apoptotico di TF sulle cellule di melanoma umano e ha condotto un esperimento in vivo utilizzando un modello di xenotrapianto in pesci zebra larvali per determinare il suo effetto tumorale inibitorio. Inoltre, il meccanismo di TF è stato anche esplorato.
Materiali e metodi
Materiali e prodotti chimici
La taflavina (TF, >95% di purezza) è stata fornita da Theabio Co., Ltd (Hangzhou, Cina) (numero di lotto: 20181211061). Il mezzo Dulbecco modificato di Eagle (DMEM) contenente glucosio alto (4,5 g/l) è stato ottenuto da HyClone Laboratories (UT, USA). Il siero fetale bovino (FBS) è stato ottenuto da Cell Max (Pechino, Cina). La tripsina (0,25%) è stata ottenuta da Gibco (NY, USA). Il bromuro di 3-(4,5-dimetiltiazolo-2-ile)-2,5-difeniltetrazolio (MTT) e il dimetilsolfossido (DMSO) sono stati ottenuti da Sigma (St. Louis, MO, USA). Annexin-V: FITC kit di rilevamento dell’apoptosi è stato ottenuto da BD Biosciences (CA, USA). La soluzione di colorazione 4′-6-diamidino-2-fenilindolo (DAPI) è stata ottenuta dalla Thermo Fisher Scientific (MA, USA). Gli anticorpi primari sono stati ottenuti da Cell Signaling Technology (MA, USA). Il reagente Trizol e il kit per la reazione a catena della polimerasi in tempo reale (PCR in tempo reale) sono stati ottenuti da TaKaRa (Dalian, Cina).
Preparazione della linea cellulare
I fibroblasti della pelle umana HFF-1 e la linea cellulare di melanoma A375 sono stati ottenuti dalla Shanghai Cell Bank of Chinese Academy of Sciences (Shanghai, Cina), e la linea cellulare di melanoma umano A875 è stata ottenuta dalla Kunming Cell Bank of Chinese Academy of Sciences (Kunming, Cina). Queste linee cellulari sono state coltivate in terreno DMEM contenente 10% FBS a 37°C in un incubatore umidificato al 5% di CO2. Il mezzo è stato cambiato ogni giorno, e le cellule sono state trattate con TF nella loro fase di crescita logaritmica.
Preparazione di zebrafish
Il ceppo AB di tipo Wild di pesci zebra è stato ottenuto dalla Cina Zebrafish Resource Center, Istituto di Idrobiologia, China Academy of Science (Wuhan, Cina) e accreditato dalla Associazione per la valutazione e l’accreditamento della cura degli animali da laboratorio internazionale (SYXK 2012-0171). Le larve di pesce zebra a 2 dpf (giorni dopo la fecondazione) sono state prodotte tramite accoppiamento naturale e alloggiate in un impianto di acquacoltura a luce controllata con un fotoperiodo standard di 14:10 ore giorno/notte e alimentate con gamberetti vivi due volte al giorno e fiocchi di avannotti una volta al giorno.
Saggio di vitalità cellulare e osservazione morfologica
Saggi MTT sono stati condotti per determinare gli effetti inibitori di TF su linee cellulari di melanoma, come precedentemente descritto (Zhou et al, 2017). Le cellule sono state seminate in piastre da 96 pozzetti a 6×103 cellule/pozzetto in 200 μl di terreno per 24 ore di aderenza, seguite dal trattamento con TF a concentrazioni di 0, 50, 100, 150, 200, 250, 300 e 400 μg/ml per 24, 48 e 72 ore. Poi 20 μl di soluzione MTT (5,0 mg/ml) sono stati aggiunti a ciascun pozzetto e incubati a 37°C per 4 ore. DMSO (150 μl) è stato aggiunto in ogni pozzetto e il valore di densità ottica (valore OD) è stato misurato a 490 nm con il lettore di micropiastre Biorad (CA, USA). Tasso inibitorio (%) = × 100%. Le concentrazioni inibitorie del 50% (IC50) per 24, 48 e 72 ore sono state calcolate mediante analisi di regressione. Di conseguenza, 120, 240, e 360 μg/ml (232.3, 464.7, e 697.0 μM) sono stati designati come basse, medie e alte dosi di TF. Poi, le linee cellulari HFF-1, A375 e A875 sono state seminate in piastre da 96 pozzetti come sopra, e trattate con la dose media di TF a 24 ore. La morfologia cellulare delle cellule A375 è stata osservata al microscopio a fluorescenza Carl Zeiss (Göttingen, Germania).
Analisi dell’apoptosi tramite colorazione DAPI e citometria a flusso
L’apoptosi delle cellule è stata determinata dalla colorazione DAPI e dalla colorazione annexin-V/PI basata sulla citometria a flusso. Per la colorazione DAPI, le cellule A375 sono state seminate in piastre da 96 pozzetti e trattate con TF a basse, medie e alte concentrazioni per 24 ore, seguite da fissazione con paraformaldeide al 4% in PBS per 30 minuti a temperatura ambiente e colorazione con DAPI per 10 minuti al buio. Dopo tre lavaggi, le cellule sono state osservate con cinque coprioggetti al microscopio a fluorescenza Carl Zeiss (Göttingen, Germania) e sono state contate le cellule apoptotiche. La citometria a flusso è stata condotta secondo le istruzioni del produttore. Brevemente, le cellule A375 sono state seminate in piastre da 6 pozzetti a 3×105 cellule/pozzetto per 24 ore e trattate con TF a basse, medie e alte concentrazioni per altre 48 ore. In seguito, le cellule sono state lavate due volte e marcate con soluzione di annexina V-fluoresceina isotiocianato e PI in tampone di legame. L’intensità della fluorescenza delle cellule è stata rilevata dalla citometria a flusso BD C6 (CA, USA). L’analisi è stata replicata e sono stati calcolati i tassi di cellule apoptotiche precoci e tardive (%).
Saggio su animali xenotrapiantati
Per determinare la gamma di dosi di TF, sono stati usati totalmente 300 pesci zebra larvali a 3 dpf e coltivati in modo casuale in piastre da 6 pozzetti con 30 pesci ciascuno. I TF sono stati sciolti in ogni pozzetto a 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1.000 e 2.000 μg/ml, rispettivamente, per 24 ore. Come descritto dal nostro studio precedente, nessun livello di effetto avverso osservato (NOAEL) di TF è stato stimato, e 1/9 NOAEL, 1/3 NOAEL e NOAEL sono stati applicati come le dosi basse, medie e alte per il seguente esperimento (Jin et al, 2018).
Per stabilire il modello di xenotrapianto, le cellule A375 sono state colorate con CM-Dil (fluorescenza rossa) ad una diluizione di 1:1.000 e microiniettate nel sacco vitellino di pesci zebra larvali (2 dpf) ad una dose di 200 cellule/pesce. Dopo la crescita del tumore per 24 ore, tutti i pesci sono stati osservati al microscopio a fluorescenza (AZ100, Nikon, Tokyo, Giappone) per la verifica del modello. I pesci portatori di A375 sono stati raggruppati in 5 gruppi (30 pesci ciascuno) e trattati con 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL, e NOAEL di TF, così come 15 μg/ml (50 μM) di cisplatino, rispettivamente, per 24 h. L’intensità di fluorescenza (FI) della massa cellulare A375 dei pesci zebra è stata rilevata e il tasso inibitorio è stato calcolato come: tasso inibitorio (%) = × 100%.
Analisi della PCR in tempo reale (qPCR)
Per rivelare le azioni molecolari della TF sulle cellule A375, la qPCR è stata impiegata su un sistema ABI QuantStudio™ 7 Flex Real-Time PCR (Applied Biosystems, CA, USA). L’RNA totale delle cellule A375 è stato estratto usando il reagente Trizol e sintetizzato in cDNA tramite trascrizione inversa. Il sistema di reazione qPCR aveva un volume di 20,0 μl: 10 μl SYBR® Premix Ex Taq II (Tli RnaseH Plus), 0,8 μl primer forward PCR, 0,8 μl primer reverse PCR, 2,0 μl template cDNA, 0,4 μl ROX colorante di riferimento, e 6,0 μl ddH2O. La condizione di reazione qPCR è stata impostata a 95°C per 30 s denaturazione iniziale, 40 cicli di 95°C per 5 s denaturazione, 60°C per 34 s ricottura, e 72°C per 40 s estensione. Alla fine di ogni reazione, è stata eseguita un’analisi della curva di fusione. La β-ACTIN è stata usata come gene di riferimento e il metodo 2-ΔΔCT è stato applicato per analizzare l’espressione relativa di ogni gene (Tabella 1).

Tabella 1 Sequenze di primer usati per l’analisi qPCR.
Analisi Western Blot (WB)
L’espressione proteica delle cellule A375 con trattamento TF a 0 μg/ml e 120 μg/ml (232,3 μM) è stata analizzata mediante analisi WB. Le proteine totali sono state estratte utilizzando un tampone di lisi (50 mM Tris-HCl pH 7.4, 150 mM NaCl, 1 mM EDTA, 1% Triton, 0,1% SDS, 5 μg/ml leupeptina, e 1 mM PMSF) per 30 min in ghiaccio con ripetuti congelamento e scongelamento. Proteine mirate sono stati separati utilizzando denaturante sodio dodecil solfato poliacrilammide gel elettroforesi (SDS-PAGE) (8 ~ 12%) e poi trasferito su una membrana di polivinilidene fluoruro (PVDF) (Millipore, MA, USA). La membrana è stata bloccata con latte scremato al 5% per 2 ore, seguita da un’incubazione notturna a 4°C con gli anticorpi contro: ACTIN, ASK1, ATM, ATM fosforilato (p-ATM), ATR, ATR fosforilato (p-ATR), caspasi scissa 3 (c-CASP3), caspasi scissa 8 (c-CASP8), CHK1, CHK2, CHK1 e CHK2 fosforilati (p-CHK1 e p-CHK2), JNK, JNK fosforilato (p-JNK), C-JUN, C-JUN fosforilato (p-C-JUN), PARP scisso (poli ADP-ribosio polimerasi), P53, e P53 fosforilato (p-P53). Dopo l’incubazione con l’anticorpo secondario, queste proteine sono state visualizzate con un kit di chemiluminescenza potenziata (Amersham Pharmacia Biotech, Little Chalfort, UK) e rilevate utilizzando un analizzatore di chemiluminescenza.
Analisi statistica
I dati sono stati espressi come valori medi ± SD e sottoposti a una via ANOVA, seguita dal confronto con la minima differenza significativa (LSD) di Fisher. Tutte le analisi sono state eseguite utilizzando una versione aggiornata del software DPS (Tang e Zhang, 2013).
Risultati
Effetto antiproliferativo di TF
Come mostrato nella Figura 1A, TF a 50 μg/ml (96.8 μM) ha inibito significativamente la vitalità delle cellule A375, e i tassi inibitori sono stati aumentati con l’aumento delle concentrazioni di TF da 50 a 400 μg/ml (96,8 a 744,4 μM) (ogni P < 0,01 vs. livello normale), indicando un modo concentrazione-dipendente. I tassi inibitori erano anche aumentati con il trattamento TF da 24 a 72 h, con IC50 di 218,9 a 84,9 μg/ml (423,8 a 164,4 μM), rispettivamente. Poi, abbiamo applicato 120, 240 e 360 μg/ml (232.3, 464.7 e 697.0 μM) come dosi di TF-L, TF-M e TF-H, rispettivamente. Come mostrato nella Figura 1B, TF-M ha ovviamente inibito la vitalità delle cellule A375 e A875 ma ha esercitato poco effetto sulle cellule HFF-1. Come mostrato nella Figura 1C, la morfologia delle cellule A375 era ovviamente alterata e il numero di cellule vive era diminuito con il trattamento TF a concentrazioni crescenti.

Figura 1 Vitalità delle cellule A375 con trattamento TF a 24, 48 e 72 ore (A), vitalità delle cellule HFF-1, A375 e A875 con trattamento TF a 24 ore (B) e morfologia delle cellule A375 con trattamento con teaflavina (TF) a 24 ore (C). I dati erano media ± SD (n = 5). Per mezzo di Fisher minima differenza significativa (LSD) confronti multipli, i dati (media ± SD) con la stessa lettera minuscola (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) indicano nessuna differenza significativa tra di loro, mentre i dati con lettere diverse (a vs. b vs. c vs. b vs. e vs. f vs. g) indicano differenza significativa tra di loro. Barra della scala = 200 μm.
effetto pro-apoptotico di TF
DAPI colorazione e citometria a flusso sono stati eseguiti per valutare l’effetto pro-apoptotico di TF su cellule A375. Il risultato della colorazione DAPI ha mostrato una morfologia apoptotica, compresa la forma rimpicciolita, la cariopecnosi e la frammentazione nucleare, nelle cellule A375 con trattamento TF da 120 a 360 μg/ml (232,3 a 697,0 μM) (Figura 2A). Il numero di cellule apoptotiche era significativamente aumentato con il trattamento TF a 240 e 360 μg/ml (464.7 e 697.0 μM) (ogni P < 0.01 vs. NC) (Figura 2C). Il risultato della citometria a flusso ha mostrato TB indotta apoptosi precoce e apoptosi tardiva delle cellule A375 (Figura 2B). Il numero di cellule apoptotiche precoci e tardive sono stati aumentati con il trattamento TF da 120 a 360 μg/ml (232,3 a 697,0 μM) (Figura 2B), e le loro proporzioni erano significativamente superiori con trattamento TF a 360 μg/ml (697,0 μM) (P < 0,01 e P < 0,05 vs livello normale) (Figure 2D, E). I risultati hanno indicato che TF ha indotto l’apoptosi delle cellule A375 in modo concentrazione-dipendente.
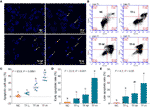
Figura 2 osservazione colorazione DAPI (A) e analisi citometria a flusso (B) su cellule A375 con trattamento teaflavina (TF). Analisi statistica del tasso di cellule apoptotiche (C), analisi statistica del tasso apoptotico precoce (D) e analisi statistica del tasso apoptotico tardivo (E). Per mezzo della differenza minima significativa di Fisher (LSD) confronti multipli, i dati (media ± SD) con la stessa lettera minuscola (a vs. ab; ab vs. b; b vs. b; c vs. c) indicano nessuna differenza significativa tra loro, mentre i dati con lettere diverse (a vs. b vs. c) indicano una differenza significativa tra loro. Barra della scala = 100 μm.
In Vivo Effetto di TF su Xenograft Zebrafishes
Le curve di mortalità e gli eventi avversi di pesci zebra con trattamento TF sono stati mostrati in Fig. 3A. La morte dei pesci è stata causata da TF a 31.25 μg/ml (60.5 μM), e nessun pesce è sopravvissuto con TF a 125 μg/ml (242.0 μM), indicando la massima dose non letale di TF inferiore a 31.25 μg/ml (60.5 μM). Gli eventi avversi, tra cui il rotolamento anomalo del corpo e l’edema, sono stati osservati con il trattamento TF da 3,47 μg/ml (6,7 μM) alle sue dosi più elevate, indicando il NOAEL di TF inferiore a 3,47 μg/ml (6,7 μM). Dopo test replicati, il NOAEL è stato infine stimato come 2,0 μg/ml (3,9 μM). Quindi, 0.22, 0.67, e 2.0 μg/ml (0.4, 1.3, e 3.9 μM) sono stati usati come le dosi basse, medie e alte di TF per l’esperimento successivo.
Come mostrato nella Figura 3B, un modello di xenotrapianto di cellule A375 è stato stabilito in pesci zebra larvali e le intensità fluorescenti della massa cellulare nei pesci sono stati testati. Dopo 24 ore di trattamento, TF da 0,22 a 2,0 μg/ml (0,4, 1,3, e 3,9 μM) ha ovviamente inibito la crescita del tumore A375, con tassi inibitori da 1,0 a 46,4%. Gli effetti inibitori di TF a 0,67 e 2,0 μg/ml (1,3 e 3,9 μM) erano significativi, se confrontati con il gruppo modello (P < 0,01), e l’effetto di TF a 2,0 μg/ml (3,9 μM) era addirittura superiore a quello del cisplatino al suo NOAEL (50 μM).
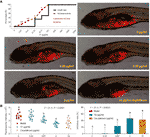
Figura 3 Mortalità ed eventi avversi di pesci zebra larvali indotti dalla teaflavina (TF) e osservazione di pesci zebra larvali xenotrapiantati con cellule A375 con trattamento di TF o cisplatino (A) così come l’intensità di fluorescenza e tassi inibitori di TF (B). L’area fluorescente in rosso rappresenta la massa delle cellule A375. Per mezzo di confronti multipli LSD, i dati (media ± SD) con la stessa lettera minuscola (a vs. a; c vs. c) indicano nessuna differenza significativa tra di loro, mentre i dati con lettere diverse (a vs. b vs. c) indicano una differenza significativa tra di loro.
Azione molecolare di TF su espressioni mRNA in cellule A375
Le espressioni relative mRNA di TF-geni bersaglio sono stati testati da test qPCR. Come mostrato in Fig. 4, le espressioni di BAX, BIM, C-MYC, P21, P53, e PUMA sono state significativamente up-regolate da TF (ogni P < 0.01 vs. livello NC), tranne quella di BAX con trattamento TF alla sua bassa concentrazione. Anche se l’espressione di BCL-2 è stata up-regolata da TF, i rapporti di BAX/BCL-2 erano significativamente più alti con il trattamento TF alle sue concentrazioni medio-alte rispetto a quello del livello NC (P < 0,01), indicando il ruolo principale di BAX nell’azione di TF.
Azione molecolare di TB sulle espressioni delle proteine nelle cellule A375
WB è stato applicato per determinare l’espressione e la fosforilazione delle proteine target di TF. Come mostrato nella Figura 5, le espressioni di ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8, e c-CASP3 sono state significativamente up-regolate da TF a 120 μg/ml (232.3 μM) (ogni P < 0.01 vs livello NC). Inoltre, le azioni di TF su ATR, p-ATR, CHK2, P53, C-JUN (43 kd), e p-C-JUN (Ser 73) erano insignificanti (ciascuna P > 0,05 vs. livello NC).
Discussione
Anche se le attività anticancro di TF è stata ben documentata (Sur e Panda, 2017; Takemoto e Takemoto, 2018; Sajadimajd et al, 2020), la conoscenza della sua efficacia sul melanoma è ancora poca. Per colmare questa lacuna, il presente studio ha condotto esperimenti in vitro e in vivo per studiare gli effetti e il meccanismo di TF contro le cellule di melanoma. Per la prima volta, abbiamo dimostrato gli effetti citotossici pro-apoptotici e inibitori del tumore di TF sulle cellule di melanoma A375. Il suo meccanismo è stato suggerito per essere associato alle vie P53 e JNK. L’innovazione di questo studio è la scoperta dell’efficacia anti-melanoma di TF, mentre i rapporti precedenti si concentravano solo sugli effetti di TF su altri tumori (Lin, 2002; Sur e Panda, 2017). Inoltre, questo è anche il primo rapporto sull’azione molecolare di TF sul percorso JNK, mentre il meccanismo associato al percorso P53 dell’effetto pro-apoptotico di TF sulle cellule di carcinoma è stato precedentemente riportato (Lahiry et al., 2008).
Di recente, i modelli di tumore xenotrapianto utilizzando pesci zebra larvali hanno attirato una crescente attenzione per gli studi anticancro, a causa dei vantaggi dei pesci zebra larvali rispetto ad altri modelli animali: (1) la mancanza di rigetto immunitario contro le cellule umane fornisce un tasso di successo più elevato per lo xenotrapianto; (2) la trasparenza del corpo fornisce l’osservazione visibile in vivo della crescita tumorale e la tossicità dei farmaci; e (3) la generazione su larga scala e la rapida organogenesi fornisce periodi sperimentali più brevi (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). In questo studio, TF esercitato effetto inibitorio dose-dipendente sulla massa tumorale A375 in pesci zebra larvali (Figura 3B), con tasso inibitorio di 46.4% al suo NOAEL (3.9 μM). Il tasso inibitorio era superiore a quello del cisplatino, indicando che TF era più efficace del cisplatino all’interno del loro rispettivo intervallo di dosaggio sicuro. Inoltre, il tasso inibitorio era superiore a quello di un altro pigmento del tè (theabrownin) (Jin et al., 2018), suggerendo TF come il componente più efficace del tè. Tuttavia, l’intervallo di dose efficace in vivo (da 1,3 a 3,9 μM) di TF è molto inferiore al suo intervallo di dose efficace in vitro (da 96,8 a 774,4 μM). La ragione di tale differenza può essere che, dopo la somministrazione orale, i derivati di TF metabolizzati hanno un effetto superiore a quello di TF. Ciò indica che l’applicazione orale può essere più efficiente di altre vie per TF.
Secondo la regola di conversione della dose, le dosi efficaci (1,3 e 3,9 μM) di TF nei pesci zebra larvali possono essere stimate come 0,03 a 0,09 mg/kg nell’uomo (Zhang et al., 2003). Ciò suggerisce che la somministrazione orale di TF ad una gamma di dosi così bassa può essere efficace nel trattamento di pazienti con melanoma, indicando un buon rapporto costo-efficacia di questo composto. Fino alla nostra conoscenza, ci sono solo pochi rapporti riguardanti l’applicazione clinica del TF. Uno studio in doppio cieco, randomizzato, controllato con placebo e a gruppi paralleli ha applicato l’estratto di tè verde arricchito con TF per trattare pazienti con ipercolesterolemia da lieve a moderata per 12 settimane (Maron et al., 2003). In quello studio, l’assunzione giornaliera di TF era di 75 mg in estratto di tè verde, che ha ridotto significativamente il colesterolo totale, LDL-C, e trigliceridi in adulti ipercolesterolemici senza osservazione di eventi avversi significativi (Maron et al., 2003). In questo studio, la gamma di dosi efficaci di TF era molto più bassa di quella riportata, suggerendo un maggiore potenziale di TF per il trattamento del melanoma in clinica. Tuttavia, anche se l’intervallo di dose efficace di TF era piccolo, la sua soglia di dose letale alle larve di zebrafish era anche bassa (<60,5 μM) ed era inferiore ad altri pigmenti di tè (Figura 3A) (Jin et al., 2018), lasciando una preoccupazione per la potenziale tossicità di TF per gli esseri umani. È interessante notare che abbiamo trovato che TF ha esercitato poco effetto sulla linea cellulare normale (fibroblasto cutaneo HFF-1) (Figura 1B), suggerendo una fattibilità clinica per il suo uso esterno che può evitare la potenziale tossicità del suo uso interno.
Il nostro esperimento meccanicistico ha mostrato che TF ha attivato ATM, CHK1/2, P53, CASP8/3 nel percorso P53 e anche attivato ASK1, JNK, e C-JUN nel percorso JNK, associando l’apoptosi delle cellule A375. L’apoptosi è stata determinata dalla colorazione DAPI e dall’analisi citometrica di flusso a livello cellulare (Figura 2) e mediata dalla sovraespressione dei geni pro-apoptotici (P53, BAX, BIM e PUMA) e dall’attivazione delle proteine legate all’apoptosi (caspasi e PARP) a livello molecolare (Figure 4 e 5). P53 (TP53) codifica una fosfoproteina nucleare legata al DNA con attività di soppressione tumorale, che agisce come fattore di trascrizione al centro di una rete per il controllo dell’apoptosi in risposta a stress cellulari (Martin et al., 2002). Attiva l’apoptosi stimolando la trascrizione dei geni della famiglia Bcl-2, come BAX, BIM e PUMA (Levine e Oren, 2009). BAX e BIM codificano membri pro-apoptotici che provocano apoptosi e morte cellulare attivando la cascata delle caspasi in risposta a stimoli apoptotici (Rossé et al., 1998; Youle e Strasser, 2008). PUMA, come modulatore dell’apoptosi up-regolato da P53, codifica una proteina contenente il dominio BH3 che si localizza nei mitocondri, interagisce con Bax e Bak, e attiva la cascata delle caspasi mediante scissione di CASP3 (Nakano e Vousden, 2001; Letai, 2009). In questo studio, CASP8 e CASP3 sono state scisse in risposta all’attivazione di P53. CASP8 è una caspasi iniziale nella cascata apoptotica, che attiva CASP3 per la frammentazione apoptotica del DNA, con conseguente scissione di PARP (c-PARP) per eseguire il processo apoptotico (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP è responsabile della riparazione del DNA e della vitalità cellulare in risposta allo stress esogeno (Satoh e Lindahl, 1992). Può essere scisso da CASP3 e quindi facilita lo smontaggio cellulare nell’apoptosi (Oliver et al., 1998). Quindi, la quantità di PARP scissa (c-PARP) può essere usata come marcatore di apoptosi cellulare.
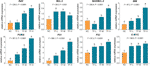
Figura 4 Espressione relativa dell’mRNA dei geni bersaglio dell’aflavina (TF) nelle cellule A375 dopo 24 ore di trattamento. Per mezzo di Fisher minima differenza significativa (LSD) confronti multipli, dati (media ± SD) con la stessa lettera minuscola (a vs. a; b vs. b; c vs. c) indicano nessuna differenza significativa tra di loro, mentre i dati con lettere diverse (a vs. b vs. c vs. d) indicano una differenza significativa tra di loro.
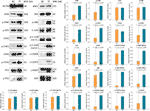
Figura 5 Espressione e fosforilazione delle proteine mirate alla teaflavina (TF) in cellule A375 dopo 24 ore di trattamento. I dati (media ± SD) con lettere minuscole diverse sono significativamente diversi tra loro a Fisher’s least significant difference (LSD) confronti multipli.
Nei nostri studi precedenti, abbiamo riportato che l’induzione del danno al DNA era associata al meccanismo pro-apoptotico mediato dal pathway P53 della teabrownina (Wu et al., 2016; Jin et al., 2018). Tuttavia, anche se sia TF che theabrownin hanno attivato il percorso di P53 e indotto l’apoptosi delle cellule tumorali, non abbiamo trovato l’induzione del danno al DNA con il trattamento TF in questo studio. In alternativa, abbiamo trovato l’attivazione della cascata ASK1-JNK-C-JUN, che funziona anche come via apoptotica. In questo modulo di segnalazione, ASK1 (apoptosis signal-regulating kinase 1) è una proteina chinasi attivata da mitogeno che gioca un ruolo chiave nell’apoptosi indotta da citochine e stress innescando la via mitocondriale (Matsuzawa e Ichijo, 2001; Zhang et al., 2003). Attiva la segnalazione JNK a valle in risposta a diversi tipi di stress, portando all’apoptosi cellulare attraverso l’attivazione di C-JUN e la successiva sovraespressione di geni pro-apoptotici (Tobiume et al., 2001). I chemioterapici, come il cisplatino, il docetaxel e il paclitaxel, sono stati riportati per indurre l’apoptosi delle cellule di melanoma attraverso la via JNK indipendente dalla via P53 (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Questo indica che TF potrebbe avere un vantaggio rispetto a questi farmaci a causa del suo meccanismo d’azione mediato da un doppio percorso, che è stato preliminarmente dimostrato dai maggiori effetti tumorali inibitori di TF rispetto a quelli del cisplatino in questo studio. Tuttavia, ci sono alcune limitazioni di questo studio come segue: (1) le azioni delle vie P53 e JNK nel meccanismo duale mediato dal TF non è stato verificato; (2) l’interazione tra le vie P53 e JNK non è stata studiata, e quale via giochi il ruolo principale è sconosciuto; e (3) la gamma di dosi in vitro e la gamma di dosi in vivo sono abbastanza diverse, la cui ragione è stata spiegata ma necessita di prove sperimentali. Per affrontare questi problemi, sono necessari ulteriori studi in futuro. Per esempio, siRNA o inibitori di P53 e JNK dovrebbero essere usati per verificare le azioni di queste vie e per esplorare l’interazione tra di loro, e i metaboliti sierici di TF dovrebbero essere analizzati chimicamente e studiati farmacologicamente per testare la nostra ipotesi che i derivati di TF metabolizzati hanno un effetto maggiore di quello di TF. Inoltre, poiché non ci sono rapporti clinici di TF per il trattamento del cancro, l’efficacia terapeutica e i benefici di TF sui pazienti affetti da cancro dovrebbero essere ulteriormente studiati.
Conclusione
Siccome il potenziale anticancro di TF è stato ben documentato, rimane incerto se TF sia efficace nel trattamento del melanoma. In questo studio, utilizzando la linea cellulare di melanoma e il modello di zebrafish xenograft, abbiamo trovato effetti citotossici pro-apoptotici e inibitori del tumore di TF sulle cellule di melanoma e abbiamo rivelato il suo meccanismo in associazione con le attivazioni delle vie P53 e JNK. Questo è il primo studio che descrive gli effetti e il meccanismo di TF contro le cellule di melanoma. Poiché il meccanismo di TF non dipendeva solo dal percorso di P53, ci si può aspettare che TF possa essere efficace nel trattamento delle linee cellulari con P53-mutate. Ulteriori studi sono giustificati per verificare questa deduzione. Complessivamente, questo studio fornisce la prova dell’efficacia di TF contro il melanoma, che contribuisce allo sviluppo di agenti derivati da TF per la terapia del melanoma.
Data Availability Statement
I dati grezzi che supportano le conclusioni di questo articolo sono disponibili dall’autore corrispondente su richiesta ragionevole.
Dichiarazione etica
Lo studio sugli animali è stato rivisto e approvato dal comitato etico della Zhejiang Chinese Medical University.
Contributi degli autori
LeZ ha eseguito il lavoro principale di questo articolo. BY ha condotto gli esperimenti cellulari e molecolari. LiZ e SM hanno contribuito alla scrittura di questo manoscritto. WD ha fornito idee e supporto finanziario a questo lavoro. YX ha condotto l’esperimento con lo zebrafish. LS ha progettato questo lavoro e ha redatto il manoscritto. TE ha migliorato il progetto e la bozza di questo articolo. Tutti gli autori hanno contribuito all’articolo e hanno approvato la versione presentata.
Finanziamento
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (Grant No. 81774331, 81873049, e 81973873), la Zhejiang Provincial Natural Science Foundation of China (Grant No. LY18H270004), la Zhejiang Provincial Science and Technology Project of Traditional Chinese Medicine of China (Grant No. 2016ZZ011), la Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditional Chinese Pharmacology), e la Opening Foundation of China (Grant No. ZYX2018006).
Conflitto di interessi
YX è stato impiegato dalla società Hunter Biotechnology, Inc.
I restanti autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Abbreviazioni
DAPI, 4′-6-diamidino-2-fenilindolo; DMEM, mezzo Dulbecco modificato di Eagle; DMSO, dimetilsolfossido; dpf, giorni dopo la fecondazione; FBS, siero fetale bovino; FI, intensità di fluorescenza; LSD, minima differenza significativa di Fisher; NOAEL, no observed adverse effect level; MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide; PARP, poly ADP-ribose polymerase; SDS-PAGE, denaturing sodium dodecyl sulfate polyacrylamide gel electrophoresis; TCM, theaflavin; TF, Traditional Chinese medicine.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflavins ritardare la migrazione delle cellule del cancro al seno umano inibendo NF-kappaB attraverso p53-ROS cross-talk. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A. H., Yakovlev, A. G., Ivanova, V., Stoica, B. A., Wang, G., Iyer, S., et al. Ruolo della scissione della polimerasi ADP-ribosio (PARP) nell’apoptosi. Il mutante PARP resistente alla caspasi 3 aumenta il tasso di apoptosi nelle cellule trasfettate. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). La caspasi-3 è necessaria per la frammentazione del DNA e i cambiamenti morfologici associati all’apoptosi. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownin innesca il danno al DNA per sopprimere le cellule umane osteosarcoma U2OS attivando la via di segnalazione p53. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Xenotrapianti di zebrafish come strumento per studi in vivo sul cancro umano. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Studi comparativi sugli effetti ipolipemizzanti e soppressivi della crescita delle foglie di tè oolong, nero, pu-erh e verde nei ratti. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. Contributo della transattivazione di Bax mediata da p53 nell’apoptosi delle cellule di carcinoma epiteliale mammario indotta dalla teaflavina. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. Le teaflavine hanno come bersaglio Fas/caspasi-8 e le vie Akt/pBad per indurre l’apoptosi nelle cellule di cancro al seno umano mutate in p53. Carcinogenesi 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebrafish: un nuovo modello sulla passerella farmaceutica. BioEssays News Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Melanoma cutaneo: Dalla patogenesi alla terapia (Review). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma colpisce Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). I primi 30 anni di p53: sempre più complesso. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Theaflavins inibire la sintasi ATP e la catena respiratoria senza aumentare la produzione di superossido. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Chemioprevenzione del cancro da polifenoli del tè attraverso la modulazione delle vie di trasduzione del segnale. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Il composto Vitexin 1, una nuova estrazione da un’erba cinese, sopprime la crescita delle cellule di melanoma attraverso il danno al DNA aumentando i livelli di ROS. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatino induce la conformazione proapoptotica di Bak in un modo deltaMEKK1-dipendente. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Il tè e i suoi componenti prevengono il cancro: Una revisione del meccanismo legato al redox. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Effetto ipocolesterolemizzante di un estratto di tè verde arricchito con teaflavina: uno studio controllato randomizzato. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. Integrazione dei dati di mutazione e analisi strutturale della proteina soppressore di tumori TP53. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Meccanismi molecolari della decisione tra la vita e la morte: regolazione dell’apoptosi da parte dell’apoptosis signal-regulating kinase 1. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Coinvolgimento dello stress del reticolo endoplasmatico nell’apoptosi JNK-dipendente indotta da Docetaxel nel melanoma umano. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumina: Un nuovo candidato per la terapia del melanoma? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, un nuovo gene proapoptotico, è indotto da p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Strategie nanotecnologiche emergenti per la chemioterapia sistemica contro il melanoma. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Importanza della polimerasi (ADP-ribosio) e della sua scissione nell’apoptosi. Lezione da un mutante non salvabile. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). High-throughput in vivo screening vertebrato. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). Le sostanze fenoliche del tè lavorato. I. Frazionamento e cromatografia su carta delle sostanze solubili in acqua. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Progressi nell’immunoterapia per il melanoma: una revisione completa. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. Bcl-2 prolunga la sopravvivenza cellulare dopo il rilascio di citocromo c indotto da Bax. Natura 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. Progressi sui polifenoli naturali come agenti antitumorali per il cancro della pelle. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Ruolo della formazione di poli (ADP-ribosio) nella riparazione del DNA. Natura 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Lo stress mitocondriale indotto dal taxolo nelle cellule di melanoma è mediato dall’attivazione delle vie c-Jun N-terminal kinase (JNK) e p38 attraverso la proteina disaccoppiante 2. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Le teaflavine sopprimono la crescita tumorale e le metastasi attraverso il blocco della via STAT3 nel carcinoma epatocellulare. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. La pro-caspasi-3 è un importante bersaglio fisiologico della caspasi-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Aspetti molecolari del cancro chemiopreventivo ed efficacia terapeutica del tè e polifenoli del tè. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Sintesi delle teaflavine e delle loro funzioni. Mol. (Basilea Svizzera) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Data Processing System (DPS) software con disegno sperimentale, analisi statistica e data mining sviluppato per l’uso nella ricerca entomologica. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. ASK1 è richiesto per attivazioni sostenute di JNK/p38 MAP kinasi e apoptosi. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analisi sulla teoria della patogenesi della tossina del cancro e sulla teoria del ‘consolidamento della resistenza del corpo e dello sgombero della fonte’. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Effetto antiproliferativo e di induzione dell’apoptosi di theabrownin contro le cellule A549 di adenocarcinoma polmonare non a piccole cellule. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Una revisione epidemiologica della dieta e del melanoma maligno cutaneo. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). La famiglia di proteine BCL-2: attività opposte che mediano la morte cellulare. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebrafish: un modello animale per studi tossicologici. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin inibisce la progressione del ciclo cellulare e la crescita tumorale del carcinoma polmonare attraverso il meccanismo legato a c-myc. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar