Introduzione
L’uso di rimedi naturali è un’antica tradizione ancora in pratica, con >60% della popolazione mondiale che affronta vari problemi di salute, compreso il cancro, usando la medicina tradizionale come prima scelta (Sultana et al., 2014). Tuttavia, il trattamento del cancro è complesso, e le possibilità attuali per i pazienti dipendono dal tipo di cancro e dallo stadio, oltre che dall’età, dal sesso e dalla salute generale del paziente. Anche se la chemioterapia ha solitamente successo durante le prime fasi del cancro, la sua efficacia dipende dallo schema di somministrazione del farmaco e dalle condizioni fisiologiche del paziente. Tuttavia, la principale preoccupazione riguardo alla chemioterapia è la sua tossicità, poiché i farmaci impiegati tendono a colpire sia le cellule cancerose che quelle normali, con un alto indice di proliferazione che genera danni collaterali nei pazienti. Inoltre, le cellule tumorali possono sviluppare resistenza al trattamento, esibendo metastasi, e quindi diminuendo la risposta al trattamento e riducendo la possibilità di sopravvivenza libera da malattia. Pertanto, una delle sfide chiave nella scoperta dei farmaci è la riduzione della tossicità degli agenti chemioterapici e lo sviluppo di farmaci più efficaci ed efficienti per migliorare i trattamenti, i tempi di recupero e la qualità complessiva della vita dei pazienti.
I prodotti naturali hanno fornito una ricca fonte di strutture chimiche per lo sviluppo di trattamenti anticancro. Nell’area della farmaceutica oncologica, il 49% dei farmaci impiegati nella chemioterapia sono derivati o ispirati da fonti naturali come piante, microrganismi e organismi marini (Newman e Cragg, 2016). Gli esempi includono gli alcaloidi della vinca e i taxani (agenti leganti la tubulina), oltre alle podofillotossine, alle antracicline e agli etoposidi (inibitori della topoisomerasi) (Da Rocha et al., 2001; Nobili et al., 2009). Questi esempi illustrano il potenziale dei prodotti naturali nella scoperta di farmaci.
Gli AA sono metaboliti secondari prodotti dalla famiglia delle Annonaceae (Figura 1). Nella medicina tradizionale, il frutto del genere Annona è usato per il trattamento di febbre, dolore, reumatismi, diarrea e artrite, e le sue foglie per il diabete, mal di testa e insonnia (Moghadamtousi et al., 2015a). Annona reticulate è stata impiegata in Africa come trattamento anti-dissenterico e antielmintico, e A. squamosa è usata in India per il trattamento di varie condizioni tra cui i tumori maligni (Savithramma et al., 2011). Inoltre, A. muricata è un rimedio medicinale popolare in America, Africa e India per il trattamento del cancro (Moghadamtousi et al., 2015a), mentre in Messico, A. macroprophyllata, A. muricata e A. purpurea sono utilizzate per il trattamento dei tumori della pelle e del cancro gastrico (Alonso-Castro et al., 2011; Brindis et al., 2013). Secondo una revisione etnofarmacologica delle piante medicinali in Messico, il genere Annona potrebbe anche essere esplorato per il trattamento del cancro al colon (Jacobo-Herrera et al., 2016). Queste evidenze indicano che gli AA sono molecole con un significativo potenziale bioattivo.

Figura 1 Nucleo di acetogenine: lineari, epossiche, mono-tetraidrofurano (THF), bis-THF e tris-THF.
Sono stati descritti ad oggi oltre 500 AA; questi composti sono caratterizzati da una lunga catena alifatica con un anello α, β-insaturo γ-lattone e anelli 0-3 tetraidrofurano (THF) (Yuan et al, 2015), e hanno mostrato attività citotossica contro diverse linee cellulari di cancro umano (cioè, polmone, seno, colon, rene, pancreas, prostata, fegato e vescica) (rivisto in Zeng et al, 1996; Chávez e Mata, 1998; Wang et al., 2002; Yuan et al., 2003; Mangal et al., 2016; Miao et al., 2016a; Miao et al., 2016b) oltre all’attività antitumorale in vivo (Chen et al., 2012a; Chen et al., 2012b). Qui, abbiamo esaminato i rapporti più recenti sugli AA nel campo della scoperta di farmaci-oncologia.
Materiali e metodi
Abbiamo effettuato una ricerca nel database PubMed utilizzando i seguenti termini chiave: “acetogenine e cancro”, “attività antitumorale delle acetogenine”, “citotossicità delle acetogenine” e “meccanismo d’azione delle acetogenine”, tra le altre combinazioni. Abbiamo esaminato gli articoli pubblicati negli ultimi 15 anni che si basavano su due criteri: piante con uso medicinale e la metodologia di frazionamento guidata dal biodosaggio. I dati in vitro qui riportati si basano esclusivamente sull’attività dei composti puri, mentre per gli studi in vivo, sono stati considerati anche gli estratti di erbe a causa della mancanza di saggi in modelli animali.
Risultati e discussione
Studi in vitro
Nel campo dei prodotti naturali, la ricerca di molecole bioattive tende a coinvolgere un frazionamento degli estratti guidato dal test biologico per trovare la molecola o le molecole principali responsabili dell’attività. Tuttavia, molti metaboliti secondari possono colpire più caratteristiche del cancro. In generale, l’industria farmaceutica è interessata a farmaci che mostrano più di un’interazione molecolare e comprendono vari obiettivi molecolari.
Le acetogenine sono molecole con un grande potenziale per la futura terapia del cancro. La loro attività biologica più importante è l’inibizione del complesso mitocondriale I a causa della loro struttura bis-THF. Infatti, è stato precedentemente segnalato che gli AA mono-THF con una catena alchilica che collega la parte lattonica con il gruppo THF sono inibitori non competitivi del Complesso I (cioè, NADH: ubichinone ossidoreduttasi) nella catena respiratoria, che porta ad un blocco dell’ossidazione fosforilativa e una conseguente diminuzione della produzione di ATP (Tormo et al., 1999; Chen et al., 2012). Tale inibizione coinvolge un ampio gruppo di vie che possono indurre la morte cellulare, tra cui l’apoptosi e l’autofagia, o agire in altre reti metaboliche come inibitori dell’enzima lattato deidrogenasi A, come antiossidante, o arrestando il ciclo cellulare.
Inoltre, A. muricata (Moghadamtousi et al, 2015a) e A. squamosa L. (Chen et al., 2012a; Chen et al., 2012b; Chen et al., 2012c; Chen et al., 2016) sono stati riportati per avere attività citotossica contro diverse linee cellulari di cancro umano o di altri mammiferi. In particolare, gli AAs annosquatins A (1) e B (2) mostrano selettività verso le linee cellulari MCF-7 e A-549, rispettivamente (Chen et al., 2012c). La tabella 1 mostra gli AA scoperti più recentemente che mostrano attività citotossica, oltre ad altri composti meno recenti che mostrano attività antineoplastica in vivo (tabella 2).
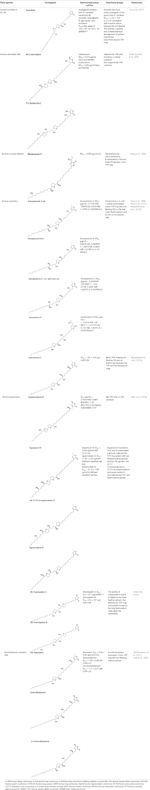
Tabella 1 Attività citotossica delle acetogenine in vitro in diverse linee cellulari di cancro.

Tabella 2 Attività antitumorale in vivo delle acetogenine e di estratti selezionati ricchi di acetogenine.
L’apoptosi è una strategia naturale di morte cellulare che uccide le cellule inutili o danneggiate. I principali geni coinvolti in questo processo sono p53 e la famiglia bcl2; il primo è un soppressore tumorale, mentre il secondo potrebbe essere sia proapoptotico (BAD, BAX e BAK tra gli altri) o antiapoptotico (bcl2, e bcl-x) (Okada e Mak, 2004). La funzione primaria di p53 è di prevenire la replicazione delle cellule con danni al DNA. Pertanto, p53 è inattiva, e le cellule danneggiate continuano a crescere e a replicare mutazioni del DNA, dando luogo a malattie come il cancro (Igney e Krammer, 2002; Okada e Mak, 2004). Così, la ricerca condotta fino ad oggi può essere classificata in due temi principali: induzione dell’apoptosi o meccanismi di resistenza all’apoptosi.
Le attuali chemioterapie che inducono l’apoptosi causano gravi effetti secondari sui pazienti. Come tale, la ricerca di farmaci meno tossici è una priorità e ci si aspetta che i prodotti naturali aiutino lo sviluppo di farmaci che modulano l’apoptosi. In questo contesto, gli AA aumentano l’attività delle caspasi 3 e 8 (effettori dell’apoptosi), mentre diminuiscono l’espressione di survivin e Bcl-2, aumentando così l’apoptosi. L’annonacina AA (3) promuove l’apoptosi nelle cellule tumorali attivando le vie della caspasi 3 e Bax (Yuan et al., 2003), mentre la squamocina induce l’apoptosi attraverso l’espressione dei geni proapoptotici Bax e Bad, che risulta nella scissione della PARP e nell’aumento dell’attività della caspasi 3 nelle cellule tumorali della vescica T24 (Yuan et al., 2006). Questo contrasta con i risultati precedenti in cui la squamocina non induceva l’apoptosi nelle cellule del cancro al seno ma inibiva la proliferazione bloccando il ciclo cellulare nella fase G1 (Raynaud et al., 1999).
L’estratto metanolico di A. reticulata inibisce l’espressione delle caspasi 6 e 9 nelle cellule del cancro al colon e al fegato (Mondal et al., 2007), mentre gli estratti organici e acquosi di A. squamosa down-regolano l’espressione di Bcl-2 nelle cellule di cancro al seno MCF-7 e nelle cellule leucemiche K-562, indicando il loro effetto come induttori di apoptosi (Pardhasaradhi et al., 2005). Inoltre, l’estratto di foglie di A. muricata induce l’espressione delle caspasi 3 e 9 e inibisce la proliferazione cellulare riducendo la fosfo-ERK e la fosfo-AKT nelle cellule MIA PaCa-2 (Yiallouris et al., 2018).
Gli AAs portano anche all’arresto del ciclo, che ha implicazioni sulla proliferazione delle cellule tumorali. Gli AA regolano il ciclo cellulare nella transizione G1/S inibendo l’espressione della ciclina D1 nelle cellule di carcinoma epatocellulare umano (Qian et al., 2015). In questo contesto, l’estratto di A. muricata arresta il ciclo cellulare nella fase G1 e diminuisce il numero di cellule nella fase S in modo concentrazione-dipendente riducendo l’espressione della ciclina D1, un’importante proteina di regolazione del ciclo cellulare (Torres et al., 2012). Un risultato simile è stato osservato per la squamocina, che arresta le cellule nella fase G1 nelle cellule di cancro alla vescica T24 (Yuan et al., 2006). Nonostante la rilevanza del ciclo cellulare, pochi studi hanno affrontato come gli AA influenzano questo meccanismo.
La glicolisi aerobica, un meccanismo utilizzato dalle cellule tumorali per ottenere energia in assenza di ossigeno (Figueroa-González et al., 2016; García-Castillo et al., 2017), è anche un obiettivo degli AA. Varie proteine ed enzimi glicolitici sono upregolati da HIF-1, un importante fattore di trascrizione coinvolto nella glicolisi aerobica tumorale, nelle cellule tumorali. È interessante notare che l’estratto di A. muricata ha abbassato l’espressione di HIF-1α e NF-κB e i livelli del trasportatore di glucosio GLUT1 e degli enzimi HKII e LDHA nelle cellule tumorali pancreatiche (Torres et al., 2012). Inoltre, l’estratto di foglie di A. muricata ha mostrato effetti antiproliferativi in linee cellulari di cancro e ha promosso la morte cellulare attraverso l’inibizione delle pompe NKA e SERCA (Yiallouris et al, 2018).
D’altra parte, il gene MDR1 codifica la glicoproteina P della membrana cellulare, una proteina trasportatrice chiave che estrude i farmaci anticancro dall’interno delle cellule, limitando così il loro accumulo intracellulare e diminuendo la loro tossicità (Figueroa-González et al., 2012). I metaboliti secondari, come flavonoli, ginsenosidi, polifenoli, alcaloidi e glicosidi resinosi, hanno mostrato risultati interessanti nella modulazione della P-gp nelle linee cellulari tumorali (Phang et al., 1993; Beck et al., 1988; Silva et al., 2001; Jodoin et al., 2002; Zhou et al., 2004; Figueroa-González et al., 2012). Inoltre, gli AA possono down-regolare l’espressione dei geni MDR1 e MRP1 nel carcinoma epatocellulare umano resistente ai farmaci, così come l’espressione della topoisomerasi IIα e della glutatione S-transferasiΠ (Qian et al., 2015).
Di recente, l’autofagia aveva generato interesse come meccanismo di morte cellulare. L’autofagia è un processo catabolico che le cellule eucariotiche attivano quando sono sotto stress, come l’inedia cellulare o la presenza di agenti patogeni (He e Klionsky, 2009). Durante questo processo, la cellula ricicla proteine o organelli non funzionali in un processo a più fasi che coinvolge la degradazione lisosomiale per recuperare infine l’omeostasi cellulare (Kenific e Debnath, 2015). Come tale, la deregolazione del flusso di autofagia potrebbe portare al cancro, poiché il riciclaggio di macromolecole, organelli non funzionali e proteine fornisce alle cellule tumorali un elevato fabbisogno metabolico per la proliferazione cellulare (Kenific e Debnath, 2015; García-Castillo et al., 2017). In questo scenario, l’autofagia è diventata un interessante bersaglio terapeutico, e gli AA potrebbero essere in grado di inibire questo processo. Liu et al. (2012) hanno riferito che il composto AA005 (un analogo dell’acetogenina) ha inibito la produzione di ATP, attivato AMPK e bloccato la via del complesso mTOR 1 per indurre infine l’autofagia nelle cellule del cancro del colon e arrestare il ciclo cellulare nella fase G1. Questo composto è un mimico degli AA, in cui un’unità etere di glicole etilenico sostituisce i due anelli THF. Tale modalità chimica conferisce un’attività biologica superiore, un esempio della plasticità degli AA da considerare come ispirazione per creare nuove e più potenti molecole con diversi obiettivi farmacologici.
Attività antitumorale delle acetogenine in modelli animali
I dati riguardanti l’attività antitumorale degli AA e degli estratti di Annona sono particolarmente promettenti poiché questi composti hanno mostrato attività antitumorale in modelli animali. Gli studi in vivo forniscono informazioni chiave sulle prestazioni del farmaco in un intero organismo e permettono di valutare non solo il loro effetto antitumorale ma anche la loro tossicità in diversi organi. È importante sottolineare che gli animali sono soggetti sperimentali che permettono di eseguire il follow-up clinico, compresa la valutazione del risultato clinico, la progressione libera da malattia e la sopravvivenza, e la recidiva della malattia.
L’estratto etilico acetato di A. squamosa che è ricco di AAs 12,15-cis-squamostatina-A (4) e bullatacina (5) ha ridotto la crescita tumorale dei tumori epatocellulari nei topi con un tasso inibitorio massimo del 69,55% rispetto al controllo positivo (ciclofosfamide) (Chen et al., 2012b). È stato suggerito che la configurazione cis in uno dei componenti potrebbe essere responsabile dell’attività citotossica della preparazione a base di erbe. Inoltre, la bullatacina (5) isolata da A. squamosa alla dose di 15 μg/kg ha ridotto efficacemente la crescita del tumore nei topi con xenotrapianti S180 e HepS del 65,8 e 63,4%, rispettivamente. Questi risultati sono superiori a quelli ottenuti utilizzando concentrazioni più elevate di taxolo (40 μg/kg). La bullatacina (5) possiede una moiety bis-THF adiacente e tre gruppi idrossi, che probabilmente costituiscono la struttura bioattiva (Chen et al., 2012a).
L’olio di semi di A. squamosa ha inibito il 53,54% della crescita tumorale in topi portatori di cellule H22 (Chen et al., 2016) e ha ridotto l’espressione di IL-6, Jak, e vari trasduttori di segnale fosforilati e attivatori della trascrizione p-Stat3 pathway. È stato anche riportato che le α, β-insature γ-lattone moieties presenti negli AAs sono accettori di reazione Michael (Ji et al., 2012), che inibiscono l’attivazione di Stat3, un bersaglio terapeutico coinvolto nella proliferazione cellulare, apoptosi, infiammazione e angiogenesi (Cafferkey e Chau, 2016). L’estratto di A. muricata ha rallentato la crescita tumorale in xenotrapianti di pancreas (Yiallouris et al., 2018), riducendo le metastasi diminuendo i livelli della metalloproteinasi-9, e promuovendo la morte delle cellule tumorali attraverso la necrosi (Torres et al., 2012). In uno xenotrapianto di prostata, l’estratto di A. muricata arricchito di flavonoidi ha migliorato la biodisponibilità e ha mostrato una minore tossicità rispetto all’estratto arricchito di AA (Yang et al., 2015).
Laherradurin (6) e cherimolin-2 (7) sono stati isolati dalla pianta medicinale A. diversifolia e testati in vivo contro cellule tumorali cervicali e colorettali (Schlie-Guzmán et al., 2009). Entrambi gli AA hanno ridotto le dimensioni dei tumori HeLa con valori simili a quelli della doxorubicina; entrambi i composti hanno anche mostrato un’attività antiproliferativa in vitro contro la stessa linea cellulare tumorale. Questi risultati sono in accordo con altri rapporti, dove la molecola più attiva è stata riportata essere laherradurin (6), che possiede adiacenti bis-THF moieties e una struttura β-idrossi γ-metil γ-lattone, mentre cherimolin-2 (7) che contiene una non adiacente bis-THF moiety e una unità γ-lattone mostra una ridotta attività antitumorale. La tabella 2 delinea le attività antitumorali di vari AA in modelli animali.
Studi di tossicità
Gli esperimenti con gli animali dovrebbero includere protocolli di tossicità orale acuta per testare le sostanze chimiche e osservare i segni di tossicità; questi minimizzano il numero di animali necessari, assicurano una corretta somministrazione della dose negli esperimenti, ed evitano la sofferenza (OECD, 2008). Tuttavia, ad oggi, ci sono poche informazioni sulla tossicità degli AA o degli estratti di Annona. Per esempio, la DL50 per l’estratto etanolico di A. muricata nei topi era di 1,67 g/kg secondo Sousa et al. (2010). Arthur et al. (2011) hanno riportato la LD50 (<5 g/kg) dell’estratto acquoso, registrando che una dose maggiore potrebbe danneggiare i reni. Inoltre, è stato osservato che l’estratto di semi di A. squamosa potrebbe causare danni al fegato (Miao et al., 2016b), e l’estratto di A. muricata arricchito di flavonoidi ha mostrato una ridotta tossicità in uno xenotrapianto di prostata (Yang et al., 2015). La cherimolina-2 isolata da A. diversifolia ha mostrato effetti tossici e morte in xenotrapianti SW480 a dosi superiori a 5 mg/kg/giorno (Schlie-Guzmán et al., 2009).
Come spiegato prima, gli AA possono inibire il complesso 1 della catena respiratoria attraverso il trasporto della catena degli elettroni nei mitocondri. Gli AA si uniscono e bloccano l’enzima NADH, che di solito è sovraespresso nelle cellule tumorali, inibendo la produzione di ATP, portando infine alla morte cellulare. Presumibilmente, tale meccanismo suggerisce che gli AA sono “innocui” per le cellule normali; tuttavia, dovrebbero essere eseguiti più studi per assicurare la selettività di queste molecole.
Conclusione
La chemioterapia non è specifica per le cellule tumorali; essa causa diversi effetti collaterali indesiderati come danni ai tessuti e organi normali. Tuttavia, l’aspetto più importante della chemioterapia convenzionale è che in un numero significativo di casi, le cellule tumorali sviluppano meccanismi di resistenza che permettono la progressione del tumore e le metastasi.
La ricerca di nuovi farmaci in natura non è nuova. Diversi derivati di sostanze naturali sono attualmente utilizzati per trattare diverse malattie. Per esempio, il taxolo (paclitaxel) che è stato scoperto dalla conoscenza tradizionale è considerato il trattamento del cancro più redditizio sul mercato. È interessante notare che il paclitaxel è un farmaco antimitotico che inibisce la proliferazione cellulare nelle colture cellulari ma, nei tumori, è stato documentato che induce divisioni multipolari, il che descrive come una molecola può avere diversi meccanismi di azione a seconda delle condizioni in vitro o del paziente. Questo alcaloide ha 30 anni di storia e illustra i principali ostacoli del lavoro con i prodotti naturali, la loro limitata disponibilità biologica e i costi di produzione, ma anche l’incredibile efficacia nell’uccidere le cellule tumorali.
Le acetogenine sono molecole anticancro versatili che causano la morte delle cellule tumorali con diversi meccanismi. Possono modulare l’esclusione dei farmaci chemioterapici dalle cellule tumorali e sono forti induttori di apoptosi. La loro flessibilità bioattiva si riflette nella loro capacità di regolare il ciclo cellulare arrestando le cellule in fase G1, promuovendo l’apoptosi attraverso l’inibizione di varie proteine, e anche di indurre l’autofagia. Inoltre, spiccano le loro interazioni metaboliche, specificamente legate ai fattori di trascrizione HIF1 e STAT3 e le sue ripercussioni sul consumo energetico, l’angiogenesi, l’infiammazione e le metastasi. L’attività antitumorale degli AA in vivo è promettente (bullatacina, laherradurin e cherimolin-2 sono esempi). Tuttavia, i dati preclinici non sono sufficienti per ottenere una buona comprensione della farmacodinamica e della cinetica degli AA, e sono necessari più test di tossicità acuta e di solubilità per assicurare la sicurezza e la possibilità di test clinici con gli esseri umani. Inoltre, l’incorporazione di diversi ligandi (ad esempio, anticorpi, vitamine e peptidi) o la preparazione di derivati specifici per il tumore potrebbero migliorare l’attività degli AA e produrre farmaci più adatti.
Gli estratti di piante sono chimicamente complessi, e le loro proprietà curative spesso dipendono dalle interazioni tra i composti e dalle loro proporzioni all’interno dell’estratto. C’è ancora molto da scoprire sull’impatto degli AA nel cancro. Questo campo offre l’opportunità di trovare nuove molecole per il trattamento di questa complessa malattia. La standardizzazione degli estratti è, quindi, una possibile alternativa all’uso di integratori a base di erbe, soprattutto nelle piante in cui le attività farmacologiche sono basate sulla combinazione di più di un composto. Questa mini-review elenca alcuni AA precedentemente studiati che presentano attività antitumorale e potrebbero avere un futuro nella ricerca clinica sul cancro.
Contributi degli autori
NJ-H ha contribuito all’ideazione, alla scrittura e alla discussione dell’articolo; CP-P ha contribuito sostanzialmente alla discussione e alla revisione del manoscritto; VC-T ha preparato tutte le figure e le tabelle; MM-V e AG-E hanno contribuito alla sezione chimica dell’articolo; AZ-D ha contribuito notevolmente alla discussione di biologia molecolare dell’articolo. Tutti gli autori hanno discusso, rivisto e approvato la versione finale del manoscritto da pubblicare.
Finanziamento
Questo lavoro è stato sostenuto dal Consejo Nacional de Ciencia y Tecnología (CONACYT), Messico (borsa numero 285884). VC-T è stato finanziato da CONACYT (borsa di studio numero 267787).
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi.
Riconoscimenti
NJ-H ringrazia CONACYT per il finanziamento del progetto.
Alonso-Castro, A. J., Villarreal, M. L., Salazar-Olivo, L. A., Gómez-Sánchez, M., Domínguez, F., García-Carrancá, A. (2011). Piante medicinali messicane utilizzate per il trattamento del cancro: studi farmacologici, fitochimici ed etnobotanici. J. Ethnopharmacol. 133, 945-972. doi: 10.1016/j.jep.2010.11.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Arthur, F., Woode, E., Terlabi, E., Larbie, C. (2011). Valutazione della tossicità acuta e subcronica di Annona muricata (Linn). estratto acquoso negli animali. Eur. J. Exp. Biol. 1 (4), 115-124.
Google Scholar
Beck, W. T., Cirtain, M. C., Glover, C. J., Felsted, R. L., Safa, A. R. (1988). Effetti degli alcaloidi indolici sulla resistenza multifarmaco e sull’etichettatura della P-glicoproteina da parte di un analogo di fotoaffinità della vinblastina. Biochem. Biophys. Res. Commun. 153, 959-966. doi: 10.1016/S0006-291X(88)81321-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Brindis, F., González-Trujano, M. E., González-Andrade, M., Aguirre-Hernández, E., Villalobos-Molina, R. (2013). Estratto acquoso di Annona macroprophyllata: un potenziale inibitore di α-glucosidasi. Biomed Res. Int. 443 (2), 495-499. doi: 10.1155/2013/591313
CrossRef Full Text | Google Scholar
Cafferkey, C., Chau, I. (2016). Nuovi inibitori di STAT3 per il trattamento del cancro gastrico. Expert Opin. Investig. Drugs 25, 1023-1031. doi: 10.1080/13543784.2016.1195807
PubMed Abstract | CrossRef Full Text | Google Scholar
Chávez, D., Mata, R. (1998). Purpurediolin e purpurenin, due nuovi citotossici adiacente bis-tetraidrofurano annonaceo acetogenine dai semi di Annona purpurea. J. Nat. Prod. 61, 580-584. doi: 10.1021/np970410
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Xu, S., Wang, Y., Li, X., Cai, B., et al. Attività antitumorale delle acetogenine annonacee in xenotrapianti di HepS e S180 su topi. Bioorg. Med. Chem. Lett. 22, 2717-2719. doi: 10.1016/j.bmcl.2012.02.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Sh, Xu, Chen, J., Wang, Y., Xu, H., Fan, N., et al. Attività antitumorale dell’estratto di semi di Annona squamosa contenente composti di acetogenina annonacea. J. Ethnopharmacol. 142, 462-466. doi: 10.1016/j.jep.2012.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Wang, Y., Xu, S., Li, X. (2012c). Sei acetogenine annonacee citotossiche dai semi di Annona squamosa. Chimica alimentare. 135, 960-966. doi: 10.1016/j.foodchem.2012.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, Y., Shi, Y., Ch, Ma, Wang, X., Li, Y., et al. (2016). Attività antitumorale dell’olio di semi di Annona squamosa. J. Ethnopharmacol. 193, 362-367. doi: 10.1016/j.jep.2016.08.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Da Rocha, A. B., Lopes, R. M., Schwartsmann, G. (2001). Prodotti naturali nella terapia antitumorale. Curr. Opin. Pharmacol. 1, 364-369. doi: 10.1016/S1471-4892(01)00063-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Elisya, Y., Kardono, L. B. S., Simanjuntak, P. (2014). Formulazione della compressa dell’estratto solubile in acetato di etile di soursop (Annona muricata L). foglie. AJAS 2 (3), 323-329.
Google Scholar
Figueroa-González, G., Jacobo-Herrera, N., Zentella-Dehesa, A., Pereda-Miranda, R. (2012). Inversione o resistenza multi-farmaco da glicosidi di resina di gloria del mattino in cellule umane di cancro al seno. J. Nat. Prod. 75 (1), 93-97. doi: 10.1021/np200864m
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueroa-González, G., García-Castillo, V., Coronel-Hernández, J., López-Urrutida, E., León-Cabrera, S., Arias-Romero, L. E., et al. (2016). Attività antinfiammatoria e antitumorale di una tripla terapia per un cancro colorettale legato alla colite. J. Cancer 7 (12), 1632-1644. doi: 10.7150/jca.13123
PubMed Abstract | CrossRef Full Text | Google Scholar
García-Castillo, V., López-Urrutia, E., Villanueva-Sánchez, O., Ávila-Rodríguez, MÁ, Zentella-Dehesa, A., Cortés-González, C., et al. (2017). Targeting rimodellamento metabolico nel cancro al seno triplo negativo in un modello murino. J. Cancer 8 (2), 178-189. doi: 10.7150/jca.16387
PubMed Abstract | CrossRef Full Text | Google Scholar
He, C., Klionsky, D. J. (2009). Meccanismi di regolazione e vie di segnalazione di autofagia. Annu. Rev. Genet. 43, 67-93. doi: 10.1146/annurev-genet-102808-114910
PubMed Abstract | CrossRef Full Text | Google Scholar
Igney, F. H., Krammer, P. H. (2002). Morte e anti-morte: resistenza dei tumori all’apoptosi. Nat. Rev. Cancer 2 (4), 277-288. doi: 10.1038/nrc776
PubMed Abstract | CrossRef Full Text | Google Scholar
Jacobo-Herrera, N. J., Jacobo-Herrera, F. E., Zentella-Dehesa, A., Andrade-Cetto, A., Heinrich, M., Pérez-Plasencia, C. (2016). Piante medicinali utilizzate nella medicina tradizionale messicana per il trattamento del cancro colorettale. J. Ethnopharmacol. 179, 391-402. doi: 10.1016/j.jep.2015.12.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Ji, L., Yuan, Y., Luo, L., Chen, Z., Ma, X., Ma, Z., et al. (2012). Physalins con attività anti-infiammatoria sono presenti in Physalis alkekengi var. franchetii e può funzionare come accettori di reazione di Michael. Steroidi 77, 441-447. doi: 10.1016/j.steroids.2011.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Jodoin, J., Demeule, M., Béliveau, R. (2002). Inibizione dell’attività della P-glicoproteina della resistenza multidroga da parte dei polifenoli del tè verde. Biochim. Biophys. Acta 1542 (1-3), 149-159. doi: 10.1016/S0167-4889(01)00175-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenific, C. M., Debnath, J. (2015). Funzioni cellulari e metaboliche per l’autofagia nelle cellule tumorali. Trends Cell Biol. 25 (1), 37-45. doi: 10.1016/j.tcb.2014.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Ko, Y. M., Wu, T. Y., Wu, Y. C. h., Chang, F.r., Guh, J.Y., Chuang, L. Y. (2011). L’annonacina induce l’arresto della crescita dipendente dal ciclo cellulare e l’apoptosi nei percorsi legati al recettore degli estrogeni-α nelle cellule MCF-7. J. Ethnopharmacol. 137, 1283-1290. doi: 10.1016/j.jep.2011.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Lima, L. A. R. S., Alves, T. M. A., Zani, C. L., Júnior, P. A. S., Romanha, A. J., Johann, S., et al. (2014). Attività citotossiche, antifungine, tripanocide e leishmanicide in vitro di acetogenine isolate da Annona cornifolia A. St.-Hil. (Annonaceae). An. Acad. Bras. Cienc. 86 (2), 829-839. doi: 10.1590/0001-3765201420130048
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Cheng, X., Guo, L. X., Ch, Mao, YJ, Chen, Liu, H. X., et al. (2012). Identificazione di un mimetico delle acetogenine annonacee, AA05, come attivatore di AMPK e induttore di autofagia nelle cellule del cancro al colon. PLoS One 7 (10), e47049-e-47049. doi: 10.1371/journal.pone.0047049
CrossRef Full Text | Google Scholar
Mangal, M., Khan, M. I., Agarwal, S. M. (2016). Acetogenine come potenziali agenti antitumorali. Agenti anticancro Med. Chem. 16, 138-159. doi: 10.2174/1871520615666150629101827
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Xu, X. F., Chen, Y., Chen, J. W., Li, X. (2016a). Tre acetogenine annonacee citotossiche dai semi di Annona squamosa. Phytochem. Lett. 16, 92-96. doi: 10.1016/j.phytol.2016.03.006
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Li, F. Q., Shan, C. h. X., Chen, Y., Chen, J. W., et al. (2016b). Studio metabolomico sulla tossicità dell’Annona squamosa mediante spettrometria di massa ad alta definizione con cromatografia liquida ad alte prestazioni accoppiata ad un approccio di riconoscimento dei modelli e all’analisi dei percorsi metabolici. J. Ethnopharmacol. 184, 187-195. doi: 10.1016/j.jep.2016.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Fadaeinasab, M., Nikzad, S., Mohan, G., Ali, H. M., Kadir, H. A. (2015a). Annona muricata (Annonaceae): una revisione del suo uso tradizionale, acetogenine isolate e attività biologiche. Int. J. Mol. Sci. 16, 15625-15658. doi: 10.3390/ijms160715625
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Rouhollahi, E., Karimian, H., Fadaeinasab, M., Firoozinia, M., Abdulla, M. A., et al. (2015b). L’effetto chemiopotenziale delle foglie di Annona muricata contro i focolai aberranti della cripta colonica indotti da azoxymethane nei ratti e l’effetto di apoptosi dell’acetogenina annomuricina E nelle cellule HT-29: un approccio bioassay-guidato. PLoS One 10 (4), e0122288. doi: 10.1371/journal.pone.0122288
PubMed Abstract | CrossRef Full Text | Google Scholar
Mondal, S. K., Mondal, N. B., Mazumder, U. K. (2007). In vitro effetto citotossico e caspasi ricombinante umana di Annona reticulata foglie. Indian J. Pharmacol. 39, 253-254. doi: 10.4103/0253-7613.37279
CrossRef Full Text | Google Scholar
Newman, D. J., Cragg, G. M. (2016). Prodotti naturali come fonti di nuovi farmaci dal 1981 al 2014. J. Nat. Prod. 79 (3), 629-661. doi: 10.1021/acs.jnatprod.5b01055
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobili, S., Lippi, D., Witort, E., Donnini, M., Bausi, L., Mini, E., et al. (2009). Composti naturali per il trattamento e la prevenzione del cancro. Pharmacol. Res. 59, 365-378. doi: 10.1016/j.phrs.2009.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
OECD (2008). “Testo n. 425: Tossicità orale acuta: procedura up and down” in OECD Guildelines for the testing of chemicals, Section 4. OECDiLibrary. https://www.oecd-ilibrary.org/environment/test-no-425-acute-oral-toxicity-up-and-down-procedure_9789264071049_en
Google Scholar
Okada, H., Mak, T. W. (2004). Percorsi di morte apoptotica e non apoptotica nelle cellule tumorali. Nat. Rev. Cancer 4 (8), 592-603. doi: 10.1038/nrc1412
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardhasaradhi, B. V., Reddy, M., Ali, A. M., Kumari, A. L., Khar, A. (2005). Effetti citotossici differenziali degli estratti di semi di Annona squamosa sulle linee cellulari tumorali umane: ruolo delle specie reattive dell’ossigeno e del glutatione. J. Biosci. 30, 237-244. doi: 10.1007/BF02703704
PubMed Abstract | CrossRef Full Text | Google Scholar
Phang, J. M., Poore, M., Lopaczynska, J., Yeh, G. C. (1993). Flavonol-stimola l’efflusso di 7,12-dimetilbenz(a)antracene in cellule di cancro al seno multi-farmaco resistenti. Cancer Res. 53, 5977-5981.
PubMed Abstract | Google Scholar
Qian, J. Q., Sun, P., Pan, Z. Y., Fang, Z. Z. (2015). Le acetogenine annonacee invertono la resistenza ai farmaci del carcinoma epatocellulare umano BEL-7402/5-FU e delle linee cellulari HepG2/ADM. Int. J. Clin. Exp. Pathol. 8 (9), 11934-11944.
PubMed Abstract | Google Scholar
Raynaud, S., Némati, F., Miccoli, L., Michel, P., Poupon, M. F., Fourneau, C., et al. Effetti antitumorali della squamocina su linee cellulari MCF7 (adenocarcinoma mammario umano) parentali e multidrug resistant. Life Sci. 65 (5), 525-533. doi: 10.1016/S0024-3205(99)00273-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Savithramma, N., Rao, M. L., Suhrulatha, D. (2011). Screening di piante medicinali per i metaboliti secondari. MEJSR 8 (3), 579-584.
Google Scholar
Schlie-Guzmán, M. A., García-Carrancá, A., González-Esquinca, A. R. (2009). Attività antiproliferativa in vitro e in vivo di laherradurin e cherimolin-2 di Annona diversifolia Saff. Phytother. Res. 23, 1128-1133. doi: 10.1002/ptr.2760
PubMed Abstract | CrossRef Full Text | Google Scholar
Silva, G. L., Cui, B., Chávez, D., Tu, M., Hee-Byung, C., Rasoanaivo, P., et al. (2001). Modulazione del fenotipo di multi-farmaco-resistenza da nuovi esteri aromatici di alcaloidi tropanici da Erythroxylum pervillei. J. Nat. Prod. 64 (12), 1514-1520. doi: 10.1021/np010295+
PubMed Abstract | CrossRef Full Text | Google Scholar
Sousa, O. V., Vieira, G. D., Pinho, JJRGd, Yamamoto, C. H., Alves, M. S. (2010). Attività antinocicettive e antinfiammatorie dell’estratto etanolico delle foglie di Annona muricata L. in modelli animali. Int. J. Mol. Sci. 11 (5), 2067-2078. doi: 10.3390/ijms11052067
PubMed Abstract | CrossRef Full Text | Google Scholar
Sultana, S., Asif, H. M., Nazar, H. M. I., Akhtar, N., Rehman, J. U., Rehman, R. U. (2014). Piante medicinali che combattono contro il cancro – un approccio verde anticancro. Asian Pac. J. Cancer P 15 (11), 4385-4394. doi: 10.7314/APJCP.2014.15.11.4385
CrossRef Full Text | Google Scholar
Tantithanaporn, S., Wattanapiromsakul, C., Itharat, A., Keawpradub, N. (2011). Attività citotossica di acetogenine e lattoni stirilici isolati da estratti di radice di Goniothalamus undulatus Ridl. contro una linea cellulare di cancro al polmone (COR-L23). Phytomedicine 18, 486-490. doi: 10.1016/j.phymed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Tormo, J. R., Gallardo, T., Aragón, R., Cortes, D., Estornell, E. (1999). Interazioni specifiche delle acetogenine annonacee monotetraidrofuriche come inibitori del complesso mitocondriale I. Chem. Biol. Interact. 122, 171-183. doi: 10.1016/S0009-2797(99)00120-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Torres, M. P., Rachagani, S., Purohit, V., Pandey, P., Joshi, S., Moore, E. D., et al. (2012). Graviola: un nuovo promettente farmaco di derivazione naturale che inibisce la tumorigenicità e le metastasi delle cellule del cancro pancreatico in vitro e in vivo attraverso l’alterazione del metabolismo cellulare. Cancer Lett. 323 (1), 29-40. doi: 10.1016/j.canlet.2012.03.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, L. Q., Min, B. S., Li, Y., Nakamura, N., Qin, G. W., Li, C. J., et al. Acetogenine annonacee dalle foglie di Annona montana. Bioorg. Med. Chem. 10, 561-565. doi: 10.1016/S0968-0896(01)00303-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Gundala, R., Mukkavilli, R., Vangala, S., Reid, M. D., Aneja, R. (2015). Interazioni sinergiche tra flavonoidi e acetogenine nelle foglie di Graviola (Annona muricata) conferiscono protezione contro il cancro alla prostata. Carcinogenesis 36 (6), 656-665. doi: 10.1093/carcin/bgv046
PubMed Abstract | CrossRef Full Text | Google Scholar
Yiallouris, A., Patrikios, I., Johnson, E. O., Sereti, E., Dimas, K., De Ford, C., et al. (2018). L’annonacina promuove la morte selettiva delle cellule tumorali attraverso vie NKA-dipendenti e SERCA-dipendenti. Cell Death Dis. 9 (764), 13. doi: 10.1038/s41419-018-0772-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, F., Bai, G., Chen, Y., Miao, Y., Chen, J., Li, X. (2015). Relazioni struttura-attività di diversi ACGs contro la linea cellulare di cancro al polmone umano multidrug resistant A549/Taxol. Bioorg. Med. Chem. Lett. 25, 787-790. doi: 10.1016/j.bmcl.2014.12.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S., Chang, H. L., Chen, H. W., Yeh, Y. T., Kao, Y. H., Lin, K. H., et al. L’annonacina, un’acetogenina mono-tetraidrofurano, arresta le cellule tumorali nella fase G1 e causa citotossicità in un percorso legato a Bax. E caspasi-3 percorso correlato. Life Sci. 72, 2853-2861. doi: 10.1016/S0024-3205(03)00190-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S, Chang, H. L., Chen, H. W., Kuo, F. c. h., Liaw, C. h. C. h., Su, J. H., et al. (2006). Citotossicità selettiva della squamocina sulle cellule di cancro alla vescica T24 nella fase S attraverso un percorso legato a Bax, Bad e caspasi-3. Life Sci. 78, 869-874. doi: 10.1016/j.lfs.2005.05.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, L., Wu, F. E., Oberlies, N. H., McLaughlin, J. L., Sastrodihajo, S. (1996). Cinque nuove acetogenine ad anello monotetraidrofurano dalle foglie di Annona muricata. J. Nat. Prod. 59, 1035-1042. doi: 10.1021/np960447e
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, S., Lim, L. Y., Chowbay, B. (2004). Modulazione a base di erbe della P-glicoproteina. Drug Metab. Rev. 36 (1), 57-104. doi: 10.1081/DMR-120028427
PubMed Abstract | CrossRef Full Text | Google Scholar