- Introduzione
- Materiali e metodi
- Popolazione dello studio
- Variabili dello studio
- Risultati
- Distribuzione del gruppo sanguigno AB0/Rh nei pazienti con PCa
- Nessuna differenza significativa nelle caratteristiche clinicopatologiche tra i pazienti con PCa secondo i gruppi sanguigni AB0/Rh
- Nessun valore prognostico significativo del gruppo sanguigno per la sopravvivenza libera da BCR dopo RP
- Discussione
- Consenso informato
- Dichiarazione etica
- Contributi degli autori
- Dichiarazione di conflitto di interessi
Introduzione
Il cancro alla prostata (PCa) è la neoplasia più comune nei paesi occidentali e la seconda causa di morte per cancro nei maschi (1). I fattori di rischio più riconosciuti per lo sviluppo del PCa sono l’età crescente, l’origine etnica e la storia familiare (2). La predisposizione familiare suggerisce una componente genetica ereditaria della malattia (3), ma rappresenta solo una minoranza (5-10%) dei casi di PCa. Di conseguenza, i fattori ambientali e genetici predisponenti per la maggior parte dei pazienti sono ancora sconosciuti (4, 5). Il gruppo sanguigno AB0 è una caratteristica ereditaria che è stata associata all’incidenza e alla prognosi di diversi tumori maligni (6-8). Diversi meccanismi plausibili, tra cui l’infiammazione, l’immunosorveglianza delle cellule maligne, l’adesione intercellulare e la segnalazione di membrana sono stati proposti per spiegare l’associazione osservata tra i gruppi sanguigni AB0 e il rischio di cancro.
Gli antigeni del gruppo sanguigno AB0 (ABH) sono glicoproteine espresse sulla superficie dei globuli rossi. Gli antigeni fenotipici A e B sono carboidrati terminali sintetizzati dall’aggiunta di singoli zuccheri catalizzati da una serie di glicosiltransferasi specifiche. Il fenotipo 0 è caratterizzato dall’assenza di glicosiltransferasi A e B, per cui è presente solo una spina dorsale proteica, l’antigene H. Gli antigeni dei globuli rossi hanno varie funzioni, tra cui l’integrità strutturale della membrana, il trasporto di molecole attraverso le membrane e l’adesione (9). Oltre alla loro espressione sui globuli rossi, gli antigeni ABH sono espressi anche in una varietà di cellule epiteliali tra cui l’urotelio, la mucosa gastrointestinale e i polmoni. Diversi studi hanno dimostrato cambiamenti del modello di espressione ABH nelle cellule tumorali in base al grado del tumore e alla progressione della malattia, suggerendo una possibile associazione tra il gruppo sanguigno AB0 e il rischio di alcuni tumori maligni epiteliali (8, 10). Studi recenti hanno dimostrato che gli individui con gruppo sanguigno A, AB, o B avevano una maggiore incidenza di cancro al pancreas rispetto a quelli con gruppo sanguigno 0, mentre il rischio più alto tra è stato trovato essere legato al gruppo sanguigno B (8). Allo stesso modo, è stato riportato che il sierotipo A del sangue è associato a un rischio maggiore di cancro gastrico, al seno e alle ovaie (11). D’altra parte, il gruppo sanguigno 0 è stato correlato con i più alti tassi di recidiva e progressione dopo la resezione transuretrale della vescica e quindi associato a una prognosi peggiore nei pazienti con carcinoma uroteliale della vescica non muscolare invasivo (6).
In base all’attuale evidenza del ruolo predittivo del gruppo sanguigno in diverse neoplasie, abbiamo ipotizzato che il tipo di gruppo sanguigno possa essere utilizzato come un parametro aggiuntivo, che facilita la valutazione dei rischi e aiuta a stimare la prognosi dopo l’intervento chirurgico nei pazienti con PCa. Nella letteratura attuale, ci sono solo limitate prove cliniche disponibili riguardo al gruppo sanguigno e al PCa in generale, che hanno dimostrato risultati controversi (12-14) Inoltre, attualmente, esiste solo uno studio con un’attenzione particolare all’impatto dei gruppi sanguigni sull’esito nei pazienti dopo la prostatectomia radicale (RP) (13). Utilizzando 555 pazienti con PCa sottoposti a RP, gli autori hanno dimostrato che il gruppo sanguigno AB0 è un predittore indipendente di recidiva biochimica (BCR) nell’analisi multivariabile ma non in quella univariabile.
Quindi, lo scopo del presente studio è stato quello di aggiungere ulteriori informazioni al dibattito in corso analizzando la correlazione del gruppo sanguigno AB0/Rh e la sua distribuzione nei pazienti con PCa, la patologia tumorale, la recidiva e la mortalità nei pazienti con PCa localizzato sottoposti a RP utilizzando un ampio dataset di 3.574 pazienti.
Materiali e metodi
Popolazione dello studio
Lo studio è stato approvato dal comitato di revisione istituzionale. Un totale di 3.582 pazienti con PCa clinicamente localizzato che sono stati sottoposti a RP presso il nostro istituto tra il 2009 e il 2010 sono stati selezionati per l’inclusione dello studio. Quelli con set di dati incompleti e follow-up mancante sono stati esclusi (n = 8), lasciando 3.574 pazienti disponibili per l’analisi.
La prostatectomia radicale è stata eseguita utilizzando un approccio retropubico aperto (n = 3.220) o un approccio laparoscopico assistito dalla robotica (n = 354), come descritto in precedenza (15). La dissezione linfonodale è stata eseguita nei pazienti D’Amico a rischio intermedio e ad alto rischio secondo le linee guida dell’Associazione Europea di Urologia (EAU) per il PCa (16). I campioni chirurgici sono stati trattati secondo le procedure istopatologiche standard e valutati da uropatologi esperti in un centro ad alto volume (>2.000 campioni di prostatectomia all’anno). I tumori sono stati classificati secondo il sistema di stadiazione TNM dell’American Joint Committee on Cancer del 2007 e la classificazione istopatologica è stata assegnata secondo il sistema Gleason (17).
Tutti i partecipanti sono stati sottoposti a test sierologici prima della RP. La conferma di laboratorio del gruppo sanguigno AB0 e Rh è stata ottenuta dal dipartimento di medicina trasfusionale dell’ospedale universitario di Amburgo-Eppendorf. La distribuzione di riferimento AB0 della popolazione tedesca è stata usata come controllo (18).
Variabili dello studio
Le variabili dello studio includevano il gruppo sanguigno AB0/Rh, l’età, l’antigene prostatico specifico (PSA) preoperatorio, il volume della prostata (ecografia transrettale), il punteggio di Gleason (campione), lo stadio pT, lo stato pN, il margine chirurgico, il BCR e la mortalità dopo RP. Il follow-up del paziente consisteva nel controllo del PSA ogni 3-6 mesi durante i primi 2 anni dopo la RP, il BCR è stato definito come un livello di PSA ≥0,2 ng/ml.
La relazione tra il gruppo sanguigno AB0 e le variabili clinicopatologiche sono state valutate utilizzando test chi-quadrato e t-test. Nell’analisi multivariabile di regressione di Cox (test log-rank), l’impatto del gruppo sanguigno, del PSA preoperatorio, del punteggio di Gleason, dello stadio pT, dello stato pN e del margine chirurgico sulla sopravvivenza libera da BCR sono stati valutati al fine di valutare i valori prognostici per la sopravvivenza. La probabilità di sopravvivenza libera da BCR è stata confrontata nei gruppi 0, A, B, e AB usando l’analisi Kaplan-Meier e il test log-rank.
Tutti i test erano a due code e i valori di p-valori <0,05 sono stati considerati statisticamente significativi. Le analisi statistiche sono state eseguite con il software JMP v9.0.2 (SAS Institute, Inc, Cary, NC, USA) e R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Risultati
Un totale di 3.574 pazienti con PCa clinicamente localizzato era eleggibile per le analisi finali, l’età mediana all’intervento era di 65 anni (range: 38-80) e il follow-up mediano era di 36,9 mesi (Tabella 1).

Tabella 1. Associazione del gruppo sanguigno AB0 e del fattore Rhesus con le caratteristiche clinicopatologiche di 3.574 pazienti trattati con prostatectomia radicale.
Distribuzione del gruppo sanguigno AB0/Rh nei pazienti con PCa
La distribuzione del gruppo sanguigno AB0 tra i pazienti con PCa prima della RP era la seguente: 0 in 1.350 (38%), A in 1.605 (45%), B in 445 (12%), e AB in 174 (5%) pazienti, l’83% dei pazienti era Rh positivo (Tabella 1). La distribuzione di riferimento per la popolazione tedesca è data come (18): 0 nel 41%; A nel 43%; B nell’11%; AB nel 5%; Rhesus positivo: 85%. Le distribuzioni complessive dei gruppi sanguigni AB0 e Rh nella coorte dello studio erano equivalenti alla distribuzione osservata nella popolazione maschile tedesca.
Nessuna differenza significativa nelle caratteristiche clinicopatologiche tra i pazienti con PCa secondo i gruppi sanguigni AB0/Rh
La maggioranza dei pazienti aveva un PCa clinicamente localizzato con profilo di rischio intermedio. Il punteggio di Gleason più riportato era 3 + 4 (66,9%) e il 63,3% dei pazienti aveva livelli di PSA preoperatorio nel range di 4-10 ng/ml. I tumori pT2 sono stati rilevati nel 68,7% e i margini negativi sono stati raggiunti nell’81,3% dei pazienti. Il volume mediano della prostata era di 40 ml e il coinvolgimento linfonodale è stato diagnosticato in 224 (6,3%) pazienti (Tabella 1). Non c’erano differenze significative nelle caratteristiche clinicopatologiche tra i pazienti con diversi gruppi sanguigni AB0. Percentuali leggermente maggiori di stadio tumorale avanzato (≥pT3b) sono state trovate nei pazienti con gruppo sanguigno AB rispetto ai gruppi sanguigni 0, A e B (16,1, 12,6, 9,9, e 13,7%, rispettivamente, p = 0,033). La popolazione di pazienti con AB ha anche mostrato un rapporto moderatamente aumentato di fattore Rh negativo (21,8%) rispetto agli altri gruppi sanguigni (16,9%, p = 0,01) (Tabella 1).
Nessun valore prognostico significativo del gruppo sanguigno per la sopravvivenza libera da BCR dopo RP
Secondo l’analisi di regressione multivariabile cox, il PSA preoperatorio, il punteggio di Gleason, lo stadio pT, lo stato pN e il margine chirurgico erano significativamente e indipendentemente correlati alla sopravvivenza libera da BCR (tutti p < 0,05) (Tabella 2). Tuttavia, non abbiamo potuto osservare alcun impatto del gruppo sanguigno AB0 sui tassi di BCR (Figura 1). Abbiamo valutato ulteriormente il valore prognostico del gruppo sanguigno 0 rispetto ai gruppi sanguigni non-0 e all’interno dei gruppi sanguigni alternativi A/B/AB con risultati non significativi (Tabella 2). Anche se sono state eseguite sottoanalisi solo con pazienti con stato dei margini positivo o negativo, l’influenza di AB0/Rh su BCR è rimasta insignificante (Figure 2A,B). Inoltre, anche lo stato del fattore Rhesus dei pazienti non aveva alcun impatto sulla sopravvivenza libera da BCR (p = 0,74).
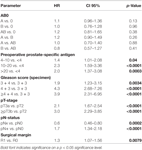
Tabella 2. Modelli multivariabili di regressione cox di AB0 e fattori prognostici standard per la sopravvivenza libera da recidiva biochimica.
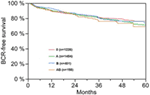
Figura 1. Sopravvivenza libera da recidiva biochimica (BCR) dopo prostatectomia radicale stratificata per gruppi sanguigni AB0 (p = 0,572).
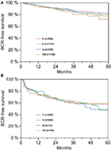
Figura 2. (A,B) Sopravvivenza libera da recidiva biochimica (BCR) dopo prostatectomia radicale stratificata per gruppi sanguigni AB0 in pazienti con stato di margine chirurgico negativo e positivo.
Discussione
Possibili associazioni tra il gruppo sanguigno AB0 e il rischio di alcune neoplasie epiteliali, tra cui il cancro pancreatico, colorettale e gastrico sono state riportate frequentemente (19, 20). Inoltre, i gruppi sanguigni AB0/Rh sono disponibili per la maggior parte dei pazienti prima dell’intervento chirurgico, quindi suggeriti come un marcatore aggiuntivo ideale senza ulteriori passaggi di laboratorio.
Diversi decenni fa, gli studi immunoistochimici hanno indicato che le cellule di PCa derivate dai pazienti mostrano diversi modelli di espressione ABH rispetto alle cellule prostatiche normali/benigne (21). Poiché sia il gruppo sanguigno AB0 che l’espressione del suo antigene sui tessuti sono stati riportati come associati all’incidenza, alla progressione della malattia e all’esito di diversi tumori maligni (8, 22, 23), tale espressione alterata dell’antigene ABH nel tessuto prostatico ha suggerito una possibile influenza del gruppo sanguigno sulla trasformazione maligna delle cellule prostatiche.
Un recente studio pubblicato da Markt e colleghi (14) ha analizzato la relazione tra il gruppo sanguigno AB0 e il rischio di avere un PCa aggressivo. Gli autori hanno analizzato un set di dati di 2.774 pazienti con PCa aggressivo e 4.443 pazienti senza PCa come controlli. Utilizzando questi dati, non è stato possibile dimostrare una correlazione significativa tra il gruppo sanguigno AB0 o la “dose” di alleli A o B e il rischio di PCa aggressivo. Mentre gli autori hanno anche riportato la mortalità specifica e complessiva del cancro stratificata per gruppi sanguigni, lo studio non ha incluso informazioni sul trattamento del PCa. Inoltre sono stati inclusi solo i pazienti con tumori aggressivi che potrebbero mascherare il potenziale effetto dei diversi gruppi sanguigni.
Questi risultati sono in linea con uno studio condotto da Kvist e colleghi, che non ha dimostrato alcuna correlazione tra il gruppo sanguigno AB0 e la sopravvivenza dei pazienti con PCa gestito con vigile attesa. Questo studio era principalmente limitato dal piccolo numero di casi (n = 279) (12). È interessante notare che l’unico studio incentrato sui pazienti dopo RP che includeva 555 pazienti giapponesi ha recentemente riportato che il gruppo sanguigno 0 era significativamente associato a un rischio ridotto di BCR dopo RP in analisi multivariabile ma non univariabile (13). Nella sottoanalisi dei pazienti con un margine chirurgico negativo, il tasso di BCR-free a 5 anni nel gruppo sanguigno 0 era significativamente più alto di quello del gruppo A (91,2 contro 71,0%; p = 0,026). In questa coorte di studio, il 46,3% dei pazienti aveva un margine positivo nonostante uno stadio clinico di T1c nel 74,2% dei pazienti. Lo stadio patologico (pT) non è stato menzionato.
La nostra coorte retrospettiva di 3.574 pazienti con PCa clinicamente localizzato è la più grande coorte analizzata finora per determinare un possibile impatto di entrambi i gruppi sanguigni AB0 e Rh sulle caratteristiche del tumore e sull’esito dopo RP. Nel presente studio, la maggior parte dei pazienti aveva tumori pT2 (68,7%) e il 18,6% aveva margini positivi. Utilizzando questi dati, non abbiamo potuto mostrare alcun impatto significativo dei gruppi sanguigni AB0/Rh sulle caratteristiche clinicopatologiche (PSA preoperatorio, Gleason score, volume della prostata, stadio pT, stato pN, e margine chirurgico) e sulla sopravvivenza libera da BCR dopo RP curativa. Inoltre, quando si è eseguita una sottoanalisi con i soli pazienti con stato del margine positivo o negativo, l’influenza di AB0/Rh sul BCR è rimasta insignificante. Quindi, non abbiamo potuto riprodurre i risultati dello studio giapponese (13). A differenza di altre neoplasie come il cancro al pancreas o alla vescica, il gruppo sanguigno AB0/Rh non ha fornito alcun valore prognostico nel PCa.
Ci sono diverse limitazioni importanti nel nostro studio. Innanzitutto le limitazioni inerenti alle analisi retrospettive e la mancanza di un gruppo di controllo. Inoltre, la nostra coorte di studio contiene prevalentemente PCa localizzati con un profilo di rischio da basso a intermedio (Gleason score 3 + 4 nel 66,9%, PSA preoperatorio di 4-10 ng/ml nel 63,3%, pT2 nel 68,7% e margini negativi nell’81,3% dei pazienti) permettendo la preselezione dei pazienti con prognosi favorevole. Inoltre, la distribuzione complessiva di AB è – in contrasto con gli altri gruppi sanguigni – generalmente poco abbondante (4,9%). Alcune osservazioni come il rapporto moderatamente aumentato di fattore Rh negativo (21,8%) nei pazienti con AB rispetto agli altri gruppi sanguigni (16,9%, p = 0,01) potrebbero essere potenziati a causa della rarità del tipo AB Rh-negativo, che impedisce un rilevamento staticamente significativo di una correlazione all’interno di questo sottogruppo. Infine, mancavano informazioni sul genotipo del rispettivo gruppo sanguigno.
Oltre alle caratteristiche sopra menzionate, le preoccupazioni ambientali, geografiche e razziali non possono mai essere trascurate nel discutere le correlazioni del gruppo sanguigno AB0 con il cancro. Le differenze razziali ed etniche nei gruppi sanguigni e nel PCa sono ben note (24, 25). In Europa, dove il PCa è il tumore maligno più comune e la seconda causa di morte per cancro negli uomini (1), i gruppi sanguigni più frequenti sono A e 0, aumentando all’allele B da ovest a est. Al contrario, i paesi asiatici con la più bassa incidenza e il basso grado di PCa sono caratterizzati da un’alta presenza di tipi B e una relativa bassa frequenza di 0, così come una popolazione più piccola con fattore Rh negativo (26). In questo senso, i nostri risultati differiscono dallo studio attuale nei pazienti giapponesi con un’alta percentuale di margini positivi e BCR dopo la RP curativa (13).
Sono stati proposti diversi meccanismi per spiegare come il gruppo sanguigno influenzi l’incidenza e la progressione del cancro; tuttavia, rimangono ancora poco chiari. Nel caso del cancro alla vescica, è stata suggerita un’aberrazione cromosomica, perché il gene AB0 si trova sul cromosoma 9q34, un’area che è frequentemente alterata nel cancro alla vescica (27). Poiché il gene AB0 codifica effettivamente per le glicosiltransferasi, che catalizzano il trasferimento degli zuccheri all’antigene H (0), l’insorgenza del cancro alla vescica è potenzialmente correlata al gruppo sanguigno 0. Al contrario, è stato riportato che gli individui con gruppi sanguigni non 0 (A, AB e B) hanno un rischio elevato di sviluppare il cancro gastrico e indicano un ruolo specifico del gruppo sanguigno nel cancro.
Riguardo al PCa, ci sono diversi sforzi in corso per chiarire il ruolo del gruppo sanguigno nella sopravvivenza dopo la terapia. È stato già riportato che i pazienti con gruppo sanguigno non-0 dovrebbero avere un rischio maggiore di tromboembolia venosa dopo la RP, che potrebbe avere un’influenza sull’esito (28). Anche uno studio recentemente pubblicato ha dimostrato che gli anticorpi sierici del gruppo sanguigno A predicono la sopravvivenza su PROSTVAC-VF (un vaccino terapeutico contro il cancro basato sul poxvirus in fase III di studi clinici per il trattamento del PCa avanzato) e dovrebbe essere considerato come un nuovo biomarcatore potenzialmente predittivo per PROSTVAC-VF (29). Anche se nel nostro studio non abbiamo osservato una chiara associazione tra il gruppo sanguigno AB0/Rh e la patologia tumorale e l’esito, tale evidenza suggerisce ancora un ruolo predittivo del gruppo sanguigno nell’epidemiologia del PCa e nell’esito clinico, soprattutto in vista della risposta alla terapia.
Il presente studio con 3.574 pazienti è il più grande finora che analizza l’impatto dei gruppi sanguigni AB0 o Rh sulla patologia e sull’esito dopo la RP e aggiunge importanti conoscenze alla letteratura.
In conclusione, i nostri dati non suggeriscono alcuna associazione rilevante del gruppo sanguigno AB0/Rhesus con caratteristiche clinicopatologiche avverse del tumore o con l’esito oncologico dopo la chirurgia, in contrasto con diversi altri tumori maligni. Tuttavia, ulteriori ricerche sono indicate per valutare una possibile associazione tra il genotipo del gruppo sanguigno o la sua espressione dell’antigene sul tessuto del PCa e la prognosi all’interno di diversi gruppi di terapia, compreso il PCa di alto grado o avanzato, che non erano sufficientemente riflessi nel nostro gruppo di studio.
Consenso informato
Il consenso informato è stato ottenuto da tutti i partecipanti individuali inclusi nello studio.
Dichiarazione etica
Tutte le procedure eseguite negli studi che coinvolgono partecipanti umani erano conformi agli standard etici del comitato di ricerca istituzionale e/o nazionale e alla dichiarazione di Helsinki del 1964 e ai suoi successivi emendamenti o a standard etici comparabili.
Contributi degli autori
SO, DT, e TS: contributi sostanziali all’ideazione o alla progettazione del lavoro, redazione del lavoro, approvazione finale della versione da pubblicare. PM: contributi sostanziali all’ideazione o progettazione del lavoro, stesura del lavoro, approvazione finale della versione da pubblicare. FC: acquisizione, analisi o interpretazione dei dati per il lavoro, revisione critica del contenuto intellettuale importante, approvazione finale della versione da pubblicare. PT: acquisizione, analisi o interpretazione dei dati per il lavoro, revisione critica per importanti contenuti intellettuali, approvazione finale della versione da pubblicare. SP: acquisizione, analisi o interpretazione dei dati per il lavoro, revisione critica per importanti contenuti intellettuali, approvazione finale della versione da pubblicare. JLH, JH e MG: acquisizione, analisi o interpretazione dei dati per il lavoro, revisione critica per importanti contenuti intellettuali, approvazione finale della versione da pubblicare. Tutti gli autori hanno accettato di essere responsabili di tutti gli aspetti del lavoro nel garantire che le questioni relative all’accuratezza o all’integrità di qualsiasi parte del lavoro siano adeguatamente indagate e risolte.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Il curatore ha dichiarato un’affiliazione condivisa, ma nessun’altra collaborazione, con molti degli autori (FC, SP, JH e DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Statistiche sul cancro, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. fattori di rischio per il cancro alla prostata. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Eziologia genetica del cancro alla prostata ereditario. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Segnalato storia familiare di cancro nella prostata, polmone, colorettale e cancro ovarico screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Fattori ambientali ed ereditari nella causalità del cancro – analisi di coorti di gemelli da Svezia, Danimarca e Finlandia. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impatto del gruppo sanguigno ABO sugli esiti in pazienti con cancro primario della vescica non muscolare invasivo. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. Il gene che codifica l’antigene del gruppo sanguigno I: revisione di una I per un occhio. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. L’espressione degli antigeni del gruppo sanguigno A, B e H nel tessuto del carcinoma correla con una prognosi sfavorevole per i pazienti con cancro colorettale. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. Gruppo sanguigno ABO e incidenza del cancro ovarico epiteliale. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Variabili prognostiche in pazienti con cancro alla prostata: influenza del gruppo sanguigno ABO (H), il sistema Rhesus, età, differenziazione, stadio del tumore e metastasi. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associazioni tra gruppi sanguigni ABO e recidiva biochimica dopo prostatectomia radicale. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. Alleli del gruppo sanguigno ABO e rischio di cancro alla prostata: risultati dal consorzio di coorte del cancro al seno e alla prostata (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) aumenta la frequenza nerve-sparing e riduce i margini chirurgici positivi nella prostatectomia radicale aperta e robot-assistita: esperienza dopo 11.069 pazienti consecutivi. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Linee guida sul cancro alla prostata 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Previsione della prognosi per l’adenocarcinoma prostatico mediante classificazione istologica combinata e stadiazione clinica. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Il gruppo sanguigno determina l’incidenza del cancro al pancreas in Germania. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. Gruppi sanguigni ABO e cancro. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. Il sistema dei gruppi sanguigni ABO e Lewis. Immunochimica, genetica e relazione alla malattia umana. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Rilevazione di antigeni del gruppo sanguigno in sezioni congelate di epitelio prostatico. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Espressione di antigeni ABH/Lewis-related come fattori prognostici in pazienti con cancro al seno. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. La trascrizione del gene del gruppo sanguigno ABO è down-regolata nei tumori della vescica umana e nelle linee cellulari uroteliali stimolate alla crescita. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Studi comparativi del cancro alla prostata in Giappone rispetto agli Stati Uniti. Una revisione. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Modelli basati su modelli di mortalità per cancro alla prostata in tutto il mondo. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. Frequenze di fenotipi ABO e Rh(D) di diversi gruppi razziali/etnici negli Stati Uniti. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Caratterizzazione genotipica e fenotipica del gruppo sanguigno ABO(H) nei tumori primari della vescica. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Cancro alla prostata: non O gruppo sanguigno è fattore di rischio VTE dopo prostatectomia radicale. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Anticorpi sierici al gruppo sanguigno A prevedono la sopravvivenza su PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar