Introduzione
L’artrite reumatoide (RA) è una malattia autoimmune, di natura poligenica, caratterizzata da poliartrite con manifestazioni sistemiche e morbilità aumentata e grave.1,2 L’AR colpisce lo 0,5%-1% della popolazione, causando una diminuzione della qualità della vita, una significativa disabilità fisica e un notevole costo economico.3-6 L’espressione clinica della malattia è varia, e va da forme lievi autolimitanti a un’evoluzione molto aggressiva e rapida che culmina con la distruzione dell’articolazione colpita e la conseguente disabilità.7
Studi genetici hanno confermato l’esistenza di un substrato genetico, in parte legato ad alcuni geni che codificano proteine coinvolte nelle risposte delle cellule T.1 Questi risultati rafforzano l’importanza del ruolo attribuito alle cellule T nell’inizio e nella perpetuazione della risposta immunitaria anomala in questa malattia.8
La patogenesi dell’AR è complessa e coinvolge diverse popolazioni cellulari legate alla risposta immunitaria innata e adattativa. Le cellule residenti nella sinovia, come i sinoviociti fibroblastici B o i macrofagi dell’intima, e le cellule infiammatorie del sangue come i linfociti T, i linfociti B e i monociti9 sono coinvolti nella patogenesi. Tutti contribuiscono alla trasformazione aggressiva del fenotipo del sinoviocita B e allo sviluppo di un intenso infiltrato infiammatorio con il risultato finale della distruzione della cartilagine e dell’osso subcondrale10,11 (Fig. 1).
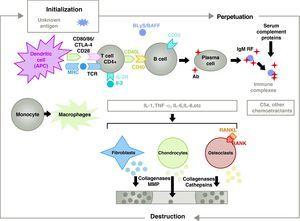
Patofisiologia dell’artrite reumatoide. Organizzazione fisiopatologica generale dell’artrite reumatoide. AC, anticorpo; BAFF, fattore attivante delle cellule B; BLyS, stimolatore dei linfociti B; CD, cluster di differenziazione; CPA, cellula presentante l’antigene; CPH, MHC; CTLA4, antigene associato ai linfociti 4 T citotossico C5a frazione complemento 5a, FR, fattore reumatoide; Ig, immunoglobulina; IL, interleuchina; MMP, metalloproteinasi di matrice; RANK, recettore attivatore del fattore nucleare B kappa; RANKL, recettore attivatore ligando per il fattore nucleare B kappa; RCT, recettore delle cellule T; TNF, fattore di necrosi tumorale.
Il trattamento attuale dell’AR si basa sulla somministrazione di farmaci antireumatici modificanti la malattia (DMARDs) usati da soli o in combinazione.12 Questi farmaci rallentano la distruzione articolare, cioè sono in grado di modificare il corso naturale della malattia.4,13 Tuttavia, la percentuale di pazienti con una risposta clinica soddisfacente è bassa e spesso richiede l’aggiunta di un farmaco biologico in un’alta percentuale di pazienti.9,13-15
Negli ultimi anni sono state identificate nuove molecole e obiettivi terapeutici il cui blocco potrebbe ridurre o eliminare la risposta infiammatoria cronica. Una di queste nuove molecole è abatacept. Abatacept è un costrutto proteico completamente umanizzato, costituito dal dominio extracellulare dell’antigene 4 associato ai linfociti T citotossici umani (CTL4) e da un frammento geneticamente ingegnerizzato della regione Fc dell’immunoglobulina G1 umana (IgG1), che inibisce la costimolazione delle cellule T agendo sul vero nucleo della risposta immunitaria e, quindi, all’inizio della malattia.
Attivazione delle cellule T
Un’efficace attivazione immunitaria delle cellule T richiede la partecipazione di due gruppi di recettori di membrana sulle cellule che presentano l’antigene (APC)14 (Figg. 1 e 2). Il primo è il veicolo utilizzato dalle APC per fornire alla cellula T l’antigene specifico precedentemente elaborato. Nonostante l’enorme sforzo dedicato a questa ricerca, non siamo ancora in grado di identificare gli antigeni artritogenici che scatenano l’AR.8 La presentazione da parte delle APC di un antigene contro cui viene montata una risposta immunitaria specifica è organizzata attraverso un complesso trimolecolare che comprende: molecole del complesso maggiore di istocompatibilità (MHC) presenti nella APC, l’antigene contro cui si sviluppa la risposta immunitaria e un recettore di membrana sulla cellula T (TCR) specifico per quell’antigene15 (segnale o via di segnalazione della risposta immunitaria 1).
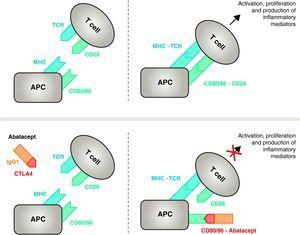
Meccanismo d’azione di abatacept. Il frammento di abatacept che comprende il dominio extracellulare di CTLA4 si lega ai recettori CD80/CD86, impedendo o spostando la sua interazione con il recettore CD28. In questo modo, blocca selettivamente il legame specifico di CD80/CD86 al recettore CD28, che è, fisiopatologicamente, un blocco del secondo segnale per l’attivazione immunitaria e, quindi, l’attivazione delle cellule T CPA, antigen-presenting cell; MHC, major histocompatibility complex; TCR, T cell receptor.
Per inibire la piena attivazione, le cellule T richiedono una seconda serie di recettori di comunicazione intercellulare tra APC e cellule T che avviene attraverso vie costimolatorie e costituisce la cosiddetta risposta immunitaria a 2 segnali.14 Anche se esistono diverse vie costimolatorie, una è essenziale, il legame dei recettori CD80 (B7-1)/CD86 (B7-2) sulla membrana delle APC con il recettore CD28 sulle cellule T.10,16 L’attivazione simultanea di entrambi innesca un’intensa segnalazione intracellulare nelle cellule T, essenziale per la piena attivazione, proliferazione, sopravvivenza e produzione di citochine 8. A 24-48h dall’attivazione dei linfociti T, la stessa segnalazione intracellulare avvia un meccanismo di regolazione che mira a disattivare la risposta stessa. Questo induce l’espressione di CTLA411 sulla membrana cellulare dei linfociti con il compito di competere con CD28 a causa della sua maggiore affinità di legame con CD80/CD86.17,18
L’attivazione di entrambi i sottoinsiemi di cellule T, CD4+ e CD8+ dipende dal recettore costimolatorio CD28. Le cellule T CD4+ sono cellule T helper. Riconoscono i peptidi presentati dalle molecole MHC di classe II presenti sull’APC. Questi antigeni provengono dalla via esogena che processa gli agenti patogeni come i batteri. Molte malattie autoimmuni sono associate a una risposta patologica delle cellule T CD4+. Da parte loro, le cellule T CD8+ sono linfociti citotossici (CTL). Le cellule T CD8+ riconoscono gli antigeni, principalmente virali e tumorali presentati dalle molecole di classe I MHC. All’attivazione, le cellule CD8+ mediano la distruzione delle cellule bersaglio attraverso la produzione di perforina, granzimi e interferone (IFN)-g. Entrambi i sottotipi di cellule T sono attivati dalla costimolazione con CD2815, anche se l’attivazione delle cellule T CD8+ è meno dipendente da questa via di costimolazione. Infatti, mentre tutte le cellule CD4+ esprimono CD28 sulla loro membrana, ciò avviene solo nel 50% circa delle CD8+.19 Inoltre, è stato dimostrato che le cellule CD4+ mostrano una maggiore risposta al legame con CD2820. Inoltre, il promotore di CD28 non è un requisito assoluto per l’attivazione dei CTL.21 Tutto ciò fornirebbe un doppio beneficio terapeutico nella pratica clinica. Da un lato, abatacept agisce preferenzialmente sulla cellula bersaglio nella patogenesi della malattia. Inoltre, la ridotta azione sull’attività dei linfociti CD8+ garantirebbe un migliore profilo di sicurezza in termini di complicazioni virali e tumorali.
L’attivazione delle cellule T CD4+ è il punto di partenza di una cascata proinfiammatoria con produzione di grandi quantità di citochine e proliferazione cellulare che, se perpetuata e mantenuta, come nell’RA, porta a un’infiammazione cronica molto attiva, capace di distruggere i tessuti in cui si scatena, soprattutto le articolazioni nel caso dell’RA8 (Fig. 1). La sinovia comincia a proliferare a causa delle cellule infiltrate dal sangue, tra cui gli stessi linfociti T e i loro sottotipi, così come i linfociti B I monociti si differenziano in macrofagi e osteoclasti e attivano anche i condrociti articolari. In questo ambiente ci sono grandi quantità di citochine proinfiammatorie come l’interleuchina (IL)-1, IL-6 e il fattore di necrosi tumorale (TNF) e molte altre. Le cellule B producono anche autoanticorpi come il fattore reumatoide o gli anticorpi anti peptide citrullinato. Tutti questi portano alla distruzione non solo della membrana sinoviale ma anche dell’osso sottostante e della cartilagine.22
La biotecnologia nel trattamento dell’artrite reumatoide
A causa delle ricerche sopra menzionate, è stata sviluppata e commercializzata la produzione biotecnologica di varie molecole volte a bloccare bersagli specifici. La prima generazione è stata caratterizzata dalla comparsa di farmaci neutralizzanti il TNF: etanercept, infliximab e adalimumab e anakinra, che inibiscono l’azione di IL-1. Successivamente, sono emerse nuove molecole, come abatacept, per modulare la costimolazione della risposta immunitaria, certolizumab e golimumab per bloccare il TNF, rituximab contro il recettore CD20 dei linfociti B, e tocilizumab che blocca IL-6.7,23-26
Nonostante l’enorme salto in termini di efficacia terapeutica dovuto all’introduzione di questi farmaci, una percentuale sostanziale di pazienti, stimata tra il 25% e il 40%, non risponde ai farmaci o ai biologici attualmente in commercio o è interessata dal verificarsi di eventi avversi.27-32 La necessità di migliorare questa situazione rimane un incoraggiamento nella ricerca e sviluppo di nuove molecole volte a regolare diversi bersagli terapeutici che potrebbero migliorare l’efficacia terapeutica, come il caso di abatacept, che modula selettivamente l’attivazione delle cellule T.33
Abatacept è un costrutto proteico prodotto attraverso la tecnologia del DNA ricombinante in cellule ovariche di criceto.34,35 Questa molecola è stata progettata per interferire con la regolazione delle vie costimolatorie nelle cellule T, che svolgono un ruolo importante nella patogenesi di varie malattie autoimmuni, infezioni, rigetto di organi trapiantati e immunità tumorale.36
Abatacept è usato in combinazione con metotrexate in pazienti RA che hanno avuto una risposta inadeguata o intolleranza ad altri DMARDs, compreso il metotrexate (MTX) o un inibitore del TNF-alfa. Nell’artrite idiopatica giovanile poliarticolare è indicato in pazienti di 6 anni o più che hanno avuto una risposta inadeguata ad altri DMARDs compreso almeno un farmaco neutralizzante del TNF.35
Meccanismo d’azione di Abatacept
Abatacept è un modulatore selettivo del segnale costimolatorio CD80/86-CD28, e come precedentemente discusso è essenziale per l’attivazione delle cellule T Abatacept inibisce l’attivazione delle cellule T, bloccando selettivamente il legame specifico del recettore CD80/CD86 in APC al CD28 sulle cellule T (Fig. 2).22,37 La strategia farmacologica cerca di inibire la risposta immunitaria/infiammatoria accelerata, caratteristica della malattia, e ripristinare la normale omeostasi nel sistema immunitario. Infatti, la competizione tra CD28 endogeno e CTLA4 per il legame a CD80/86 è il meccanismo fisiologico utilizzato per regolare e, se del caso, concludere una normale risposta immunitaria. Abatacept, bloccando il legame di CD80/86 a CD28 inibisce la trasmissione di un secondo segnale della risposta immunitaria, che indirettamente produce un segnale negativo sull’attivazione delle cellule T. Inoltre, abatacept ha probabilmente un effetto maggiore nel prevenire la formazione di un segnale costimolatorio nelle cellule T, inattivando quelle già attive, che non sono legate alla cellula T CTLA4
Farmaco di supporto all’uso
1. Perché abatacept è incluso nel gruppo dei farmaci immunomodulatori? Fondamentalmente, perché produce deplezione cellulare, specialmente di cellule T a causa dell’azione farmacologica esercitata non bloccando selettivamente una particolare citochina, evitando la soppressione radicale di vie essenziali per il corretto funzionamento della risposta immunitaria.8
2. Come impedisce il legame della regione Fc della molecola al suo recettore? La regione Fc di abatacept è geneticamente modificata, in modo che non si leghi ai recettori CD16 e CD32, e lo fa molto debolmente al recettore CD64. Questo disegno elude le risposte cellulari mediate dal recettore Fc come la citotossicità cellulare anticorpo-dipendente (ADCC) e la citotossicità dipendente dal complemento (CDC).18 Entrambi sono associati alla lisi cellulare, con potenziali effetti avversi che possono essere visti in trattamenti prolungati38. Pertanto, il frammento modificato di IgG1 sembra essere attivo, prevenendo così gli eventi avversi derivanti dalla ADCC.39
3. Effetto antinfiammatorio di abatacept. Abatacept riduce significativamente molti dei mediatori infiammatori nei pazienti con RA, riportandoli alla normalità, un fatto dimostrato in diversi studi clinici utilizzati durante la ricerca del farmaco.
In uno studio di fase II-b, di un anno, controllato con placebo, in pazienti con RA e risposta inadeguata a MTX, sono stati prelevati campioni e misurati i livelli sierici di marcatori selezionati nei giorni precedenti l’infusione per studiare l’effetto di abatacept sui mediatori e citochine proinfiammatorie. Un gruppo di pazienti ha ricevuto MTX e abatacept 10mg/kg, secondo un programma regolare. Il gruppo di controllo, nel frattempo, è stato trattato con MTX e placebo. Un anno dopo il trattamento, i marcatori nel gruppo abatacept 10mg/kg si erano normalizzati, mentre rimanevano elevati nel gruppo placebo (TNF: 7.4 vs 10.3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228.3. 1697.1pg/ml IL-6: 7.3 vs 19.9pg/ml).40
4. Immunogenicità. Secondo i dati sul farmaco, solo 187 di 3877 (4,8%) pazienti con RA trattati fino a 8 anni con abatacept hanno sviluppato anticorpi al farmaco durante il trattamento.41 Gli anticorpi ad abatacept sono stati valutati nei pazienti dopo l’interruzione del farmaco (>42 giorni dopo l’ultima dose), e in 103 di 1888 (5,5%) erano sieropositivi. Al contrario, in un altro studio di 2000 pazienti abatacept, anticorpi sono stati misurati ed è stato concluso che abatacept ha bassa immunogenicità.42,43
5. Abatacept e tubercolosi. TNF partecipa alla risposta infiammatoria e immunopatologia della tubercolosi (TB). Studi in vitro mostrano che TNF aumenta l’attività fagocitica e micobattericida macrofago, mentre in vivo sono stati coinvolti nella formazione iniziale e il successivo mantenimento dei granulomi, qualcosa che controlla la crescita dei micobatteri e limita la sua diffusione. In un modello cronico di riattivazione della TBC latente nei topi, abbiamo studiato l’evoluzione dell’infezione nei topi trattati con abatacept rispetto a un altro gruppo trattato con un monoclonale murino anti-TNF.42 4 mesi dopo aver infettato i topi C57BL/6 con Mycobacterium tuberculosis e, una volta confermato che avevano un’infezione latente di TBC, i topi sono stati trattati per 16 settimane con uno dei due interventi sperimentali. Dopo questo periodo, tutti i topi trattati con anti-TNF sono morti per TB disseminata con una sopravvivenza media di 44 giorni. Al contrario, nessuno dei topi trattati con abatacept è morto.
Mentre la concentrazione di IFN-g nel siero non cambiava nel gruppo abatacept, era elevata nei topi con anti-TNF. Questo aumento è stato attribuito alla maggiore infiltrazione di CD4+ e CD8+ causata dalla dispersione diffusa delle colonie batteriche.
Quindi, mentre i topi trattati con la terapia anti-TNF hanno mostrato il 100% di mortalità, abatacept non ha alterato la capacità dei topi di organizzare una risposta infiammatoria capace di controllare la diffusione della tubercolosi. Tuttavia, non c’è ancora abbastanza dati clinici per confermare questi risultati negli esseri umani.
6. Effetto antiriassorbente di abatacept sul rimodellamento osseo. L’attività degli osteoclasti è aumentata nell’AR, sia nell’articolazione, causando erosioni ossee, sia a livello sistemico, raggiungendo livelli associati all’osteoporosi generalizzata.44,45
In effetti, un aumento del recettore attivatore del fattore nucleare NF-kB (RANKL) è stato dimostrato nella membrana sinoviale.45,46 Abatacept inibisce in modo dose-dipendente la formazione degli osteoclasti murini e l’attività osteoclastogenica valutata in vitro. Questo è stato studiato in osteoclasti murini coltivati su piastre di dentina, che hanno misurato il numero di fosse di riassorbimento dopo 6 giorni di aggiunta di diverse dosi di abatacept.47
Il farmaco ha diminuito significativamente l’area di riassorbimento osseo. Questi dati suggeriscono che abatacept è una molecola che si lega direttamente alle cellule precursori degli osteoclasti, inibendo la loro differenziazione. Questo meccanismo potrebbe spiegare l’effetto anti-erosivo del farmaco nei pazienti con RA. Infatti, i pazienti trattati con abatacept hanno mostrato una tendenza alla diminuzione dei livelli di RANK e del suo ligando RANKL nella sinovia, il tutto associato ad un aumento dell’osteoprotegerina.48 Anche se il meccanismo esatto alla base di questa osservazione non è chiaro, questi risultati si correlano bene con il miglioramento radiologico osservato nei pazienti trattati con abatacept.
7. Effetti di abatacept in altre cellule immunitarie. Anche se l’APC è la cellula bersaglio che lega abatacept e i macrofagi esprimono anche i recettori CD80/86 sulla loro superficie, ci sono pochi studi che indagano l’azione del farmaco sull’attività di queste cellule. Infatti, un recente studio in vitro ha dimostrato che i macrofagi hanno esibito una marcata espressione del recettore CD80/86 e il trattamento con abatacept ha ridotto sostanzialmente la produzione di citochine49. Questi risultati suggeriscono che il meccanismo d’azione del farmaco potrebbe essere esteso alla regolazione del lineage dei macrofagi, cellule chiave nella patogenesi della malattia.
Abatacept sopprime anche la migrazione follicolare delle cellule T antigene-specifiche e, di conseguenza, la collaborazione tra cellule T e cellule B follicolari nel linfonodo. Questo risultato è stato osservato in situ nei linfonodi di topi BALB/c50. Dopo aver trasfuso tali topi con cellule T prestimolate specifiche per l’antigene, una successiva immunizzazione dei topi ha mostrato la proliferazione delle cellule T e la migrazione nella zona dei linfociti B. Nei topi trattati con abatacept, la proliferazione e la migrazione delle cellule T è stata bloccata, limitandone la presenza nella maggior parte dei casi nella paracorteccia linfonodale. Così, il trattamento prolungato con abatacept riduce la proliferazione, la mobilità e la distribuzione dei linfociti di memoria autoantigeni intragangliari, che potrebbe portare alla diminuzione degli autoanticorpi.
Conclusioni sul meccanismo d’azione di Abatacept
Abatacept è un costrutto proteico completamente umanizzato, costituito dal dominio extracellulare dell’antigene 4 associato ai linfociti T citotossici umani (CTL4) e da un frammento geneticamente modificato della regione Fc delle IgG1, progettato per interferire con la regolazione della costimolazione dei linfociti T Il farmaco inibisce l’attivazione delle cellule T bloccando selettivamente il legame specifico di CD80/CD86 al recettore CD28 e, quindi, inibendo la proliferazione delle cellule T e le risposte immunitarie dei linfociti B Questa azione farmacologica risulta in una diminuzione dei livelli di mediatori infiammatori nei pazienti con RA e in una risposta clinica sicura ed efficace
Conflitto di interessi
Il dottor Gabriel Herrero-Beaumont ha ricevuto sovvenzioni per la ricerca da Bristol-Myers-Squibb. Il Dr. Santos Castañeda ha ricevuto borse di studio e di ricerca da Abbott, MSD e Pfizer.