La forma dei tre orbitali 3p. Da sinistra a destra: 3py, 3pz e 3px. Per ognuno, le zone gialle sono dove le funzioni d’onda hanno valori positivi e le zone bianche denotano valori negativi.
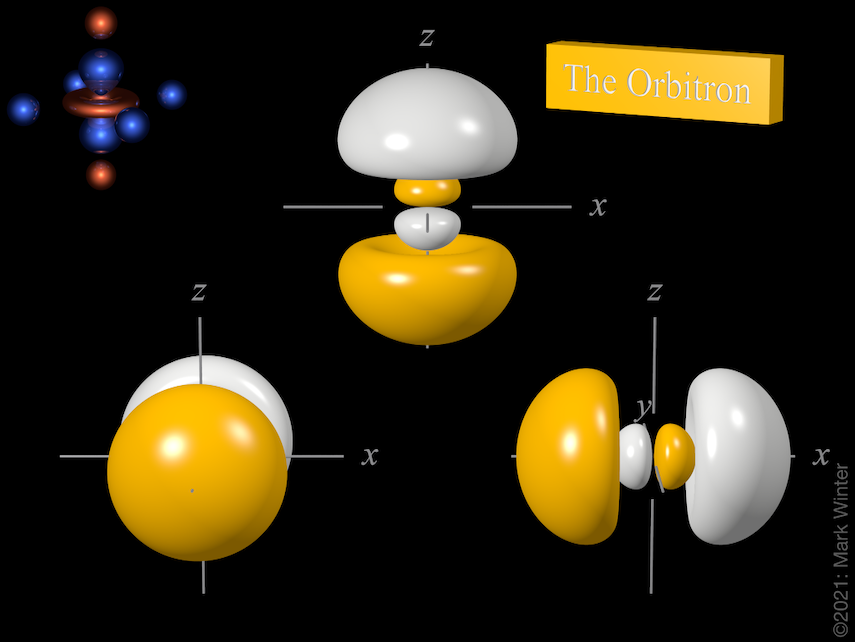
Le tre orbite 3p. Usa le icone precedente e successiva per vedere altre viste
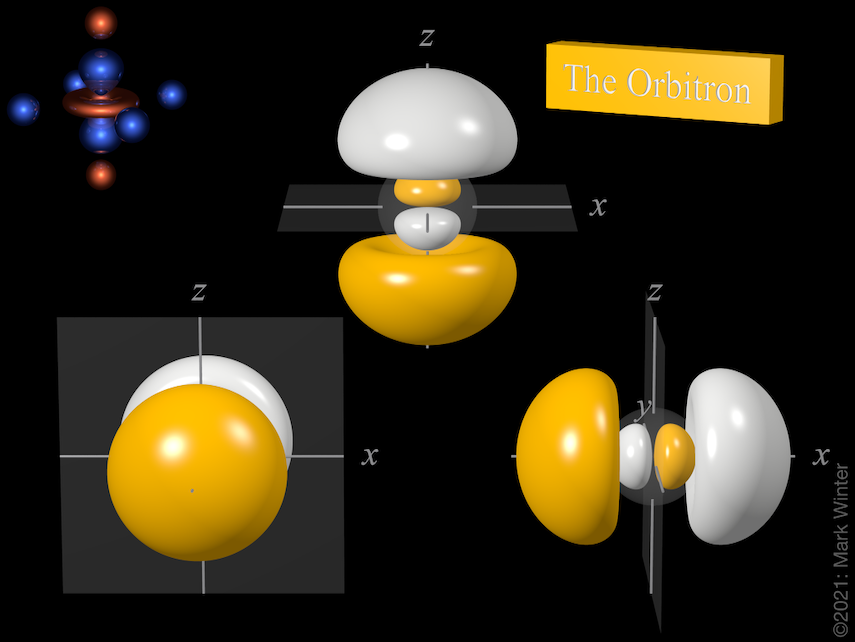
Le tre orbite 3p compresi i nodi orbitali. Usa le icone precedente e successiva per vedere altre viste
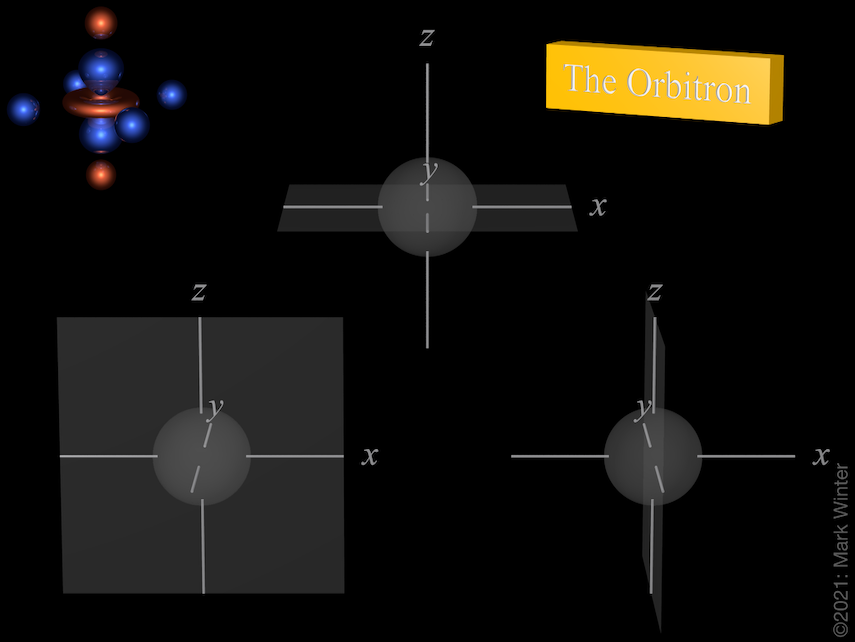
Nodi delle tre orbite 3p. Usa le icone precedente e successiva per vedere altre viste
precedente
Per ogni atomo, ci sono tre orbitali 3p. Questi orbitali hanno la stessa forma ma sono allineati diversamente nello spazio. I tre orbitali 3p normalmente usati sono etichettati 3px, 3py e 3pz poiché le funzioni sono “allineate” rispettivamente lungo gli assi x, y e z.
Ogni orbitale 3p ha quattro lobi. C’è un nodo planare normale all’asse dell’orbitale (così l’orbitale 3px ha un piano nodale yz, per esempio). Oltre al nodo planare c’è anche un nodo sferico che separa i piccoli lobi interni. Gli orbitali p superiori (4p, 5p, 6p e 7p) sono ancora più complessi poiché hanno più nodi sferici.
L’origine del nodo planare diventa chiaro quando si ispezionano le equazioni d’onda che, per esempio, includono un termine x nel caso dell’orbitale 4px. Quando x = 0, allora c’è un nodo, e questo per definizione è il piano yz.
L’origine del nodo sferico diventa chiaro quando si controllano le equazioni d’onda che, per esempio, includono (4 – ρ) termini. Quando (4 – ρ) = 0, allora c’è un nodo. Poiché per qualsiasi orbitale 3p ρ = 2Zr/3 (Z = carica nucleare effettiva, r = raggio in unità atomiche), allora i nodi sono al raggio per cui (4 – 2Zr/3) = 0, cioè r = 6/Z unità atomiche.
The OrbitronTM, una galleria di orbitali sul WWW: https://winter.group.shef.ac.uk/orbitron/