| Ed Davis, Ph.D. |
Introduzione
Lentivirus e Adeno-associated virus (AAV) si sono dimostrati preziosi per introdurre materiale genetico in cellule di mammiferi, sia in coltura che in animali interi. Entrambi i sistemi sono molto adatti a molte applicazioni di ricerca di base, come la sovraespressione di proteine, la produzione di anticorpi e il knockout genico, ed entrambi sono promettenti per la terapia genica. Tuttavia, ogni sistema virale ha i suoi vantaggi e svantaggi unici, a seconda dell’applicazione. GeneCopoeia offre ampie linee di prodotti sia per lentivirus che per AAV, fornendoti opzioni potenti e flessibili per la consegna del DNA nelle cellule. In questa nota tecnica, descriviamo le tecnologie alla base delle linee di prodotti Lentifect™ lentivirus e AAVPrime™ AAV di GeneCopoeia, e discutiamo i meriti di ciascuna tecnologia per varie applicazioni, al fine di aiutarvi a scegliere il sistema più adatto alle vostre esigenze.
Perché usare i virus per la consegna del DNA?
Uno dei modi più comuni per consegnare il DNA alle cellule è attraverso la trasfezione basata sui plasmidi, in cui le cellule sono trattate con composti chimici come il fosfato di calcio, o con reagenti a base lipidica. Tuttavia, la trasfezione plasmidica non è sempre auspicabile o pratica. Per esempio, alcune cellule sono molto difficili o impossibili da trasfettare, mentre la maggior parte delle cellule coltivate supportano l’infezione (nota anche come trasduzione) da lentivirus o AAV. In secondo luogo, la trasfezione plasmidica non può essere usata per la consegna del DNA in vivo, ma la trasduzione virale sì. Sia i lentivirus che gli AAV possono essere usati per una moltitudine di applicazioni, come l’espressione proteica da cornici di lettura aperte (ORF), l’abbattimento genico tramite interferenza RNA (RNAi) mediato da RNA a spirale corta (shRNA), luciferasi e altri saggi di geni reporter, e l’abbattimento genico mediato dal sistema clustered, regularly-interspaced, short palindromic repeats-Cas9 (CRISPR-Cas9). Molte di queste applicazioni per i vettori virali sono state eseguite con successo in linee cellulari di mammiferi immortalizzati in coltura, in colture cellulari primarie, in modelli animali e nella terapia genica su pazienti umani.
Il termine “Lentivirus” si riferisce alla classe di retrovirus che comprende il virus dell’immunodeficienza umana (HIV), e, infatti, la maggior parte dei sistemi lentivirali attualmente in uso sono derivati dall’HIV (rivisto in Mátrai, et al, 2010; Sakuma, et al., 2012). I lentivirus che trasportano transgeni si integrano nel genoma al momento dell’infezione, e quindi permettono un’espressione stabile sia nelle cellule in divisione che in quelle non in divisione.
I sistemi lentivirali sono stati altamente modificati dall’HIV nel corso di diverse generazioni per renderli sicuri da gestire e utili per le applicazioni. GeneCopoeia usa il sistema lentivirale di terza generazione (Dull, et al. 1998), che richiede quattro plasmidi separati per produrre particelle virali infettive (virioni). Un plasmide lentivirale GeneCopoeia porta solo il gene di interesse (GOI) da esprimere, un gene di selezione antibiotica, e le sequenze di segnale di confezionamento. A volte il clone includerà anche un gene reporter fluorescente. Il plasmide contenente il GOI, con il marcatore selezionabile e il gene reporter, può ospitare inserti fino a circa 5-6 kb. (Figura 1), anche se i titoli virali calano drasticamente quando le dimensioni dell’inserto superano i 4 kb.
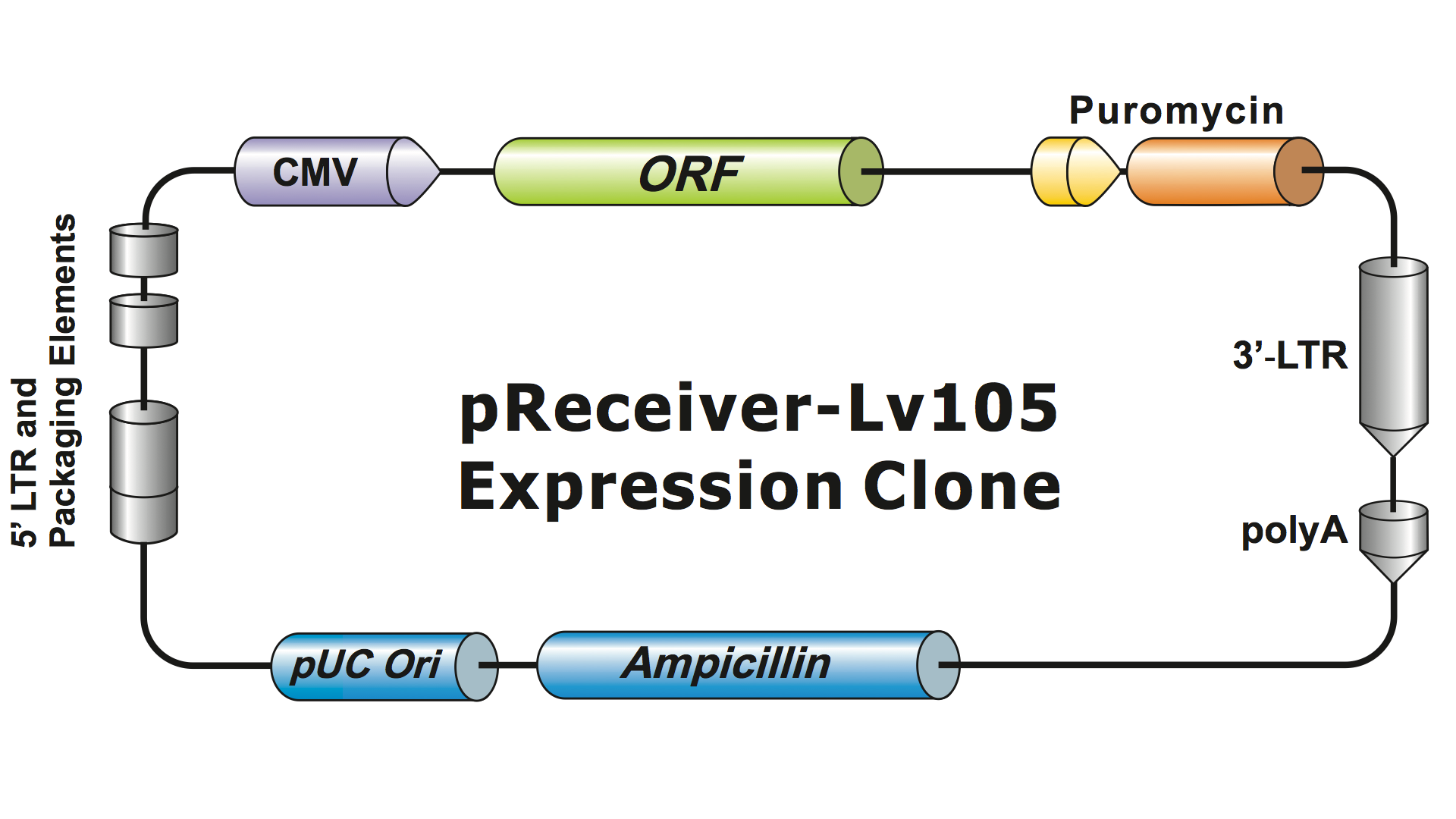 |
Figura 1. Esempio di un clone di espressione lentivirale di GeneCopoeia |
I plasmidi aggiuntivi esprimono gli elementi retrovirali necessari per il packaging e l’integrazione (gag, pol, env, Rev). Quando tutti e quattro i plasmidi sono espressi in cellule di confezionamento, l’RNA GOI è incorporato nelle particelle. Poiché le proteine retrovirali sono espresse solo durante il confezionamento, le cellule infettate non possono produrre virus infettivo. Inoltre, le particelle lentivirali Lentifect™ di GeneCopoeia contengono una delezione nella regione U3 delle LTR, che le rende auto-inattivanti (SIN). La delezione SIN impedisce la replicazione lentivirale nel raro caso in cui tutti e quattro i plasmidi si ricombinino per creare un unico plasmide virale attivo. Di conseguenza, le particelle lentivirali sono sicure da maneggiare, senza praticamente alcuna possibilità di generare virus patogeni.
In aggiunta alle modifiche di sicurezza migliorate, le particelle lentivirali Lentifect™ di GeneCopoeia portano la glicoproteina del virus G della stomatite vescicolare (VSV-G) al posto del gene env selvaggio dell’HIV, che cambia il tropismo del tessuto del virus dalle cellule T CD4+ a qualsiasi tipo di cellula di mammifero. Come tale, i lentivirus sono un sistema ampiamente utilizzato per la coltura di cellule di mammiferi, modelli animali e applicazioni di terapia genica.
Perché i vettori lentivirali sono stati modificati in questi modi, i sistemi lentivirali Lentifect™ di GeneCopoeia hanno una maggiore sicurezza e hanno le seguenti caratteristiche che li rendono molto utili per la consegna del DNA:
- Infettano quasi tutti i tipi di cellule di mammiferi
- Possono essere usati per trasportare sequenze di DNA relativamente grandi, fino a circa 5-6 kb di lunghezza
- Possono essere usati per generare linee cellulari stabili o per guidare l’espressione genica stabile in organi e tessuti in vivo, grazie all’integrazione del transgene in punti casuali del genoma
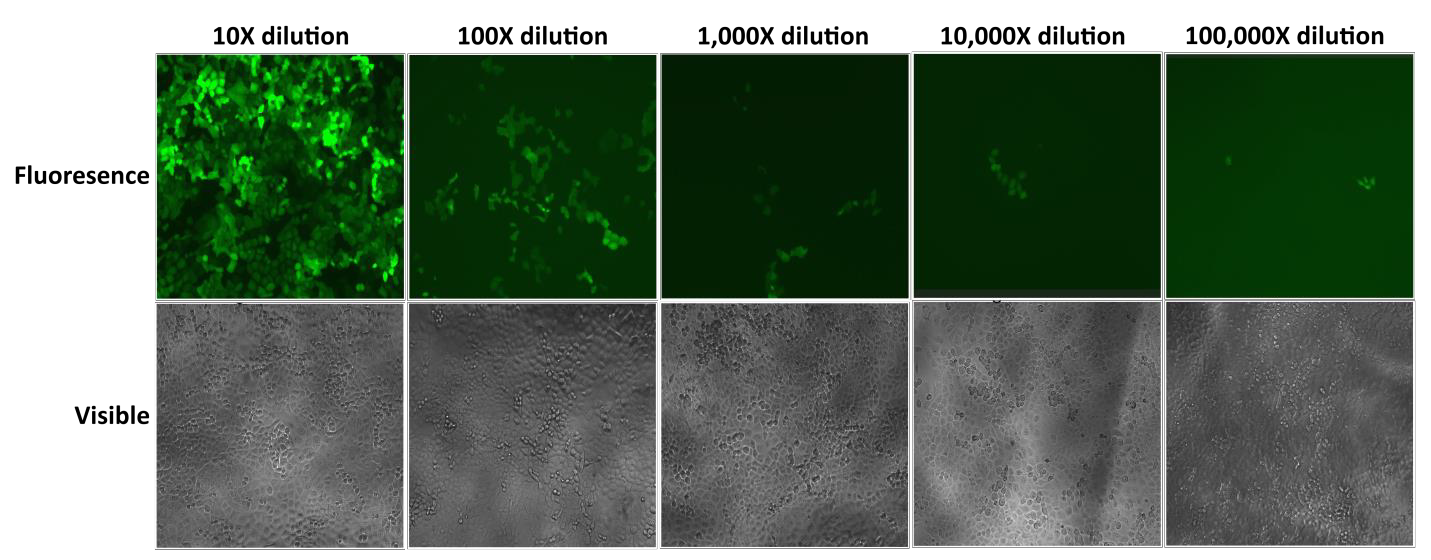
Le particelle lentivirali Lentifect™ di GeneCopoeia forniscono titoli elevati, permettendo ai ricercatori di esprimere efficacemente i geni di interesse (Figura 2).
|
Figura 2. Test di diluizioni seriali di particelle lentivirali Lentifect™. La fluorescenza eGFP è stata fotografata con un microscopio a fluorescenza 72 ore dopo la trasduzione. |
|
GeneCopoeia offre una delle linee di prodotti lentivirali più ampie del settore (Tabella 1).
| Prodotto/servizio | Descrizione |
| Cloni lentivirali e vettori di clonazione | Cloni pre-fatti e personalizzati che portano ORF, promotori, shRNA, miRNA 3′ UTR, precursori e inibitori, sgRNA e altro. Disponibile con più promotori, tag e reporter. Vettori per il clonaggio fai-da-te di sequenze di interesse. |
| Particelle lentivirali Lentifect™ | Particelle lentivirali preconfezionate e personalizzate, pronte all’uso. Prodotte dalle ampie collezioni di cloni di GeneCopoeia o dai cloni inviati dal cliente. |
| Ragenti per il confezionamento lentivirale Lenti-Pac™ | Sistema completo di reagenti per la produzione di particelle lentivirali fai-da-te. Include plasmidi di imballaggio, linea cellulare di imballaggio, soluzione di concentrazione delle particelle e kit di titolazione. |
Tabella 1. La linea di prodotti e servizi lentivirali di GeneCopoeia.
Sistemi basati su AAV
A differenza del genoma RNA dei lentivirus, AAV ha un genoma a singolo filamento di DNA (Samulski e Muzyczka, 2014). Inoltre, AAV non deriva da un patogeno; piuttosto è un contaminante dell’adenovirus, senza condizioni patogene attribuitegli. L’AAV naturale si integra nel genoma come i lentivirus, ma solo nel locus AAVS1 sul cromosoma 19. Questo sito è anche conosciuto come “Safe Harbor”, perché è comunemente usato per l’inserimento di transgeni senza danneggiare le cellule (DeKelver, et al., 2010).
Come i lentivirus, AAV è stato modificato per la sicurezza e l’usabilità. AAV richiede la co-infezione con un virus helper. Il genoma AAV è lungo 4,7 kb e contiene 2 geni, Rep e Cap, che sono necessari per la replicazione e l’integrazione virale. In AAVPrime™, Rep e Cap sono eliminati, lasciando solo i 145 bp 5′ e 3′ di ripetizioni terminali invertite (ITRs). L’eliminazione di Rep e Cap ha tre scopi: 1) Elimina la capacità di un virus helper di permettere alle cellule infettate da AAV di produrre nuovi virioni AAV; 2) Permette l’inserimento di geni lunghi fino a circa 4 kb (anche se il titolo virale diminuisce con transgeni più lunghi di 3 kb); e 3) Elimina virtualmente la capacità di integrazione di AAV. La piccola dimensione di AAV presenta delle sfide per alcune applicazioni. Per esempio, per l’editing del genoma CRISPR, i ricercatori usano la nucleasi Cas9 da S. aureus, perché è circa il 30% più corta della più comunemente usata S. pyogenes Cas9 (Ran, et al, 2015).
Per il confezionamento, Rep e Cap sono stati spostati su un plasmide diverso, e i geni helper dell’Adenovirus sono posti su un terzo plasmide, rendendo l’intero sistema di confezionamento sicuro e privo di virus helper (Figura 3).
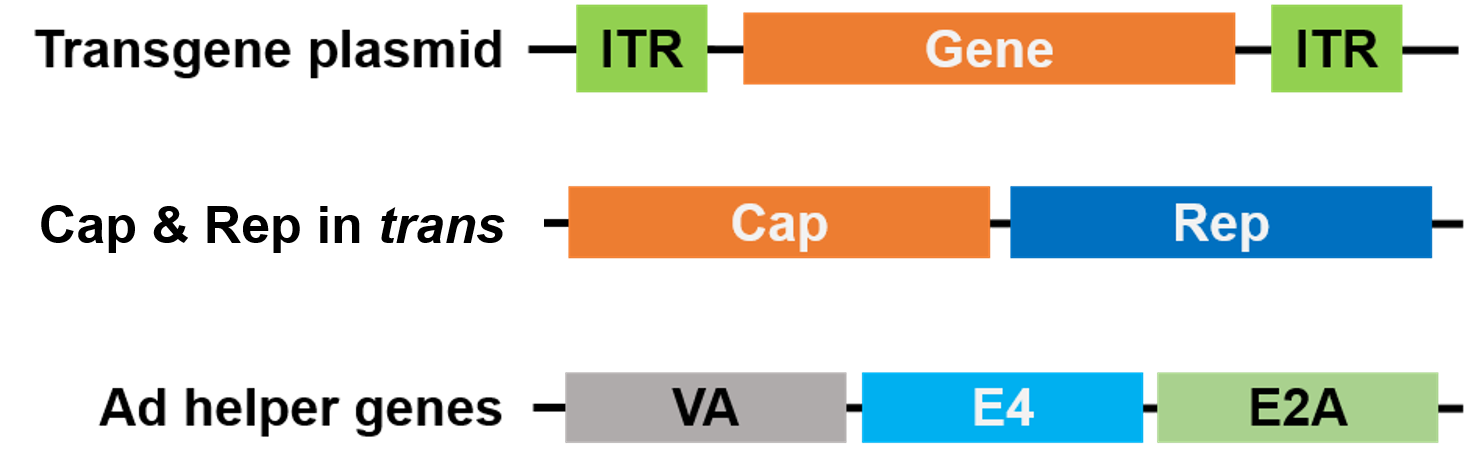 |
Figura 3. Helper virus senza AAV. 3 plasmidi sono usati per il confezionamento. Il plasmide del gene di interesse (in alto) contiene le ripetizioni terminali invertite (ITR). Un secondo plasmide (al centro) porta i geni AAV Cap e Rep, e il terzo plasmide (in basso) porta i geni richiesti da Adenovirus (Ad) |
Inoltre, AAV esiste in diversi sierotipi, che influenzano la specificità del tessuto di infezione AAV. I sierotipi multipli permettono ai ricercatori di a) infettare una vasta gamma di cellule ospiti; o b) limitare l’infezione a uno o pochi tessuti. Le particelle AAV AAVPrime™ di GeneCopoeia sono disponibili in sierotipi multipli (Tabella 2).
| Serotipo | Tessuto bersaglio primario | Descrizione |
| AAV-1 | Muscolo | Migliore per muscolo cardiaco, muscolo scheletrico, tessuto neuronale e gliale. |
| AAV-2 | Muscolo, fegato, retina | Serotipo più comunemente usato. Migliore per neuroni, muscoli, fegato e cervello. |
| AAV-3 | Megacariociti | Migliore per megacariociti, muscoli, fegato, polmoni e retina. |
| AAV-4 | Retina | Migliore per neuroni, muscoli, cervello e retina. |
| AAV-5 | Polmone | Migliore per polmoni, neuroni, articolazione sinoviale, retina e pancreas. |
| AAV-6 | Muscolo, Polmone | Migliore per polmoni, fegato e cuore. |
| AAV-7 | Muscolo, Retina, Neuroni | Migliore per muscoli, neuroni e fegato. |
| AAV-8 | Fegato | Migliore per muscoli, cervello, fegato e retina. |
| AAV-9 | Vari | Migliore per muscoli, cuore, fegato, polmone e cervello. |
| AAV-10 | Pleura, CNS | Clonato da Cynomolgus, quasi identico a AAVrh10 tranne per 12 aminoacidi in VP1. Migliore per polmone, muscolo, cuore, NCS e fegato. |
| AAV-DJ | Vario | Una miscela di 8 sierotipi presenti in natura. Trasduce efficacemente un’ampia varietà di tipi di cellule in vitro. |
| AAV-DJ/8 | Vari | Una variante di AAV-DJ con una mutazione del dominio di legame dell’eparina (HBD), che permette l’infezione del fegato e di altri tessuti in vivo. |
Tabella 2. Elenco dei sierotipi AAV ampiamente utilizzati
Le particelle AAV AAAVPrime™ hanno le seguenti caratteristiche che le rendono altamente utili per la consegna del DNA:
- Titoli elevati. Il titolo delle particelle purificate può essere fino a 10^14 GC/ml (copie del genoma/ml)
- Versatile. I sierotipi multipli permettono l’uso in una gamma ampia o limitata di cellule ospiti
- Bassa tossicità. Non si integra nel genoma dell’ospite.
- Bassa immunogenicità. Risposta immunitaria minima dell’ospite.
- Sicuro. Non associato ad alcuna malattia umana
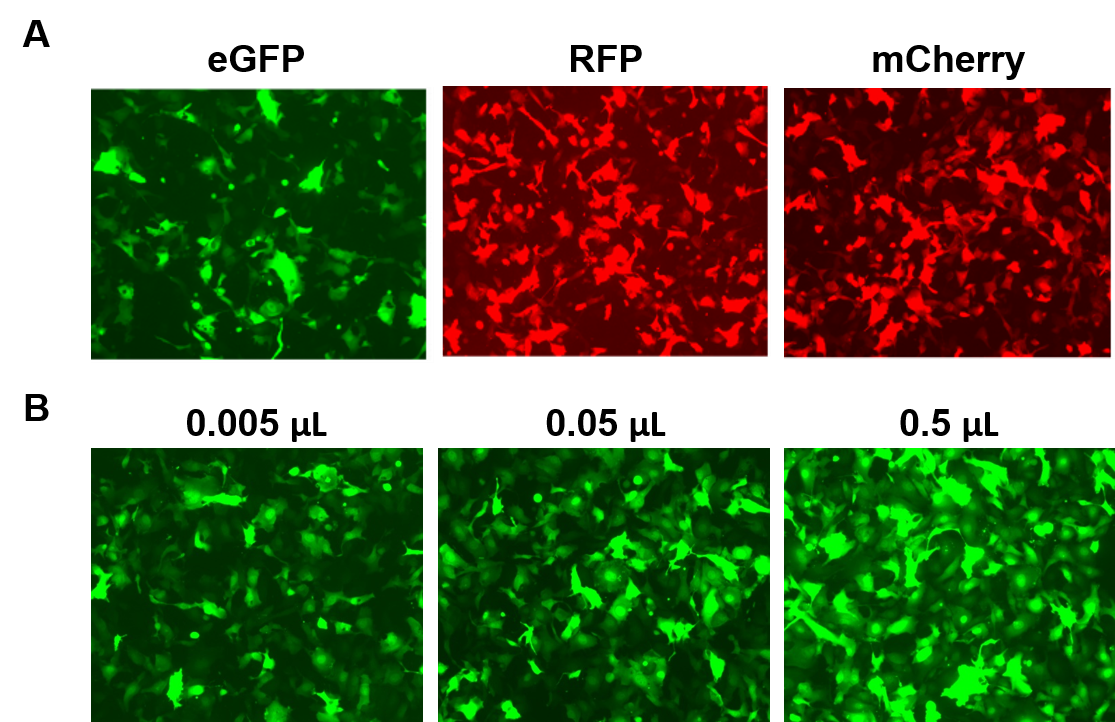
Le particelle AAAVPrime™ sono disponibili per ORF umane e murine fino a 3 kb, in sierotipi multipli e opzioni di promotore, in purezza standard (solo per uso in vitro) o purificate (per uso in vivo). I clienti possono ordinare cloni plasmidici, particelle generate su misura per i geni di interesse, o scegliere tra opzioni pre-fatte che esprimono geni come i reporter fluorescenti (Figura 4).
|
Figura 4. Prestazioni delle particelle AAVPrime™ di GeneCopoeia. A. Cellule HT1080 in piastre da 24 pozzetti trasdotte con 0,5 µL di AAV di purezza standard che esprimono GFP potenziata (eGFP), proteina fluorescente rossa (RFP) e Cherry monomerica (mCherry). B. Le cellule HT1080 in piastre da 24 pozzetti sono state trasdotte con quantità variabili di AAV purificati che esprimono eGFP. Le cellule sono state visualizzate con un microscopio a fluorescenza (tempo di esposizione: 400 ms). |
|
Che dovrei scegliere: Lentivirus o AAV?
Scegliere tra lentivirus e AAV dipende da molti fattori. Per esempio, il fatto che i lentivirus si integrino nel genoma può essere sia un vantaggio che uno svantaggio, a seconda delle tue esigenze. Fate riferimento alla tabella qui sotto per aiutarvi a decidere:
| Integrazione più grande | Integrazione stabile | No integrazione | Specificità cellulare/tessutale | sicurezza in vivo | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Per saperne di più sui sistemi virali di GeneCopoeia e per ordinare, visitate il nostro sito web (https://www.genecopoeia.com/product/lentiviral-system/)
Conclusioni
A GeneCopoeia, ci sforziamo di fornirvi la più alta qualità, la tecnologia più avanzata nei prodotti per la genomica funzionale e la biologia cellulare. Offriamo un’ampia gamma di prodotti, dai set di cloni di DNA plasmidico per ORF, promotori di geni, miRNA, shRNA e CRISPR, a potenti kit e reagenti, a prodotti per sonde fluorescenti di struttura cellulare, quantificazione di acidi nucleici e anticorpi marcati. Per saperne di più, visitate il nostro sito web, www.genecopoeia.com, o contattateci a [email protected].
DeKelver, et al. (2010). Genomica funzionale, proteomica, e l’analisi del DNA di regolamentazione in impostazioni isogeniche utilizzando transgenesi guidata da nucleasi zinc finger in un locus safe harbor nel genoma umano. Genome Res 20, 1133.
Dull, et al. (1998). Un vettore Lentivirus di terza generazione con un sistema di imballaggio condizionato. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo genoma editing utilizzando Staphylococcus aureus Cas9. Natura 526, 186.
Sakuma, et al. (2012). Vettori lentivirali: da base a traslazionale. Biochem. J. 443, 603.
Samulski e Muzyczka (2014). AAV-Mediated Gene Therapy for Research and Therapeutic Purposes. Annu. Rev. Virol. 1, 427.