Introduzione
La chiusura primaria della parete addominale dopo un trapianto d’organo isolato di piccolo intestino o multiviscerale rimane una delle sfide più importanti da risolvere in questo settore. La grande maggioranza di questi pazienti presenta complicazioni di chiusura della parete, che possono essere attribuite alla distensione intestinale dovuta alla sindrome da ischemia-riperfusione, all’edema intestinale associato e all’anelasticità della cavità addominale, che è generalmente ridotta di volume dopo una storia di operazioni multiple e infezioni associate, posizionamento dello stoma e un’alta incidenza di fistole precedenti.1,2 Queste circostanze aumentano il rischio di sindrome compartimentale, che può portare a ischemia o necrosi del graft.3 Di conseguenza, circa il 20%-50% dei riceventi di questo tipo di innesto richiederà una tecnica chirurgica alternativa alla chiusura convenzionale della parete addominale primaria.4-6 In generale, data la perdita di struttura della parete in questi riceventi, essi sono considerati cattivi candidati per la chirurgia ricostruttiva, come la separazione di componenti o lembi muscolocutanei.
Questo può essere risolto o trattato sia riducendo la dimensione dell’innesto, sia ampliando la capacità del ricevente. La tendenza generale a scegliere donatori con pesi inferiori, con un rapporto tra 1,1 e 0,757 o anche a ridurre le dimensioni degli innesti8,9 facilita la chiusura senza tensione in molti casi.1 Le tecniche di chiusura a parete che utilizzano reti convenzionali (assorbibili o meno) o reti biologiche10 hanno presentato risultati deludenti, probabilmente a causa di una combinazione di tensione nella chiusura e degli effetti di alte dosi di farmaci immunosoppressori. L’uso della chiusura addominale a stadi, sostenuta dal gruppo di Birmingham con 23 casi che combinano protesi di nylon sintetico (Silastic@) e terapia a pressione negativa, potrebbe essere un’alternativa.11 La chiusura cutanea isolata è talvolta possibile, nonostante lo strato muscolare inferiore non presenti la stessa elasticità. Sono stati proposti anche interventi con una serie di operazioni mediante espansori, che non sembrano molto raccomandabili a causa dell’alto tasso di complicanze (infezione, ernia, fistola, sieroma/ematoma, ostruzione intestinale, estrusione della mesh, ecc.).12,13
L’uso del trapianto totale o parziale della parete addominale dallo stesso donatore dell’innesto intestinale o multiviscerale, sviluppato da Levi et al. dal 2003,3 può essere un’alternativa interessante in questo contesto poiché presenta evidenti vantaggi in termini di ottenimento di una chiusura senza tensione con un innesto in normoposizione e ben vascolarizzato, evitando le complicazioni infettive del mesh che possono portare al rigetto (presentazione come eruzione maculopapulare),14 il tutto realizzato in un unico intervento.2 Le esperienze iniziali di 15 e 17 pazienti hanno mostrato buoni risultati.2,15
Stato attuale dei trapianti di parete addominale nel trapianto di organiTrapianto a spessore parzialeFascia non vascolarizzata
Ci sono due tecniche di estrazione di base descritte in letteratura:
- –
Tecnica Miami3: consiste nella rimozione completa della parete addominale come se fosse un innesto completo, in blocco, per poi separare la lamina anteriore dalla fascia del retto.
- –
Tecnica Mount-Sinai/Favaloro16: si effettua un’incisione trasversale nel tessuto sottocutaneo e nella pelle, resecando in blocco la lamina anteriore della fascia del retto anteriore attraverso un’incisione sottocostale bilaterale con peritoneo.
In entrambi i casi, l’innesto diventa indipendente dal resto del lembo alla fine dell’estrazione, dopo la perfusione, che non è sincrona al resto degli organi estratti. L’innesto viene posto nella soluzione di conservazione, e il tessuto e il muscolo in eccesso vengono rimossi sul banco.
Nel nostro ospedale, entrambe le arterie iliache esterne del donatore vengono incannulate, e il lembo completo dell’innesto viene perfuso; successivamente, viene condotta una tecnica di estrazione molto simile al metodo Miami. L’obiettivo è quello di ottenere un innesto completo dal donatore (Fig. 1) per decidere in seguito il tipo di innesto e la chiusura della parete richiesti dal ricevente (a seconda degli esami di imaging preoperatorio, soprattutto la tomografia computerizzata volumetrica, che deve essere confermata dallo stato dei tessuti al momento dell’impianto).
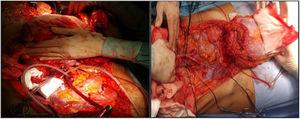
Cannulazione delle arterie iliache esterne (non è necessario cannulare le vene) e preparazione dell’innesto per l’estrazione.
Anche se la maggior parte delle serie esegue la perfusione dell’innesto a parete con la soluzione di conservazione Wisconsin, nel nostro ospedale riteniamo che l’uso della soluzione Celsior sia superiore grazie alla sua minore viscosità, sebbene non vi siano sufficienti prove in letteratura a questo proposito.17
Successivamente, sul banco, si decide il tipo di innesto in base alle esigenze del ricevente e si rimuove il tessuto non necessario (Fig. 2). Nel caso della fascia non vascolarizzata, l’escissione del tessuto grasso e muscolare è importante perché, senza supporto circolatorio, sarebbe molto suscettibile di sviluppare necrosi e diventare una fonte di infezione.
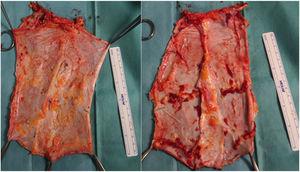
Esempi di innesti di fascia non vascolarizzata.
Fascia vascolarizzata
Questo è indicato nei casi di impianti di fegato isolati e quelli combinati con trapianti intestinali. L’estrazione del fegato verrebbe eseguita in associazione con il legamento falciforme e la lamina posteriore della guaina del retto, che manterrebbe un certo grado di flusso dall’arteria del legamento falciforme (di solito dal fegato sinistro) e il drenaggio attraverso la vena ombelicale, con una parziale vascolarizzazione del peritoneo e della lamina posteriore della guaina del retto (Fig. 3). L’arteria del legamento falciforme appare nel 67% delle autopsie, anche se solo nel 2%-24% delle angiografie.18 Sembra un’opzione molto interessante nei donatori e riceventi pediatrici, poiché negli adulti è obliterata. Apparentemente, questo innesto ha una maggiore resistenza alle infezioni rispetto alla fascia non vascolarizzata e una maggiore integrazione con il tessuto circostante. Il gruppo di Chicago19 ha dovuto accedere alla cavità di un ricevente fino a 3 volte, osservando una buona vitalità della lamina (nonostante ciò, il paziente morì 51 giorni dopo a causa di un’infezione fungina). Nei casi della Duke University,20 è stata utilizzata come una sorta di rete di rinforzo per la chiusura, senza complicazioni apparenti in entrambi i casi (Tabella 1).
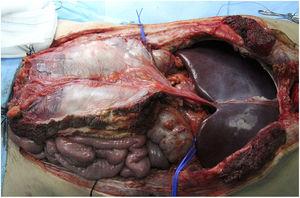
Esempio di estrazione di fascia vascolarizzata nel nostro ospedale; alla fine, il suo uso non è stato necessario.
Esperienza internazionale con trapianto di parete addominale.
| Ospedale | Tipo di anastomosi vascolare | N di casi | Complicazioni |
|---|---|---|---|
| Tx intero spessore della parete | |||
| Miami4 (2003) | Macrovascolare iliaca-iliaco | 12 (6 IT; 4 MOT; 2 MMOT) | Trombosi (2)Chiusura secondaria (2)Infezioni (7) |
| Oxford2 (2008-2014) | Microvascolare epigastrico-iliaco | 17 casi (12 IT; 5 MMOT) | Infezioni (6)GVHD (2)Rigetto acuto (5) |
| Bolonia21 (2005) | Microvascolare epigastrico-iliaco | 3 casi (3 IT) | Sindrome linfoproliferativa (1) |
| Chennai (Vayda et al. Risultati non pubblicati) (2015) | Microvascolare epigastrico-iliaca | 1 caso (1 IT) | |
| Indiana (Viana et al. Risultati non pubblicati) (2013) | Macrovascolare iliaco-iliaca | 1 caso (1 IT) | |
| Groningen23 (2016) | Microvascolare epigastrica-iliaco | 1 caso (1 IT) | |
| Tx fascia vascolarizzata | |||
| Oxford2 (2007) | 1 caso (1 IT) | ||
| Chicago19 (2010) | 5 casi (1 LKT, 4 TH) | Sepsi (1)Chiusura secondaria (2) | |
| Universidad Duke20 (2012) | 2 casi (2 MOT) | ||
| Tx nonfascia vascolarizzata | |||
| Miami24 (2009) | 13 casi (6 MOT, 4 TH, 2 MMOT, 1 LIT) | Infezioni (7)Ritiro (2) | |
| Oxford2 (2007) | 1 caso (1 IT) | ||
| Argentina16 (2007) | 19 casi (13 IT, 4 MOT, 2 LIT) | Perdite di trapianto (3)Infezione (7/17) | |
| Mount Sinai24 (2009) | 1 caso (IT) | Sepsi (1) | |
| Berlín25 (2012) | 5 casi (5 MOT) associati VAC | ||
| Hospital 12 de Octubre (2018) | 2 casi (1 IT, 1 MOT) | Sepsi (1) | |
GVHD: graft-versus-host disease; LT: trapianto di fegato; LIT: trapianto di fegato e intestino; LKT: trapianto di fegato e rene; IT: trapianto intestinale; MOT: trapianto multiorgano; MMOT: trapianto multiorgano modificato; Tx: trapianto.
Trapianto di parete addominale a tutto spessore
Questa sembra l’alternativa più fisiologica da una prospettiva anatomica. Storicamente, è il primo tipo di trapianto di parete che è stato realizzato, il che è sorprendente, dato che è la tecnica più complessa, sia per l’estrazione che per l’impianto. L’estrazione avviene in 2 fasi, all’inizio e alla fine dell’estrazione di più organi. All’inizio dell’estrazione, si fa un’incisione del lembo a tutto spessore “a domicilio”, lasciando il lembo muscolocutaneo mobilizzato e collegato al donatore dai vasi epigastrici inferiori. Una volta effettuata l’estrazione di più organi, l’aorta viene incannulata e l’innesto di parete viene perfuso prima dell’estrazione e del posizionamento in ghiaccio con soluzione di conservazione (Fig. 4). Nel nostro ospedale, l’incannulamento selettivo di entrambe le arterie iliache esterne è preferito (legatura distale al canale inguinale-arteria femorale-e nell’origine dell’arteria iliaca esterna) e indipendente dal processo di perfusione del resto degli organi da estrarre.
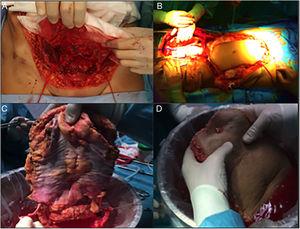
Fasi dell’estrazione completa dell’innesto: (A) Dissezione dei vasi epigastrici inferiori; (B) Preparazione delle cannule con il lembo “a casa”; (C) Dissezione al banco dell’arcata vascolare epigastrica inferiore; (D) Conferma della perfusione.
È la soluzione per i pazienti che non hanno la parete addominale e nemmeno la pelle per la chiusura. Si eviterebbe quindi la necessità di ridurre l’innesto o di limitare il pool di donatori in termini di rapporto peso innesto-ricevente di 0,75. Dato il peso dei riceventi adulti nel nostro ambiente, la concorrenza per i donatori pediatrici è comune, quindi la capacità di espandere la gamma di peso garantisce una maggiore ampiezza e qualità degli organi disponibili.
La ricostruzione dell’innesto di parete viene eseguita in diversi modi, a seconda della struttura vascolare e anatomica della parete ricevente. Di solito si usa un’anastomosi tra un lembo dell’arteria iliaca esterna e l’arteria epigastrica inferiore del donatore con la biforcazione delle arterie iliache del ricevente a causa del suo diametro maggiore. Il gruppo Bolonia22 utilizza un’anastomosi diretta tra i vasi epigastrici inferiori del donatore e del ricevente, tranne in uno dei 3 casi in cui è stata utilizzata l’arteria iliaca circonflessa superficiale a causa di una lesione dell’arteria epigastrica inferiore del ricevente.
È stata proposta la possibile individuazione del rigetto intestinale o multiviscerale dell’organo attraverso biopsie di parete, anche se queste potrebbero non essere così sensibili o specifiche come le biopsie intestinali (nel caso di Bolonia non fu rilevato alcun rigetto, anche se esisteva nell’intestino); tuttavia, potrebbero avere un grande valore di ricerca.22
La nostra esperienza
Presentiamo i casi di 2 pazienti in cui era impossibile eseguire una chiusura primaria della parete addominale o un intervento di riparazione a causa di diversi interventi chirurgici prima del trapianto.
Caso 1
La paziente è una donna di 50 anni che era stata inviata al nostro ospedale a causa della sindrome dell’intestino corto secondaria a resezioni multiple (6 interventi) per ischemia mesenterica. Dopo 3 anni come candidato per il trapianto intestinale e a causa della nutrizione parenterale, ha sviluppato una malattia epatica cronica e una funzione renale in declino, rendendola un candidato per il trapianto multiviscerale. La paziente presentava un difetto molto significativo della parete addominale che misurava 10 cm di diametro trasversale×15 cm di lunghezza, con la conseguente diminuzione delle dimensioni addominali.
Un trapianto multiorgano è stato eseguito seguendo la tecnica standard. Al momento della chiusura della parete, il difetto della parete addominale era insormontabile, associato a una significativa pelle ridondante, che prevedeva la chiusura con la lamina anteriore non vascolarizzata della fascia del retto del donatore, senza richiedere l’innesto addominale completo. La paziente ha presentato complicazioni infettive multiple che l’hanno portata alla morte (polmonite e raccolte addominali), senza alcun rapporto apparente con la parete addominale sugli esami di imaging eseguiti o sull’autopsia. Nessuna operazione addominale è stata necessaria dopo il trapianto.
Caso 2
Una donna di 60 anni è stata inviata al nostro ospedale a causa di un tumore desmoide con infiltrazione della parete addominale. Era stata sottoposta a 2 laparotomie precedenti che hanno confermato l’irriproducibilità a causa del coinvolgimento esteso dell’arteria mesenterica superiore. Due anni dopo essere stato inserito in lista d’attesa, è stato eseguito un trapianto di intestino isolato secondo la tecnica standard. Al momento della chiusura, e a causa della sindrome post-riperfusione dell’innesto, il difetto della parete addominale era impossibile da chiudere (difetto di 16cm di lunghezza×20cm di larghezza). È stato effettuato un trapianto non vascolarizzato della lamina anteriore della guaina del retto, che ha permesso la chiusura primaria della pelle (Fig. 5). Il periodo postoperatorio è stato tranquillo, tranne un episodio di lieve rigetto, che ha richiesto l’aggiunta di everolimus al regime immunosoppressivo con corticosteroidi e tacrolimus. Alla TAC di follow-up, è stata osservata un’eccellente integrazione del lembo di fascia (TAC normale, senza alcun difetto o rigonfiamento della parete) senza raccolte o segni di infezione.
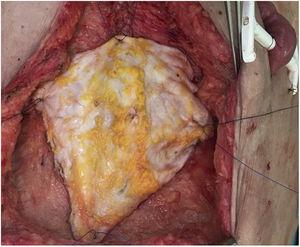
Posizionamento definitivo dell’innesto di fascia non vascolarizzata.
Discussione
Il trapianto di parete addominale si è consolidato come una valida alternativa per la chiusura della parete nei pazienti che ricevono un altro trapianto di organo addominale. Fino al 40% dei casi, la chiusura della parete addominale complicherà il trapianto multiviscerale o intestinale, per cui questo problema deve essere risolto.26 I risultati a lungo termine, soprattutto per gli innesti vascolarizzati, prevedono un buon futuro, al punto di aver dimostrato la piloerezione e un certo grado di contrazione dei muscoli autonomi in alcuni innesti.27
La scelta di un tipo di innesto o un altro si basa sulla necessità di riparare la parete addominale del ricevente. A seconda delle dimensioni del difetto, si dà la priorità all’uso dell’innesto che complica meno l’impianto. In molti casi, il difetto è muscoloaponeurotico e non necessita dell’ulteriore spessore completo richiesto dall’aggiunta di una doppia anastomosi vascolare. L’alternativa della fascia vascolarizzata è limitata ai pazienti pediatrici che richiedono almeno il trapianto di fegato.
Anche se gli innesti non vascolarizzati presentano una maggiore incidenza di complicazioni, soprattutto infettive, sembrano un’alternativa ragionevole, soprattutto nei pazienti più anziani con un grado più elevato di aterosclerosi che ostacola un adeguato supporto vascolare o comporta un rischio aggiunto quando si creano le anastomosi.24 Questo carico aterosclerotico dovrebbe essere misurato nei riceventi adulti tramite TAC con contrasto arterioso quando si calcola il rapporto rischio-beneficio.
Nei riceventi pediatrici, le alternative vascolarizzate probabilmente acquistano importanza. Benefici come una potenziale diagnosi di rigetto, o almeno un prelievo meno invasivo con meno potenziali complicazioni, ne fanno un’alternativa molto attraente per la chiusura della parete addominale in pazienti con reinterventi multipli28 e, all’inizio, un migliore stato vascolare.
La resistenza e l’integrazione nei tessuti dei diversi tipi di trapianto della parete addominale sono impressionanti, dimostrando che queste tecniche sono alternative di chiusura della parete molto solide, specialmente in caso di reinterventi. In serie pubblicate,22 dimostrano una resistenza significativa, con una notevole mancanza di aderenze dell’intestino all’innesto di parete.16 Nella nostra serie con innesti non vascolarizzati, la presenza di fibrosi macroscopica nella necroscopia di un paziente e negli esami di imaging dell’altro ha dimostrato una buona integrazione senza necessità di supporto vascolare.
Nuove classificazioni come quella proposta dal gruppo Light et al. gruppo29 potrebbero essere utili nella pianificazione preoperatoria delle necessità dell’innesto, così come per poter confrontare i diversi innesti al di là del loro supporto vascolare.
Il fatto che i trapianti multiviscerali e intestinali rappresentino una percentuale molto bassa del totale influenza il minor utilizzo del trapianto di parete addominale e ha probabilmente limitato molto la sua diffusione. Tuttavia, la possibilità di utilizzare questo tipo di innesto in riceventi di trapianto di fegato con pareti addominali ostili potrebbe estendere l’indicazione. Questo è particolarmente vero data l’incidenza delle complicazioni con la rete in polipropilene (e il fatto che la rete non può entrare in contatto con i visceri) e gli scarsi risultati con la rete in politetrafluoroetilene espanso in termini di reinterventi e infezioni. Le alternative con rete biologica utilizzate nel nostro ospedale30 hanno presentato risultati accettabili solo in riceventi pediatrici con piccoli difetti di parete, e ad un costo economico molto elevato, motivo per cui non sono più utilizzate in riceventi adulti.
L’uso di un tale trapianto senza trapianti associati di altri visceri sembra almeno controverso data la necessità di immunosoppressione, e le alternative con rete e composti sono più praticabili in pazienti non immunosoppressi.
Conclusione
I trapianti di parete addominale sono una valida alternativa nei pazienti sottoposti a trapianto con precedenti danni alla parete addominale (che impediscono la riparazione a causa della perdita di strati muscolari) o con dimensioni del donatore/trapianto non corrispondenti con la necessità di ridurre l’innesto.
Conflitto di interessi
Gli autori non hanno conflitti di interessi da dichiarare.