A: 酸度定数の定義
ある酸が他の酸より強いことをご存じでしょうか。 異なる化合物や官能基の相対的な酸性度、言い換えれば、同一の条件下で共通の塩基にプロトンを与える相対的な能力は、酸性度定数(略称Ka)という数値で定量化されています。 比較のために選んだ共通塩基は水です。
最初の例として酢酸を考えてみましょう。 酢酸を水で希釈した溶液を作ると、酸(プロトン供与体)と水(プロトン受容体)の間で酸塩基反応が起こります。
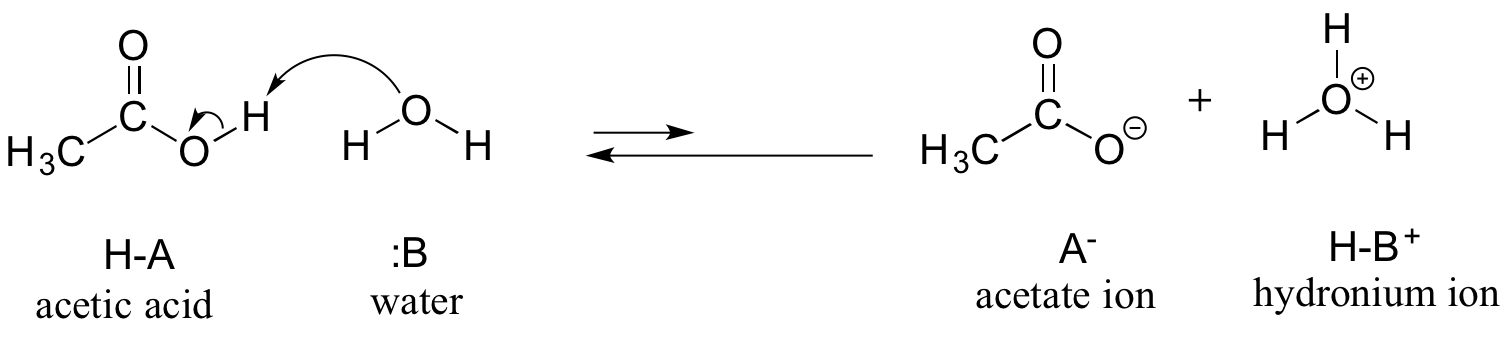
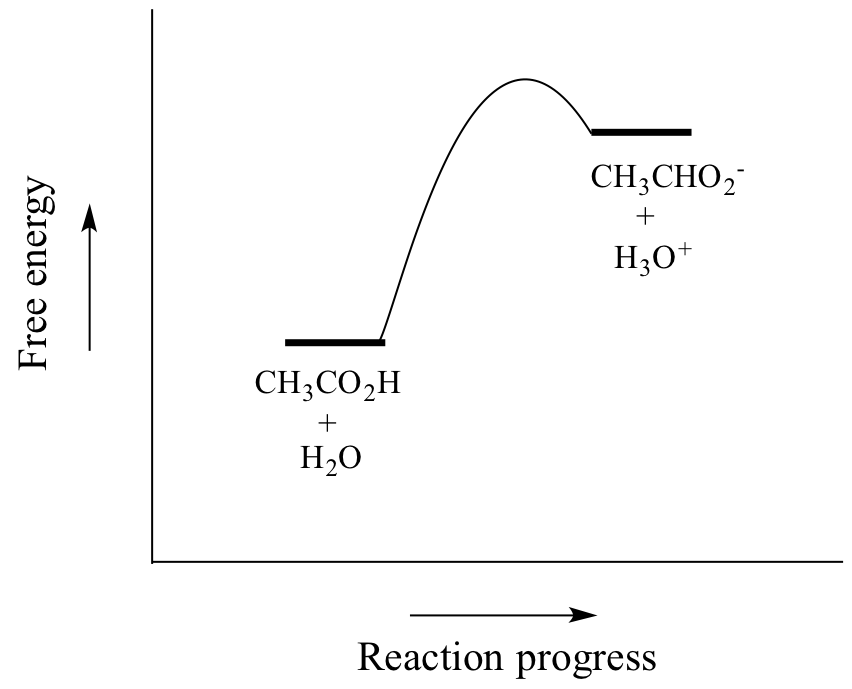
酢酸は弱酸なので、平衡は生成物より反応物が有利です。上の図では順反応と逆反応の矢印の長さが相対的であり、下の反応座標図では生成物が反応物より高エネルギーになっているように、熱力学的に「上り坂」になっていることが示されています。
ご存じのように、平衡定数Keqは次のように定義されます:
![]()
すべての平衡定数表現は、実際には反応に関わるすべての種の活性比である。 活性の使用を避け、実験測定を簡単にするために、濃度の平衡定数は希薄溶液中の溶質と気体の活性をそれぞれのモル比で近似している。 しかし、固体、純粋な液体、溶媒の活性はモル数で近似されない。
従って、希薄溶液中の水の活量を1として近似すると、酢酸の酸定数Kaの式は1で割って一般的な形になる:
}{(1)} = \dfrac{}{}。
実際、希薄な水溶液では、水の活性は1の値で近似されるので、与えられた酸HAまたはHB+の一般的な解離定数は次のように表される:
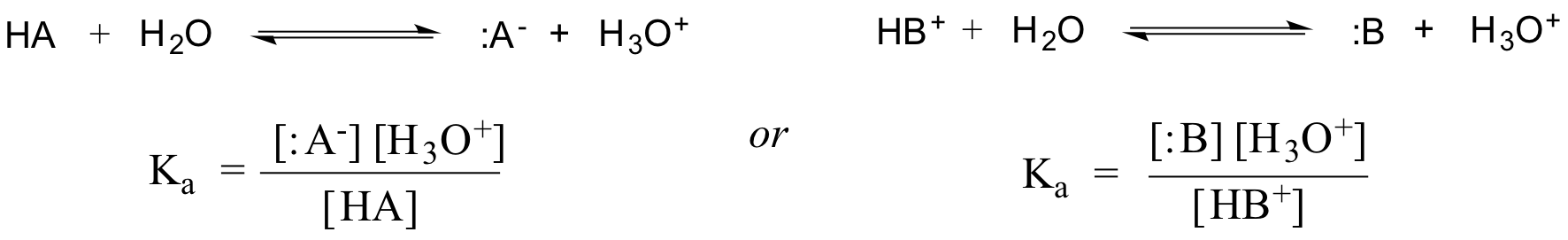
酢酸に対するKaの値は1.75×10-5と1よりはるかに小さく、平衡状態では酢酸やヒドロニウムイオンよりはるかに多くの酢酸が溶液中に存在することを示しています。
逆に、Kaが約109の硫酸や約107の塩酸は、どちらも水中で本質的に完全に解離する:それらは非常に強い酸である。 pKa = -log Ka Ka = 10-pKa
計算してみると、酢酸の pKa は 4.8 であることがわかります。 pKa値を用いることで、一般的な化合物や官能基の相対的な酸性度を、約-10(非常に強い酸)から50(まったく酸性のない化合物)までの数値で表すことができるのです。 pKa値が低いほど酸が強い。
生物有機化学に関連するイオン化可能な(プロトンを供与または受容する)官能基のpKa値は一般に約5~20の範囲である。 これらのうち最も重要なものを以下にまとめ、共役酸型のpKa値は非常に大まかなものである。 また、0に近いpKa値を持つより酸性な基も参考のため記載した。
知っておきたいpKa値の目安
ヒドロニウムイオン(H3O+) : 0
プロトン化アルコール : 0
プロトン化カルボニル : 0
カルボン酸 : 5
プロトン化イミン:。 7
プロトン化されたアミン。 10
フェノール類:10
チオール類。 10
水:14
アルコール:15-18
α-炭素酸*: 20
*α-carbon acids はこの章の後半で説明します
これらのおおよその値を今記憶することを強くお勧めします – そしてより正確な値が必要ならいつでも pKa テーブルで調べられます。
注意!pKa と pH とは別物です!
pKa と pH は別物であることを認識することが重要です。前者は化合物や官能基の固有の特性であり、後者は与えられた水溶液中のヒドロニウムイオン濃度の尺度です:
pH = -log
pKa 値を知っていると、酸強度を比較できるだけではなく、塩基強度も比較できるのです。 覚えておきたいのは、「共役酸が強いと共役塩基は弱い」ということです。 アンモニウムイオン(NH4+, pKa = 9.2)は水(pKa = 14.0)より強い酸なので、水酸化物イオンはアンモニア(NH3)より強い塩基だと判断できます。
演習 7.2.1
CH3O-とCH3S-、どっちの方が強い塩基ですか? 酢酸イオンかアンモニアか? 水酸化物イオンと酢酸イオン?
溶液
ここで、pKaの概念を理解した上で、より複雑な分子の文脈で使ってみましょう。 例えば、下の化合物のpKaは何ですか。
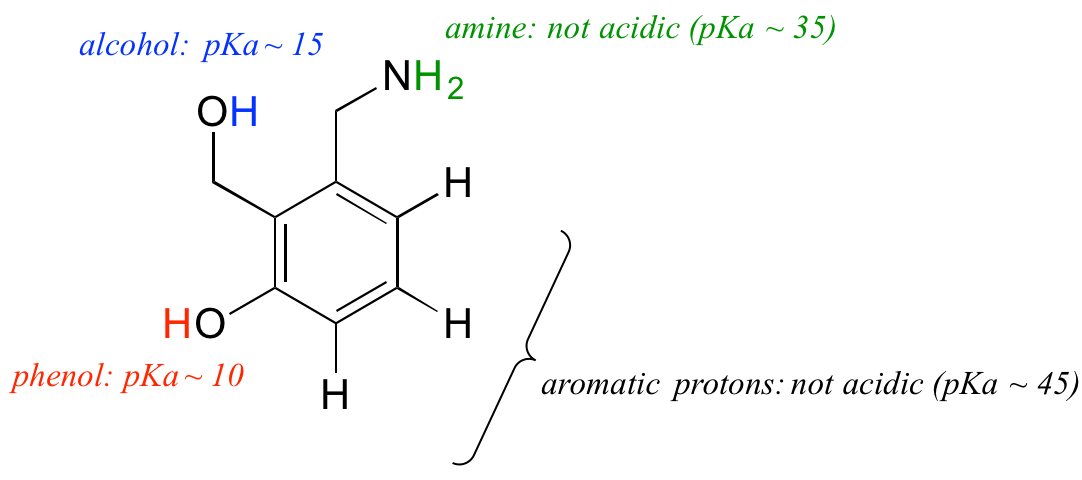
私たちは分子上の4種類の陽子の潜在的酸性度を評価し、最も酸性のものを探す必要があります。 芳香族プロトンはすべて酸性というわけではなく、そのpKaは約45である。 アミン基も酸性ではなく、そのpKaは約35である。 (電荷を持たないアミンが塩基性であることを忘れないでください。正電荷を持つプロトン化したアミンが弱酸性で、pKa値は10前後です)。 アルコールプロトンはpKaが約15で、フェノールプロトンはpKaが約10です:したがって、上の分子の最も酸性な基はフェノールです。 フェノールとアルコールの違いが分かるようにしてください。 この分子が1モル当量の水酸化ナトリウムなどの強塩基と反応すると、フェノールのプロトンが供与されてフェノラートアニオンを形成することになります。2.2
以下の各分子にある最も酸性の官能基を特定し、そのおおよそのpKaを答えよ。

Solution