Defining acidity constant
ある酸が他のものより強いことは間違いなくご存知でしょう。 異なる化合物や官能基の相対的な酸性度、つまり同一条件下で共通の塩基にプロトンを与える相対的な能力は、酸性度定数という数値で定量化され、略称は「K_axx」である。 比較のために選んだ共通塩基は水である
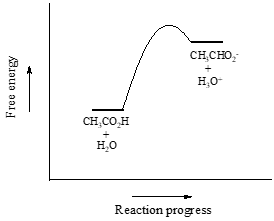
最初の例として酢酸を考えてみることにする。 酢酸の希薄溶液を水に入れると、酸(プロトン供与体)と水(プロトン受容体)の間で酸塩基反応が起こります。

酢酸は弱酸なので、平衡は反応物より生成物が有利で、熱力学的には「上り坂」であることがわかります。 これは上の図で順反応と逆反応の矢印の相対的な長さで示されています。
平衡定数 \(K_{eq}) は次のように定義されます。
{} = \frac{}{}]
これは希薄水溶液だということを覚えていてください。 したがって、反応の過程で水の濃度(約55.6mol/L)はほとんど変化しないので、定数として扱うことができます。
水の濃度の定数項を平衡定数の式の左辺に移すと、酢酸の酸定数である♪(K_a\)の式が得られる。
\ = \frac{}{}]
より一般的には、ある酸HAまたはHB+の解離定数は次のように表される。
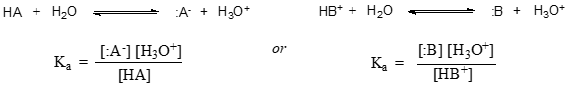
酢酸の場合は(K_a_see)は \(1.) であり、(K_see)は(1.) である。75 ╱ 10^{-5} ╱よりはるかに小さく、平衡状態では酢酸やヒドロニウムイオンよりはるかに多くの酢酸が溶液中に存在することがわかる。
逆に言えば、(K_a)が約 \(10^9) の硫酸も、(K_a)が約 \(10^7) の塩酸も、水中でほぼ完全に解離してしまう、非常に強い酸ということになります。
このような数値は、言うのも覚えるのもイメージするのも簡単ではないので、化学者は通常もっと便利な用語を使って相対的な酸度を表現します。 そのため化学者は通常、より便利な用語を使って相対的な酸度を表します。酸の \(pK_a) 値は単にその \(K_a) 値の log (base 10) です。
計算すると、酢酸の \(pK_a) 値は 4.8 であることがわかります。 また、硫酸は-10、塩酸は-7である。 このように “pK “の値を用いることで、一般的な化合物や官能基の酸性度を-10(非常に強い酸)~50(全く酸性のない化合物)程度の数値で表すことができる。
生物有機化学に関連するイオン化可能な(プロトン供与または受容)官能基は、一般に約5~20の値を持つ。 その中でも重要なものを以下にまとめました。なお、共役酸の場合は非常に大雑把な値になっています。 また、より酸性の基で閾値がゼロに近いものも参考までに掲載した。
Typical \(pK_a) values
| group | approximate \(pK_a 001) |
|---|---|
| ヒドロニウムイオン | 0 |
| プロトン化アルコール | 0 |
| プロトン化カルボニル | 0 |
| カルボン酸 | 5 |
| プロトン化イミン | 7 |
| プロトン化アミン | 10 |
| フェノール類 | 10 |
| チオール類 | 10 |
| Alcohols, 水 | 15 |
| 炭素酸 * | 20 |
*炭素酸については、7章にて説明する予定です。6A
これらの大まかな値を記憶しておくことを強くお勧めします。そして、より正確な値が必要な場合は、いつでもより完全な♪(pK_a)表で調べることができます。 また、Handbook of Chemistry and Physicsなどの資料には、より完全な表が掲載されています。 \前者は化合物や官能基の固有の特性であり、後者は与えられた水溶液中のヒドロニウムイオン濃度の尺度である。
ⒶⒶの値を知ることで、酸の強さを比較できるだけでなく、塩基の強さを比較することもできます。 覚えておきたいのは、「共役酸が強いほど、共役塩基は弱い」という考え方です。 水酸化物イオンはアンモニアより強い塩基と判断できます。なぜなら、アンモニウムイオン( \(NH4^+), pK_a = 9.2)) は水 (\(pK_a = 15.7)) よりも強い酸であるからです。 Acetate ion or ammonia? Hydroxide ion or acetate ion?
ここで、私たちが理解している「pK_a」の概念を、もっと複雑な分子の文脈で使ってみましょう。 例えば、下の化合物の \(pK_a) は何ですか?

この分子上の4種類のプロトンの潜在的酸性度を評価し、最も酸性度が高いものを探す必要があります。 芳香族プロトンはすべて酸性というわけではなく、その \(pK_a) は約 45 です。 アミン基も酸性ではなく、その \(pK_a α)は約35である。 (電荷のないアミンは塩基性で、弱酸性なのは正電荷のプロトン化したアミンで、 \(pK_a α)の値は10前後であることを思い出してください)。 アルコールプロトンは約15、フェノールプロトンは約10で、上の分子で最も酸性の基はフェノールです。 フェノールとアルコールの違いを認識できるようにしてください。 この分子が1モル当量の水酸化ナトリウムのような強塩基と反応する場合、フェノールプロトンが供与されてフェノラートアニオンを形成するのである。
演習 ㊞ 下の各分子にある最も酸性な官能基を特定し、そのおおよその閾値(pK_a)を答えなさい。