| Ed Davis、Ph.D。 |
- はじめに
- なぜDNA導入にウイルスを使うのか 細胞へのDNA導入の最も一般的な方法の1つがプラスミドベースのトランスフェクションで、これは細胞を、りん酸カルシウムなどの化学物質や、脂質ベースの試薬で処理する方法です。 しかし、プラスミドによるトランスフェクションは必ずしも望ましいものでも、実用的なものでもない。 例えば、培養細胞の多くはレンチウイルスやAAVによる感染(トランスダクションともいう)に対応しているが、一部の細胞はトランスフェクションが非常に難しいか不可能である。 第二に、プラスミドによるトランスフェクションはin vivoでのDNA導入に使用できないが、ウイルスによるトランスダクションは可能である。 例えば、オープンリーディングフレーム(ORF)からのタンパク質発現、ショートヘアピンRNA(shRNA)を介したRNA干渉(RNAi)による遺伝子ノックダウン、ルシフェラーゼやその他のレポーター遺伝子アッセイ、クラスター規則的インタースペース短回路反復配列-CAS9(CRISPR-CAS9)システムによる遺伝子ノックアウトなどである。 ウイルスベクターのこれらの応用の多くは、培養不死化哺乳類細胞株、初代細胞培養、動物モデル、およびヒト患者に対する遺伝子治療において成功裏に実施されている<7922><7001>レンチウイルスシステム<498><8217>用語「レンチウイルス」は、ヒト免疫不全ウイルス(HIV)を含むレトロウイルスクラスを指し、実際、現在使用中のレンチウイルスシステムのほとんどはHIVに由来する(Mátrai, et al.にレビューあり)。 2010; Sakuma, et al., 2012に総説あり)。 導入遺伝子を搭載したレンチウイルスは、感染と同時にゲノムに組み込まれるため、分裂している細胞でも非分裂の細胞でも安定した発現が可能です。
- AAV-based systems
- どれを選べばいいのですか? Lentivirus or AAV?
- 結論
はじめに
レンチウイルスおよびアデノ随伴ウイルス(AAV)は、培養中または動物全体の哺乳類細胞に遺伝物質を導入するために非常に貴重であることが証明されています。 両者とも、タンパク質の過剰発現、抗体産生、遺伝子ノックアウトなど、多くの基礎研究用途に非常に適しており、遺伝子治療にも有望である。 しかし、それぞれのウイルスシステムには、アプリケーションによって独自の長所と短所があります。 ジーンコポエィアでは、レンチウイルス、AAVともに豊富な製品群を取り揃えており、DNAを細胞内に導入するための強力かつ柔軟な選択肢を提供します。 このテクニカルノートでは、ジーンコポエイアの Lentifect™ lentivirus および AAVPrime™ AAV 製品ラインを支える技術について説明し、さまざまなアプリケーションにおけるそれぞれの技術の利点について述べ、お客様のニーズに最も適したシステムを選択できるようにします。
なぜDNA導入にウイルスを使うのか 細胞へのDNA導入の最も一般的な方法の1つがプラスミドベースのトランスフェクションで、これは細胞を、りん酸カルシウムなどの化学物質や、脂質ベースの試薬で処理する方法です。 しかし、プラスミドによるトランスフェクションは必ずしも望ましいものでも、実用的なものでもない。 例えば、培養細胞の多くはレンチウイルスやAAVによる感染(トランスダクションともいう)に対応しているが、一部の細胞はトランスフェクションが非常に難しいか不可能である。 第二に、プラスミドによるトランスフェクションはin vivoでのDNA導入に使用できないが、ウイルスによるトランスダクションは可能である。 例えば、オープンリーディングフレーム(ORF)からのタンパク質発現、ショートヘアピンRNA(shRNA)を介したRNA干渉(RNAi)による遺伝子ノックダウン、ルシフェラーゼやその他のレポーター遺伝子アッセイ、クラスター規則的インタースペース短回路反復配列-CAS9(CRISPR-CAS9)システムによる遺伝子ノックアウトなどである。 ウイルスベクターのこれらの応用の多くは、培養不死化哺乳類細胞株、初代細胞培養、動物モデル、およびヒト患者に対する遺伝子治療において成功裏に実施されている<7922><7001>レンチウイルスシステム<498><8217>用語「レンチウイルス」は、ヒト免疫不全ウイルス(HIV)を含むレトロウイルスクラスを指し、実際、現在使用中のレンチウイルスシステムのほとんどはHIVに由来する(Mátrai, et al.にレビューあり)。 2010; Sakuma, et al., 2012に総説あり)。 導入遺伝子を搭載したレンチウイルスは、感染と同時にゲノムに組み込まれるため、分裂している細胞でも非分裂の細胞でも安定した発現が可能です。
Lentiviral systemsは、数世代にわたってHIVから高度に改変され、安全に取り扱え、応用に役立つようになりました。 ジーンコポエィアは、第3世代のレンチウイルス系(Dull, et al. 1998)を使用しており、感染性のウイルス粒子(ビリオン)を産生するために4つの別々のプラスミドを必要とします。 ジーンコポエイアのレンチウイルスプラスミドは、発現させる目的の遺伝子(GOI)、抗生物質選択遺伝子、およびパッケージングシグナル配列のみを担持しています。 また、蛍光レポーター遺伝子を含むこともあります。 GOIを含むプラスミドは、選択マーカーとレポーター遺伝子を持ち、約5-6kbまでの挿入物を収容することができる。 (図1)。ただし、インサートサイズが約4kbを超えると、ウイルスの力価は劇的に低下する
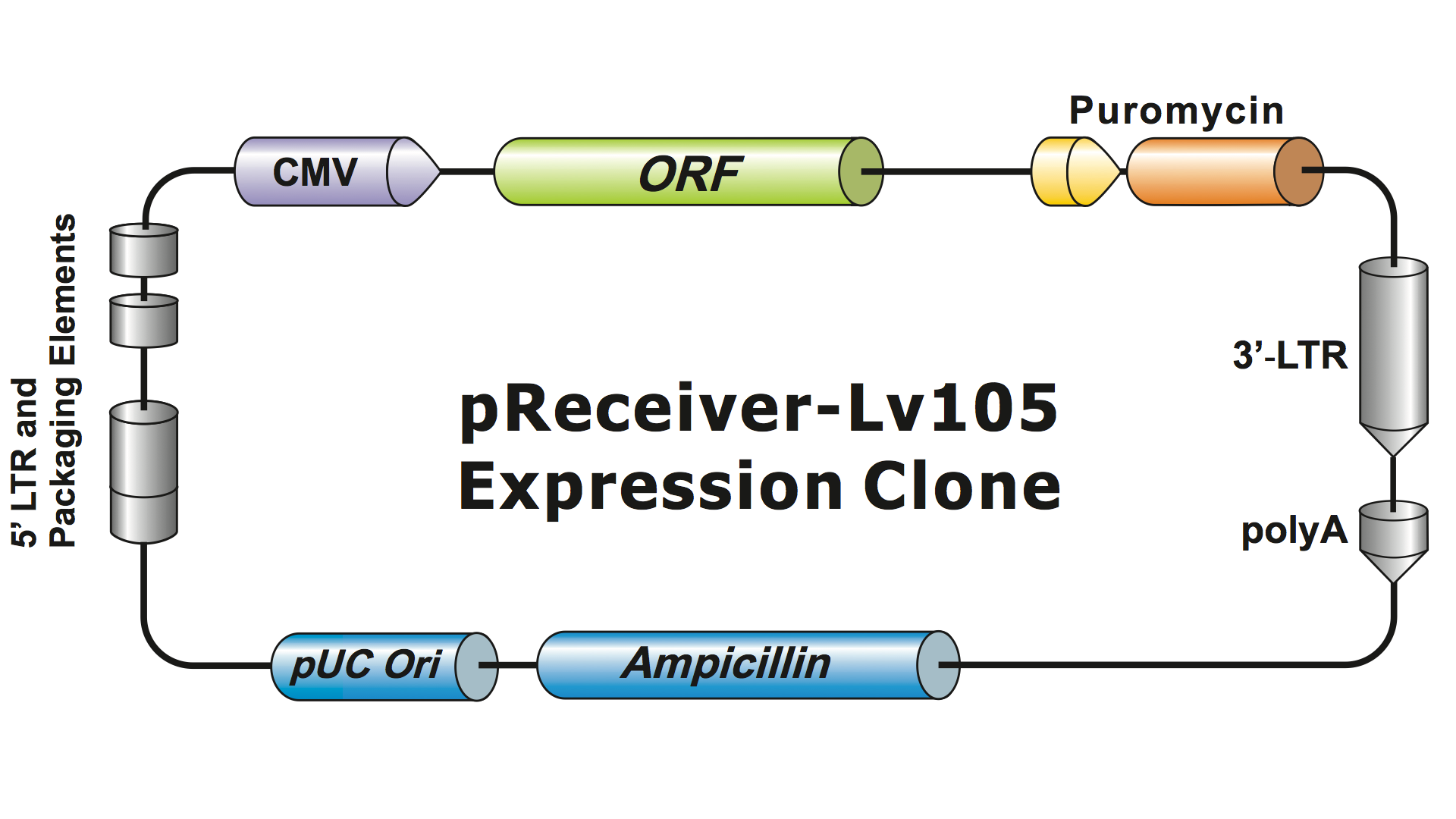 |
Figure 1. GeneCopoeiaレンチウイルス発現クローンの例 |
追加のプラスミドはパッケージングと統合に必要なレトロウイルス要素(gag, pol, env, Rev)を発現しています。 4つのプラスミドがすべてパッケージング細胞で発現されると、GOI RNAが粒子に組み込まれる。 レトロウイルスタンパク質はパッケージング時のみ発現されるため、感染細胞は感染性ウイルスを産生できない。 また、ジーンコピーのレンチウイルス粒子は、LTRのU3領域が欠失されており、自己不活性化(SIN)しています。 このSIN欠失により、4つのプラスミドが組み合わさって単一の活性ウイルスプラスミドが作られるようなまれなケースでも、レンチウイルスの複製が阻止されます。 このため、レンチウイルス粒子は、病原性ウイルスを生成する可能性がほとんどなく、安全に取り扱うことができます。
安全性の強化に加え、ジーンコピーのレンチウイルス粒子では、野生型HIV env遺伝子の代わりに水胞性口内炎ウイルスG (VSV-G) 糖タンパク質を搭載し、ウイルスの組織向性はCD4+ T細胞からほぼあらゆる哺乳類の細胞型へと変更されています。 このように、レンチウイルスは、哺乳類細胞培養、動物モデル、および遺伝子治療への応用に広く使用されているシステムである。
このようにレンチウイルスベクターは改良されているため、ジーンコピーのLentifect™レンチウイルスシステムは安全性が向上し、DNAデリバリーに非常に有用である以下の特徴を備えています。
- ほぼすべての哺乳類細胞に感染する
- 比較的大きなDNA配列(長さ5~6kb程度)を導入することができる
- 安定した細胞株を作製したり、生体内の臓器や組織で安定した遺伝子発現を誘導するために使用される
- 。 8591>
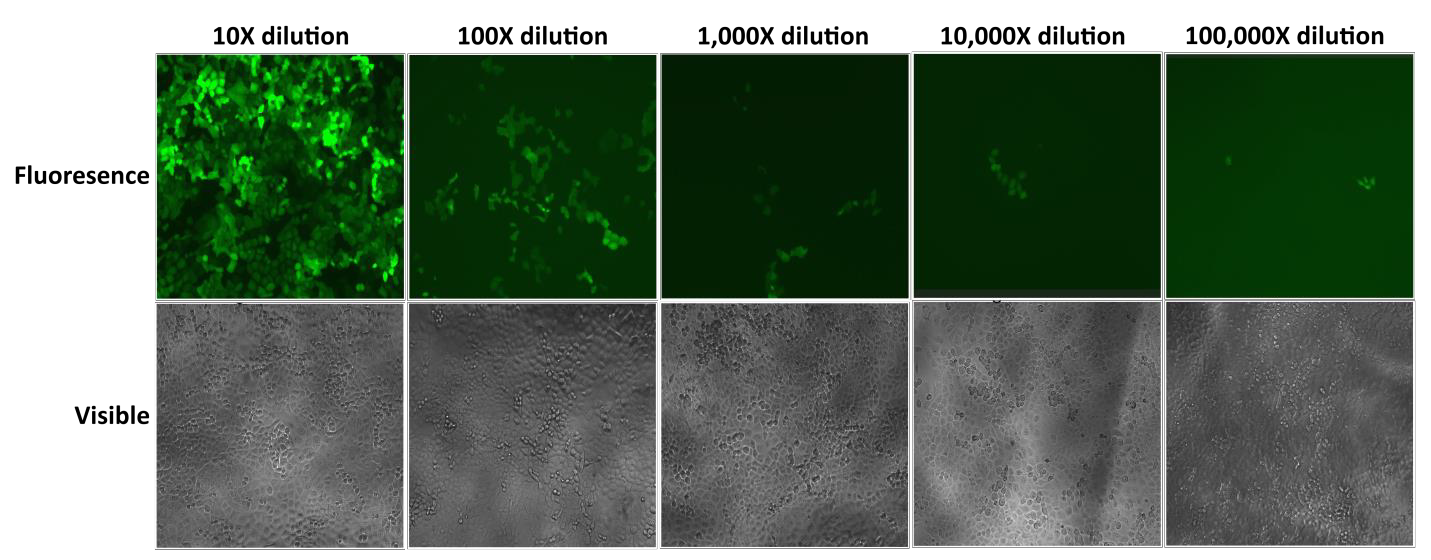
GeneCopoeia の Lentifect™ lentiviral particle は高力価で、目的の遺伝子を効率的に発現させることができます (図 2 参照)。
|
Figure 2. レンチウイルス粒子の連続希釈のテスト。eGFP蛍光は、導入後72時間後に蛍光顕微鏡で撮影されました。 |
|
GeneCopoeia は業界で最も幅広いレンチウイルス製品ラインを提供。
| 製品/サービス | 説明 |
| Lentiviral clones and cloning vectors | ORF, promoters, shRNA, miRNA 3′ UTR, precurs, and inhibitor, sgRNAs などを含む既製およびカスタムクローンです。 複数のプロモーター、タグ、レポーターを搭載したクローンが入手可能。 3572> |
| Lentifect™ lentiviral particles | 既製およびカスタムパッケージの、すぐに使用できるレンチウイルス粒子です。 |
| Lenti-Pac™ Lentiviral Packaging Reagents | DIY lentiviral particle production用試薬の完全なシステムです。 パッケージングプラスミド、パッケージングセルライン、粒子濃縮液、滴定キットが含まれます。 |
表1. GeneCopoeia’s line of lentiviral products and services.
AAV-based systems
レンチウイルスのRNAゲノムとは対照的に、AAVは一本鎖DNAゲノムを有する(Samulski and Muzyczka, 2014)。 また、AAVは病原体に由来するものではなく、むしろアデノウイルスの汚染物質であり、病原性は認められていない。 天然に存在するAAVは、レンチウイルスと同様にゲノムに統合するが、19番染色体上のAAVS1遺伝子座にのみ統合する。 この部位は、細胞を傷つけることなく導入遺伝子を挿入するためによく使われるため、「セーフハーバー」とも呼ばれる(DeKelver, et al., 2010)
レンチウイルスと同様に、AAVは安全性と使いやすさを考慮して改良されてきた。 AAVはヘルパーウイルスとの共感染を必要とする。 AAVのゲノムは4.7kbの長さで、ウイルスの複製と統合に必要な2つの遺伝子、RepとCapを含んでいる。 AAVPrime™では、RepとCapは削除され、145bpの5’と3’の逆方向反復配列(ITR)だけが残されています。 RepとCapの削除には3つの目的がある。 1)ヘルパーウイルスがAAVに感染した細胞に新しいAAVビリオンを作らせる能力をなくす、2)長さ約4kbまでの遺伝子の挿入を可能にする(ただし、3kb以上の導入遺伝子ではウイルスの力価が減少する)、3)AAVの統合能力を事実上なくす。 AAVのサイズが小さいことは、いくつかのアプリケーションに課題をもたらす。 例えば、CRISPRゲノム編集のために、研究者は黄色ブドウ球菌由来のCas9ヌクレアーゼを使用しているが、これはより一般的に使用されているS. pyogenes Cas9よりも約30%短いためである(Ran, et al, 2015)。
パッケージングのために、RepとCapは別のプラスミドに移され、アデノウイルスヘルパー遺伝子は第3のプラスミドに置かれ、パッケージングシステム全体を安全かつヘルパーウイルスなしにする(図3)
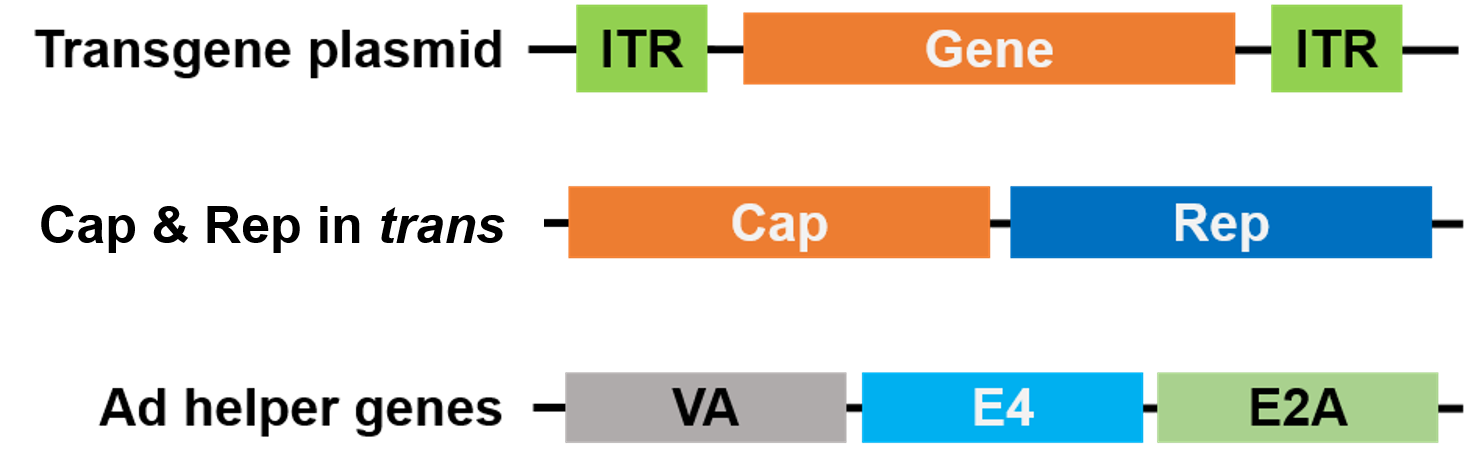 |
Figure 3.パッケージングに含まれるヘルパーウイルスは、S.pyogenesのCas9である。 ヘルパーウイルス不使用のAAV。 3つのプラスミドがパッケージングに使用されている。 目的の遺伝子プラスミド(上)には逆末端反復配列(ITR)が含まれている。 2番目のプラスミド(中)にはAAVのCapとRepの遺伝子が、3番目のプラスミド(下)にはアデノウイルス(Ad) |
さらに、AAVには異なる血清型があり、これがAAV感染の組織特異性に影響を与えている。 複数の血清型により、研究者はa)広範囲の宿主細胞に感染させる、またはb)感染を1つまたはいくつかの組織に制限することができる。 ジーンコポエィアのAAVPrime™AAV粒子は、複数の血清型を用意しています(表2)。
| 血清型 | 主要標的組織 | 説明 |
| AAV-1 | 筋肉 | 心筋、骨格筋、ニューロン、グリア組織への使用に最適である。 |
| AAV-2 | 筋肉、肝臓、網膜 | 最もよく使われる血清型である。 |
| AAV-3 | Megakaryocytes | Megakaryocytes, muscle, liver, lung, and retinaに最も適している。 |
| AAV-4 | Retina | ニューロン、筋肉、脳、網膜に最適です。 |
| AAV-5 | Lung | Best for lung, neurons, synovial joint, retina, and pancreas. |
| AAV-6 | Muscle, Lung | Best for lung, liver, and heart.これは肺に最適です。 |
| AAV-7 | Muscle, Retina, Neurons | muscle, neurons, and liver. |
| AAV-8 | muscle, brain, liver, retina にベストな製品です。 | |
| AAV-9 | Various | 筋肉、心臓、肝臓、肺、脳に最適 |
| AAV-10 | Pleura, CNS | Cynomolgusからクローニング、AAVrh10と12アミノ酸を除いてほぼ同一VP1が存在する。 肺、筋肉、心臓、NCS、肝臓に最適。 |
| AAV-DJ | Various | 自然に存在する8種類の血清型を混合したものである。 3572> |
| AAV-DJ/8 | Various | AAV-DJのヘパリン結合ドメイン(HBD)変異体で、生体内で肝臓や他の組織への感染を可能にしたもの。 |
表2. List of widely-used AAV serotypes
AAVPrime™ AAV particles have the following features that makes highly useful for DNA delivery:
- High titers.AAV Serotypes
AAVPrime™ AAV particles have the following features that makes the highly useful for DNA delivery. 精製粒子の力価は最大10^14 GC/ml (ゲノムコピー/ml)
- 多用途。 複数の血清型があるため、幅広い宿主細胞または限られた宿主細胞で使用できる。 宿主ゲノムに統合されない
- 低い免疫原性。 宿主の免疫反応が少ない。
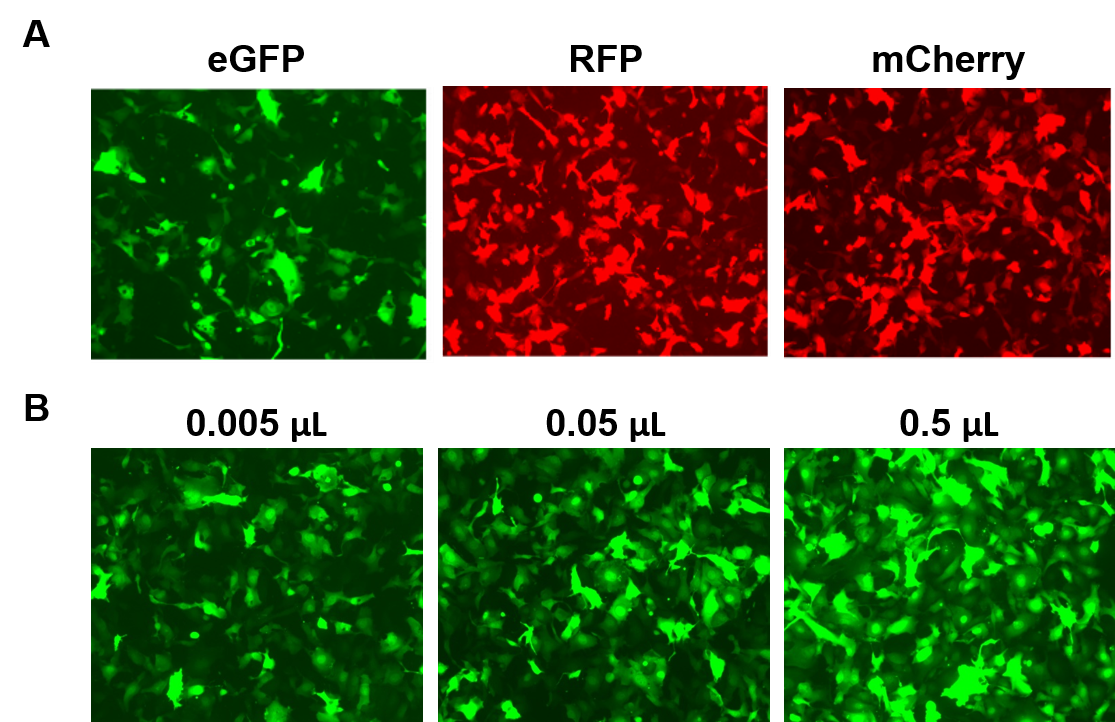
AAVPrime™ パーティクルは、最大3 kbのヒトおよびマウスORFについて、複数の血清型およびプロモーターオプションで、標準純度(in vitro使用のみ)または精製(in vivo使用)されたものが入手可能です。 お客様はプラスミドクローン、目的の遺伝子用にカスタム生成された粒子、または蛍光レポーターなどの遺伝子を発現する既製のオプションから選択して注文することができます (図 4)。 ジーンコポエアの AAVPrime™ 粒子の性能。 A. 24ウェルプレートのHT1080細胞に、強化型GFP(eGFP)、赤色蛍光タンパク質(RFP)、およびモノマーチェリー(mCherry)を発現する標準純度のAAVを0.5 µL導入したもの。 B. 24 ウェルプレート内の HT1080 細胞に、eGFP を発現する精製 AAV を様々な量だけ形質導入した。 細胞は蛍光顕微鏡で可視化した(Exposure time: 400 ms)。
どれを選べばいいのですか? Lentivirus or AAV?
Lentivirus と AAV のどちらを選ぶかは、多くの要因に左右されます。 例えば、レンチウイルスがゲノムに統合されるという事実は、あなたのニーズ次第でメリットにもデメリットにもなり得ます。 下の表を参考に決定してください。
| より大きな挿入物 | 安定した統合 | なし | より大きな挿入物 | 安定した統合 | なし 統合 | 細胞・組織特異性 | in vivo安全性 | |||
| レンチウイルス | ✔︎ | ✔︎ | ||||||||
| aav | ✔︎ | ✔︎ |
ジーンコピアのウイルスシステムについての詳細、ご注文はこちらです。 (https://www.genecopoeia.com/product/lentiviral-system/)
結論
ジーンコポエィアは、ファンクショナルゲノミクスとセルバイオロジーのための製品において、最高品質と最先端技術を提供することに尽力しています。 ORF、遺伝子プロモーター、miRNA、shRNA、CRISPRなどのプラスミドDNAクローンのゲノムワイドセットから、強力なキットや試薬、蛍光細胞構造プローブ、核酸定量用製品、標識抗体まで、幅広い製品を取り揃えています。 詳細については、当社のウェブサイト(www.genecopoeia.com)をご覧いただくか、[email protected] までお問い合わせください。
DeKelver, et al. ヒトゲノムのセーフハーバーローカスへのジンクフィンガーヌクレアーゼ駆動のトランスジェネシスを用いた同系統設定での機能ゲノミクス、プロテオミクス、制御DNA解析。 Genome Res 20, 1133.
Dull, et al. (1998). 条件付きパッケージングシステムを持つ第3世代レンチウイルスベクター. J. Virol. 72, 8463.
Ran, et al.(2015)。 黄色ブドウ球菌Cas9を用いたインビボゲノム編集。 Nature 526, 186.
Sakuma, et al. レンチウイルスベクター:ベーシックからトランスレーショナルへ. Biochem. J. 443, 603.
Samulski and Muzyczka (2014). 研究および治療目的のためのAAV媒介遺伝子療法. Annu. Rev. Virol. 1, 427.