DNAの構造が比較的単純で繰り返しが多いことを考えると、それに特異的に結合するタンパク質は、共通のDNA結合ドメインモチーフを持ちながら、特定のアミノ酸の側鎖で特定の結合相互作用を可能にするかもしれないことになります。
- helix-turn-helix: 原核生物のDNA結合タンパク質に見られる。
図: helix-turn-helix
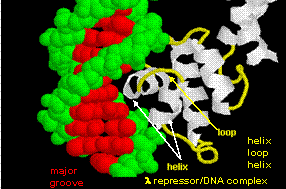
図は、バクテリオファージ 434 の cro リプレッサーとラクテリオファージ lambda リプレッサーの2種類のこの種のタンパク質を示しています。 (バクテリオファージは細菌に感染するウイルスである)タンパク質とオペレーターDNAの主要な溝の間に特定のH結合が形成されることによって、部分的に特異性が達成されていることに注目してほしい」
図。 ラムダ・リプレッサー/DNA複合体
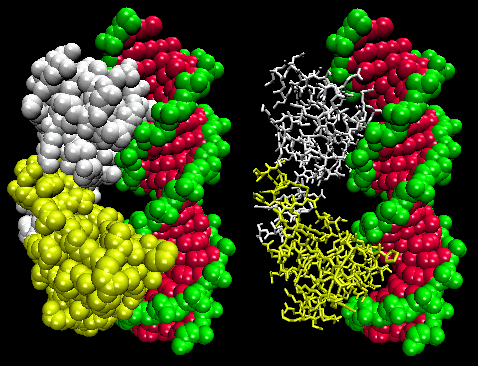
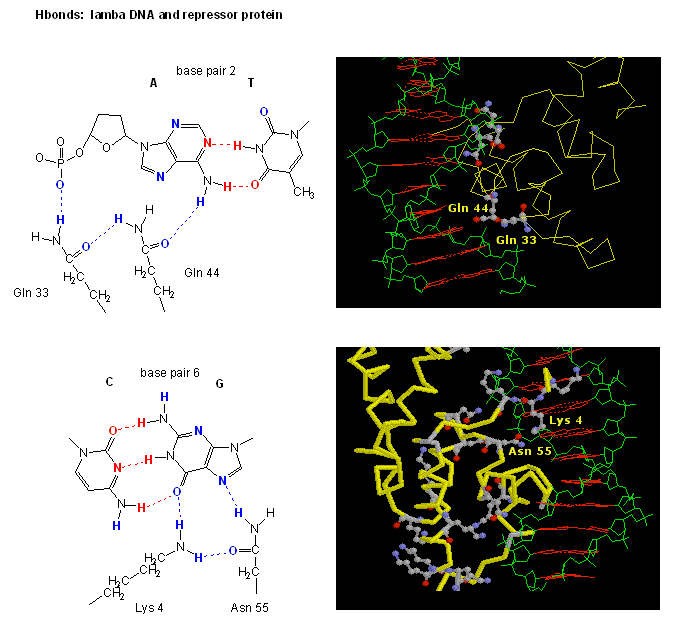
図: HボンドによるリプレッサーとDNAの相互作用
![]() Jmol.Figure:ラムダリプレッサー/DNA複合体
Jmol.Figure:ラムダリプレッサー/DNA複合体
 5679 Lambda Repressor/DNA complex Jmol14 (Java) | JSMol (HTML5)
5679 Lambda Repressor/DNA complex Jmol14 (Java) | JSMol (HTML5)
- zinc finger を更新しました。 (真核生物)これらのタンパク質は、X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4-(Xは任意のアミノ酸)の共通配列モチーフを持つ。 Zn2+はCysとHisの側鎖に4面体配位しており、それぞれ2本の逆平行β鎖とαヘリックス上にある。 亜鉛によって安定化されたジンクフィンガーは、DNAの主溝に結合する。 ]
図:ジンクフィンガー
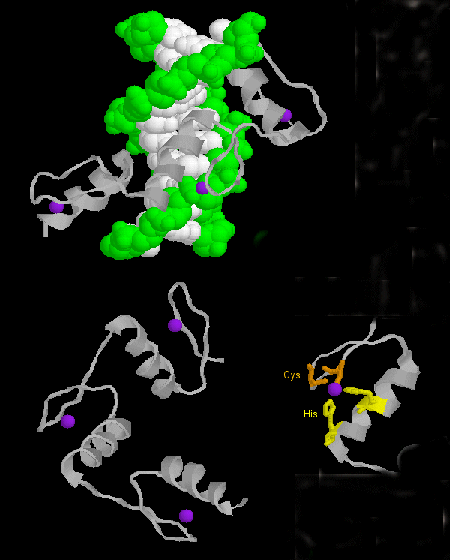
![]() Jmol: Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Jmol: Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
ヒトゲノムに900個コードされている(上記の真核生物の絶縁体結合タンパク質CTCFを含む)ジンクフィンガータンパク質を、細胞内の特定の突然変異の実際の修復に動員することができ、もし突然変異細胞の十分高い割合で実行された場合には、重症複合免疫不全症のいくつかの形態などの特定の遺伝病も治癒できる可能性があります。 この新しい技術(Urnov et al, 2005)では、複数のZnフィンガー結合ドメイン(天然に存在するもの、または研究室で作られた変異型)が、それぞれ特定のヌクレオチド配列に特異的に結合し、酵素FokIに由来する非特異的エンドヌクレアーゼに連結されている。 このヌクレアーゼは二量体で活性を示すため、活性複合体が標的部位に集合するためには、4つの異なるZnフィンガードメインにそれぞれ結合した2つのエンドヌクレアーゼドメインが必要である。 結合の特異性は、Znフィンガー・ドメインによる選択によって達成される。 そして、ヌクレアーゼによってDNAにニックが作られ、宿主細胞の修復機構が働く。 この過程では、鎖の分離、ニックの入った領域と細胞内の相補的なDNAとの相同組換え、そしてニックの修復が行われる。 もし、過剰な野生型(変異していない)DNAを細胞に加え、鋳型として使用すれば、通常のDNA修復変異により変異が固定される。 Urnovらは、突然変異を持つ培養細胞の20%までが実験室で修復されることを明らかにした。 もしこれらの細胞が選択的に成長できるようになれば、突然変異を起こした細胞は最終的に野生型の細胞に置き換わるでしょう。 (真核生物)ほとんどのホルモンが細胞表面の受容体に結合するのとは対照的に、ステロイドホルモン(コレステロールの誘導体)は細胞膜を通過し、ホルモン結合ドメインを介して細胞質受容体に結合する。 このとき、受容体の形状が変化し、DNA結合ドメインを介してDNA上の特定の部位(ホルモン応答配列要素)に結合する。 ジンクフィンガーに類似した構造として、Zn 2+が4つのCysに四面体配位した球状構造があり、大溝内の2つの同一だが逆転した配列のDNA(パリンドローム)に2量体として結合する。 (回文の例。 回文の例:Able was I ere I saw Elba; Dennis and Edna dine, said I, as Enid and Edna sinned(デニスとエドナが食事をすると、イーニッドとエドナが罪を犯したと私は言った)。
具体的な例としてグルココルチコイド受容体(GR)を考えてみましょう。 GRは二量体としてDNAに結合します。 二量体の2つのDNA結合ドメインは、プロモーター内の短いDNA配列であるGR結合配列(GBS)中のDNAの隣接する2つの主要な溝に結合する。 Meijsingらは、GBSがGRの結合部位として働き、遺伝子の転写を可能にするだけでなく、受容体の立体構造に影響を与え、別の方法で遺伝子の転写を制御していることを明らかにした。 研究グループは、タンパク質のルシフェラーゼの遺伝子にGBSを結合させたルシフェラーゼ「レポーター遺伝子」を構築し、その遺伝子が転写されていればタンパク質のルシフェラーゼ(蛍光を発する)を発現するように、GBSを結合させたものを作りました。 その結果、相対的な転写活性は、GBSに対するGRの相対的な結合親和性とは相関しないことがわかりました。 一方、転写活性が同程度のGBSは、異なる親和性で結合することがわかった。 このことは、GBSがそれに関連するGRに独自の機能を与えている(すなわち、GRがGBSに結合しているかどうかによって、単純に転写が影響を受けるのではない)ことを示している。 受容体の�lever arm�は、DNAに結合するとコンフォメーションが変化し、結合した配列に特異的な変化を示すことがわかった。 また、GR-γ�という変異体タンパク質は、DNA上の同じ場所に結合しているにもかかわらず、レバーアーム以外は野生型タンパク質であるGR-α�と同じであり、レバーアームとその構造が転写に影響を与えることが明らかになった。 (真核生物)これらのタンパク質は35アミノ酸のストレッチを持ち、その中でロイシンは7アミノ酸の間隔で繰り返し見出されている。 これらの領域は両親媒性のらせんを形成し、一方の面にはLeuが、らせんの2回転後には1つのLeuが存在する。 これらの非極性ロイシンに富んだ両親媒性らせんが互いに結合することによって安定化し、筋肉タンパク質ミオシンのようにコイルドコイルを形成し、2つのタンパク質が二量体を形成することができる。 ロイシンジッパーは、タンパク質のタンパク質結合ドメインを表している。 DNA結合領域は、N末端の最初の30個のアミノ酸に存在し、塩基性で、タンパク質がDNAに結合するときにαヘリックスを形成する。 そして、ロイシンジッパーが機能して、2つのDNA結合タンパク質が一緒になり、N末端の塩基らせんがDNAの主要な溝と塩基特異的に相互作用することが可能になる。 ロイシンとともにバリンとイソロイシンは、しばしば他のタイプのコイルドコイルを形成するために相互作用できるアミノ酸のストレッチに見られます。
図:ロイシンジッパー(VMDで作成)
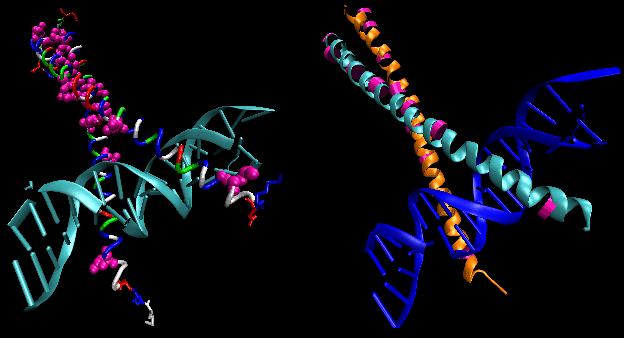
![]() Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
突然変異の修復を誘導するために亜鉛フィンガーヌクレアーゼが使用されてきたように、ラットゲノムの別の研究では、不正確なDNA修復機構(NHEJによる)による変異を含み、したがって特定の変異を含んだds-DNAに切断を起こすために特別なデザインのZFNを用いています(Geurts、 et al.2009)。 この過程、すなわち遺伝子のノックアウトは、標的遺伝子によって正常に転写されるタンパク質の産生を妨げる。 緑色蛍光タンパク質(GFP)、免疫グロブリンM(IgM)、Rab38という3種類のタンパク質に対して、5本および6本のフィンガーZFNを使用して、遺伝子への標的結合に高い特異性を実現しました。 ノックアウトは試験したラットの12%で成功した。これらの動物には野生型タンパク質がなく、発現もなかった。 ZFNは十分に特異的であり、予測された20の非標的部位のいずれにおいても変異は観察されなかった。 この研究は、病気の治療のための転写と発現の制御の実行可能性と特異的結合の重要性を支持する。
私たちは、タンパク質によるDNAの特異的認識に寄与する2つの主要因があることを見てきた:主要溝の特定のヌクレオチド供与体と受容体への水素結合形成と、タンパク質リガンドとの親和性を高める形状への配列依存のDNAらせんの変形である。 例えば、Tata Binding Protein(TBP)は、TATAボックスの広がった小溝と相互作用することができる。 5679>
Aを多く含むDNAのトラックは、大溝で塩基間水素結合を引き起こし、小溝を狭くするねじれたコンフォメーションになることがあります。 AT塩基対は狭い小溝(幅<5.0�)に集中し、CG塩基対は広い小溝に多く見られる。
小溝が狭くなることはDNA認識にどのような影響を与えるのか? 小溝が狭いとDNAの負の静電ポテンシャルが高まり、より特異的で認識しやすい部位になります。 DNAの骨格となるリン酸塩の位置は、溝が狭いと溝の中央に近づくため、溝の狭さと負の静電ポテンシャルには相関があります。
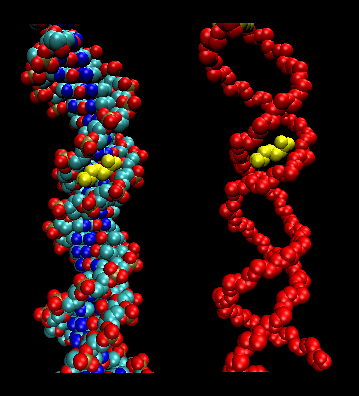
タンパク質の小溝と相互作用する部分には、側鎖がより狭く負の小溝に収容されうるアルギニンが含まれています。 アルギニンはDNAの形状認識の特異性を高める短い配列モチーフとして結合し、場合によっては挿入することができる。 アルギニンの電荷の有効半径はリスの電荷キャリアよりも大きいので、リスに比べてアルグが好ましい。 これにより、Argの脱溶媒エネルギーが減少し、狭窄した主要な溝への結合が促進されると考えられる。 この発見は、「ゲノム全体を注釈し、転写因子結合部位を予測する際には、DNAの形状の役割を考慮しなければならない」ことを示している
図: T3c TransposonのNarrowed Minor GroveにおけるT3c Transposase結合のArg
- タンパク質/DNA相互作用のスライドモデル
貢献者と帰属
- Henry Jakubowski教授 (College of St. Benedict/St. John’s University)