Editorial on Research Topic
The Role of AAA+ Proteins in the Protein Repair and Degradation(タンパク質の修復と分解におけるAAA+タンパク質の役割 タンパク質の修復と分解
ATPases Associated with diverse cellular Activities(AAA+)は、細胞生理学に不可欠な様々な機能を担うタンパク質スーパーファミリーである。 タンパク質恒常性の制御、DNA複製、組換え、クロマチンリモデリング、リボソームRNA処理、分子標的、オルガネラ生合成、膜融合など(Hanson and Whiteheart, 2005; Erzberger and Berger, 2006; Snider et al., 2008). このスーパーファミリーのメンバーは、ATPの結合と加水分解に必要な標準的なウォーカーAおよびBモチーフを含むAAA+ドメインと呼ばれるものの存在によって定義されている(Hanson and Whiteheart, 2005)。 通常、ゲノムには約10〜数百のAAA+ファミリーメンバーがコードされており(表1;Finn et al.、2017)、それぞれが基質認識とプロセシングの正確なメカニズムを必要とする特定の機能ニッチに適応していると考えられている(Hanson and Whiteheart、2005)。 多様な環境で動作するAAA+タンパク質の顕著な適応的放射は、AAA+ドメインの多用途性を示している(Erzberger and Berger, 2006)。 AAA+タンパク質は通常、6量体複合体を形成し、他のタンパク質、DNA/RNA、または多成分複合体を再構築するモーターとして働く(図1)。 実際、多くのシャペロンやATP依存性プロテアーゼがこのスーパーファミリーに属するサブユニットを持つか、持っている(図1;Olivares et al.、2016)
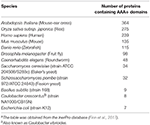
Table 1. モデル生物におけるAAA+タンパク質の数a.
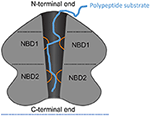
Figure 1. AAA+6量体の一例としてのClpAの模式図。 単量体あたり2つのAAA+ドメインを有するAAA+六量体の例としてのClpAのドメイン構造および相互作用の概略図である。 ここでは、ClpA6量体の側面図を切り取って、中央のポリペプチド伝導性チャネルを描いている。 ClpAには、N末端ドメインと2つのAAA+ドメイン(ヌクレオチド結合ドメイン1および2、NBD1およびNBD2)を含む3つのドメインが存在する。 N末端ドメインは基質特異性の調節因子と相互作用し、C末端はチャンバー型プロテアーゼClpPと相互作用している。 NBD1およびNBD2(オレンジ)からの可動ループは、中央チャネルに突出し、ポリペプチド基質(青)に関与し、それによってATP加水分解と中央チャネルを横切るポリペプチドの転位の結合を可能にする<616><8095><8242>近年、多数のAAA+タンパク質の構造と機能メカニズムの特定においてかなりの進展があった(Gatesら、2017;Puchadesら、2017;Ripsteinら、2017;Zehrら、2017)。 この研究テーマでは、このエキサイティングな進歩のいくつかの要素が、以下のようないくつかのAAA+シャペロンおよびプロテアーゼの詳細な構造および機構的見解を包含する21の論文で伝えられています。 ClpX (Alhuwaider and Dougan; Bittner et al.; Elsholz et al.; LaBreck et al.; Vass et al.), ClpA (Bittner et al.; Duran et al.), ClpB and Hsp104 (Chang et al.), ClpB and Hsp104 (Chang et al.).Duranら;Frankeら;Johnstonら)、Hsp78(Abrahãoら)、ClpC(AlhuwaiderおよびDougan;Elsholzら)、ClpE(Elsholzら)、Hsp104(Duranら;Duranら;Frankeら;Johnstonら)、ClpC(Duranら;Frankeら;Johnstonら)、ClpE(Duranら;Frankeら;Johnstonら、Johnstonら)、Pontin (Mao and Houry), Reptin (Mao and Houry), FtsH (Alhuwaider and Dougan), 19Sプロテアソーム (Snoberger et al.; Yedidi et al.), Lon (Alhuwaider and Dougan; Bittner et al.; Fishovitz et al.)、p97 (Hänzelmann and Schindelin; Saffert et al.; Ye et al.), Pex1/6 (Saffert et al.), CbbQ (Mueller-Cajar), rubisco activase (Bhat et al.), torsins (Chase et al.), and mitochondrial AAA+ proteases (Glynn) などが知られています。 616>
ClpXP、Lon、および関連するATP依存性プロテアーゼに関する研究
The Protein Chaperone ClpX Targets Native and Non-native Aggregated Substrate for Remodeling, Disassembly, and Degradation with ClpPという論文で、LaBreckらは、ClpPとLon、ATP依存性プロテアーゼに関する研究を行っています。 は、ClpXが特定のClpX認識シグナルを含むポリペプチドに対して分解活性を持つことを確立するために、一連のエレガントな実験を行った(LaBreck et al)。 ClpPの存在下で、ClpXはこれらの基質の分解を行う。 また、ClpXPが、生体内でClpX認識シグナルを持つタンパク質が形成する凝集体の蓄積を防ぐことも明らかにした(LaBreck et al.) これらの研究は、これまで十分に評価されていなかったタンパク質分解酵素としてのClpXを明らかにした。
彼らの研究論文「The Essential Role of ClpXP in Caulobacter crescentus Requires Species Constrained Substrate Specificity」において、VassらはClpXの種特異的機能を探索した(Vass et al.) 不思議なことに、ClpXはC. crescentusのようなある種の細菌には必須であるが、大腸菌のような他の細菌には必須ではない(Vass et al.)。 重要なことは、大腸菌のClpXは、in vivoでC. crescentusのClpXを補うことができなかったことである(Vass et al.) この活性の欠如は、C. crescentusの複製クランプローダーサブユニットDnaXを処理するのに重要なClpXのN末端ドメインの種特異的な違いによるものであった。 したがって、ClpXの特異性のわずかな違いは、特定の細菌種にとって特に重要であると考えられる。
Elsholzらは、「Functional Diversity of AAA+ Protease Complexes in Bacillus subtilis」に関するレビューにおいて、枯草菌のいくつかのAAA+プロテアーゼの機能、すなわち、「B. subtilis: ClpCP、ClpEP、ClpXP、ClpYQ、LonA/B、およびFtsHである(Elsholz et al.)。 彼らは、異なるストレス応答がどのようにそれらの発現を制御しているか、また、これらの異なるプロテアーゼの欠失によって観察される表現型について論じている。 また、これらのプロテアーゼのうち、いくつかのプロテアーゼの能力、胞子形成、運動性、バイオフィルム形成を制御する能力について述べている。 最後に、著者らは、新規抗生物質の開発のためにこれらのプロテアーゼを標的とすることについて論じている。
「AAA+ Machines of Protein Destruction in Mycobacteria」と題したレビューにおいて、Alhuwaiderら(Alhuwaider and Dougan)は、マイコバクテリアのAAA+プロテアーゼの構造と機能の決定における最近の進展について述べている。 これらのプロテアーゼは ClpXP1P2、ClpC1P1P2、Lon、FtsH、そしてMpaである。 また、真核生物のユビキチン・プロテアソーム系に相当するマイコバクテリアのPup-プロテアソーム系(PPS)についても述べている。 Alhuwaiderらは、ClpP1P2の活性を調節または阻害する新規化合物、およびClpC1の調節を阻害する他の化合物について考察し、結論を述べている。 これらの化合物は、マイコバクテリアに対して有望な活性を有する。
「The Copper Efflux Regulator CueR Is Subject to ATP-Dependent Proteolysis in Escherichia coli」という研究論文において、Bittnerらは、AAA+プロテアーゼLon、ClpXPおよびClpAPが、銅排出Cueシステムの誘発を制御する転写因子である大腸CueRの分解に責任があることを示している (Bittner et al.). 著者らは、AAA+プロテアーゼによるCueRの認識には、CueRのアクセス可能なC末端が必要であることを見出した。 616>
Fishovitz らは、「Utilization of Mechanistic Enzymology to Evaluate the Significance of ADP Binding to Human Lon Protease」という研究論文で、ヒトと大腸菌のLonを詳細に比較している(Fishovitz et al)。 大腸菌のLonと異なり、ヒトのLonはATPase活性において同等のkcat値とKM値を示すにもかかわらず、ADPに対する親和性が低いことを詳細な機構論的研究によって明らかにした。 彼らは、ヒトLonは基質によって促進されるADP/ATP交換機構によって制御されていないことを提唱している。 このようなヒトと大腸菌のLonの違いは、将来、種特異的なLon阻害剤の開発を可能にするかもしれない。
Glynn 博士は、「Multifunctional Mitochondrial AAA Proteases」のレビューで、二つのミトコンドリアAAAプロテアーゼ、i-AAとm-AAについて述べている (Glynn). どちらもミトコンドリア内膜タンパク質である。 しかし、i-AAAはATPaseとプロテアーゼドメインをミトコンドリア膜間隙に投影し、m-AAAのプロテアーゼは触媒ドメインをマトリックスに投影している。 これらのプロテアーゼの構造および機能発現機構について議論した。 616>
ClpB and Hsp104
Mini-review “Structural Elements Regulating AAA+ Protein Quality Control Machines” で、Chang らは、AAA+ プロテアーゼの構造について述べている。 は、ポアループ-1、インターサブユニットシグナリングモチーフ、およびプレセンサーI挿入モチーフが、2つのHsp100分解酵素、細菌ClpBおよび酵母Hsp104の活性にいかに寄与し得るかを論じた(Chang et al.)。 彼らは、これらの構造要素が、AAA+ ATPaseサイクルとClpBとHsp104の中央チャネルを横切る基質の移動をどのように結合させるかについてのモデルを提唱している。 ポリペプチドの移動のこのプロセスは、ClpBとHsp104が凝集構造からポリペプチドを抽出する方法を支えていると考えられている(Chang et al. 彼らは、これら3つのAAA+タンパク質(ClpA、ClpB、Hsp104)が、その6量体複合体を通してポリペプチドを移送する能力について論じている。 これらのタンパク質はすべて2つのAAA+ドメインを持ち、タンパク質を展開することが知られている。 重要なことは、ClpBとHsp104が分解酵素として機能することも知られており、ClpAがClpPプロテアーゼと複合体を形成することも知られている。 著者らは、これらのモータータンパク質の動力学的メカニズムを調べるために、過渡状態動力学的手法を用いる必要性を強調している。 例えば、ClpAは約20 aa s-1でポリペプチドを輸送するが、ClpPプロテアーゼと複合体を形成すると、ClpAの輸送速度は約35 aa s-1とさらに速くなることを、このような方法を用いて示すことができたと述べている。 また、ClpB/Hsp104の機能におけるHsp70シャペロンの重要性、Hsp70とClpB/Hsp104の相互作用における種特異性の観察についても述べている。
「Mutant Analysis Reveals Allosteric Regulation of ClpB Disaggregase」という研究論文では、Frankeらが大腸菌ClpB分解酵素の突然変異解析を行ってアロステリック制御について特徴付けを行っている (Franke et al.). ClpBは、N-末端ドメインと、M-ドメインと呼ばれるヘリカル領域によって分けられた2つのAAA+ドメインに分けることができる。 著者らは、第一AAA+ドメインに高度に保存された残基A328を同定している。 ClpB-A328V変異体は、非常に高いATPase活性を持ち、細胞毒性を示すことがわかった。 予想に反して、ClpB-A328Vの高いATPase活性は、アミド水素交換質量分析法により評価したところ、主に第二AAA+リングに起因していた。 著者らは、A328がClpBの両方のAAA+リングにおけるATP加水分解を制御する上で重要な残基であると結論付けた。
「ClpBとHsp104による基質判別」と題した研究論文で、JohnstonらはDnaKおよびHsp70シャペロンシステムがない場合のClpBおよびHsp104の生来の基質選択について述べた (Johnston et al.). 彼らは、基質特異性は各タンパク質の最初のAAA+ドメインによって決定されることを示している。 彼らは、2つのシャペロンがいくつかのモデル基質に対して作用する能力をテストすることによって、この結論に到達した。 彼らはまた、2つのシャペロンの異なるキメラをテストした。
「Hsp78(78kDa熱ショックタンパク質)、Saccharomyces cerevisiaeのミトコンドリアマトリクスで見つかった代表的なAAAファミリーメンバー」において、AbrahãoらはHsp78の構造と機能に関して述べている(Abrahao et al.)。 Hsp78はHsp104のミトコンドリアパラログであり、タンパク質の分解と再活性化に機能している(Abrahao et al.)。 不思議なことに、Hsp104とHsp78は、原生動物からメタゾアへの移行に伴って失われた(Abrahao et al.)。 しかし、Abrahaoらは、原生動物においてHsp78やHsp104と一緒に現れ、メタゾアへの進化的移行を生き抜いたANKCLPの存在について論じている。 ANKCLPは、Hsp104やHsp78のヌクレオチド結合ドメイン2(NBD2)と類似したAAA+ドメインを持つが、それ以外は大きく異なっている。 興味深いことに、ANKCLPの変異は、ヒトにおいて、3-メチルグルタコン酸尿症、進行性脳萎縮、知的障害、先天性好中球減少症、白内障、運動障害を引き起こす(Abrahao et al.)。
p97
彼らのレビュー「Structure and Function of p97 and Pex1/6 Type II AAA+ Complexes」において、Saffertらは、ユビキチン化基質タンパク質をリモデルする二つの異なるAAA+複合体について論じている(Saffert et al.) p97の1つの機能は、ER関連分解の際に、ユビキチン化基質をER膜からプロテアソームへ移動させることである(Saffert et al.)。 一方、Pex1/Pex6はPex1とPex6サブユニットが交互に並ぶヘテロ六量体モーターであり、ペルオキシソームの生合成と機能に必須であると考えられている。
A Mighty ‘Protein Extractor’ of the Cell: Structure and Function of the p97/CDC48 ATPase と題したレビューで、Ye らは、p97 の構造と機能およびいくつかの病気におけるその役割に関する現在の知識をまとめている (Ye et al.). また、異なるアダプタータンパク質との相互作用を媒介するN-末端ドメインも持っている。 著者らは、p97の構造と、その異なるコンフォメーションに対するヌクレオチドの効果について、詳細な議論を展開している。 これらの研究は、EM、X線結晶学、高速原子間力顕微鏡などの技術に基づくものである。 次に、この高度に保存されたタンパク質の多細胞での機能、例えば、ER関連タンパク質分解(ERAD)、ミトコンドリア外膜からポリペプチドを抽出するミトコンドリア関連分解(MAD)、リボソーム関連分解(RAD)におけるその役割について論じている。 最後に、Yeらは、IBMPFD(Inclusion Body Myopathy associated with Paget’s disease of the bone and Frontotemporal Dementia)]、FALS(familial amyotrophic lateral sclerosis)、CMT2Y (Charcot-Marie-Tooth disease, type 2Y)、HSP(Hereditary Spastic Paraplegias)、PD (Parkinson’s disease) およびAD (Alzheimer’s disease) などいくつかの人間の病気につながるp97突然変異の概要を提供している。
The Interplay of Cofactor Interactions and Post-translational Modifications in the Regulation of the AAA+ ATPase p97と題したp97に関するレビューにおいて、HänzelmannおよびSchindelinは、異なる補因子がp97 ATPaseの活性をいかに調節するかについて述べている(HanzelmannおよびSchindelin)。 彼らは、p97が多数の細胞内プロセスに関与する能力は、このタンパク質と相互作用する多数の補因子によるものであるという事実を強調している。 彼らは、p97の補因子として3つの異なるクラス、すなわち、p97の補因子を解明した。 (UBA-UBXタンパク質やUFD1-NPL4などの基質リクルート型補因子、ユビキチン(E3)リガーゼやデユビキチン化酵素(DUB)などの基質処理型補因子、UBXタンパク質などp97ヘキサマーの隔離やリサイクルを行う制御型補因子の3種類を解明している。 また、p97の活性、補因子や基質との相互作用における翻訳後修飾の役割についても議論している。 は,真核生物のプロテアソームのAAA+ATPaseであるRpt1,Rpt2,Rpt3,Rpt4,Rpt5,Rpt6と,その近縁種のPAN,Mpa,VATなどの活性をレビューしている(Yedidi et al.)。 彼らは、これらのAAA+ ATPアーゼが、フォールディングされていないポリペプチドをプロテアーゼのタンパク質分解室に移動させることによって、どのように機能するかを理解するための新しい技術に焦点を当てている(Yedidi et al)。 AAA+リングと隣接するチャンバー型プロテアーゼ内の構造変化が、基質を分解するために送り出す蠕動ポンプ機構を生み出しているようです(Yedidi et al.)。 は、プロテアソームAAA+タンパク質が、低速だが非常に処理能力の高いモーター機構を用いて、基質をプロテアソームのタンパク質分解キャビティに送り込むことを立証している(Snoberger et al.)。 この機構は、ClpXと対照的で、ClpXは高速だが処理能力の低いモーター機構を用いて、基質を分解するためにClpPプロテアーゼに送り込む。 このようなモーター機構の違いは、それぞれの顧客の異なる要求に応えて進化してきたのかもしれない。 Bhatらは、「Rubisco Activases: AAA+ Chaperones Adapted to Enzyme Repair」と題したレビューで、Rubisco Activase (Rca) のRubiscoのリモデリングにおけるユニークな機能について述べている (Bhat et al.)。 Rcaは、バクテリアから高等植物に至るまで光合成生物に高度に保存されているAAA+シャペロンである。 RubiscoはRibulose-1,5-bisphosphate carboxylase/oxygenase enzymeで、光合成の際に大気中のCO2を固定する役割を担っている。 地球上で最も多く存在するタンパク質であり、地球上のあらゆる有機物の合成に関わる重要な酵素である。 しかし、Rubiscoは貧弱な酵素であり、その触媒反応の副産物や、一部の植物が低照度下で合成する化合物によって容易に阻害される。 Rcaは、このような問題ある阻害からRubiscoを緩和する、あるいは「治療」する機能を持つ。 著者らは、異なる種のRcaの構造とその機能の潜在的なメカニズムについて論じている。
Mueller-Cajar博士は、”The Diverse AAA+ Machines that Repair Inhibited Rubisco Active Sites” (Mueller-Cajar) についてのレビューを提供した。 彼はRubisco activases (Rcas)の進化的に異なる3つのクラスの存在について論じている。 (1) 緑色および赤色プラスチド系の光合成真核生物に多く存在する緑色および赤色タイプRcas、そして(3) 化学栄養細菌に存在するCbbQOである。 また、これらの活性化酵素の進化や、植物のルビスコ活性を高めるための合成生物学への応用の可能性についても論じている。 Chaseらは、”Harnessing Dynamic Instability for Function “という展望記事で、酵母Hsp104のNBD2とも系統的に関連するトルシンについて述べている(Chase et al.) トルシンとは、小胞体と連結した核膜の内部に局在する唯一のAAA+ ATPアーゼである(Chase et al)。 興味深いことに、TorsinAの変異は、ヒトの神経疾患であるDYT1ジストニアを引き起こす(Chase et al.) トルシンAは弱いATPase活性を示すが、特定のアクセサリー補因子であるLAP1およびLULL1との共集合により活性部位が補完され、活性が増強される(Chase et al.)。 Chaseらは、トルシン/補因子複合体の動的な組み立てと分解が、核輸送と核膜孔複合体の組み立てにおけるその機能において重要な役割を果たすことを示唆している(Chaseら)。
Pontin and Reptin
The Role of Pontin and Reptin in Cellular Physiology and Cancer Etiologyに関する広範囲なレビューにおいて、MaoとHouryが、非常に保存されたPontinとReptin AAA+ ATPasesの多機能を論じている(Mao and Houry)。 この2つのタンパク質は、通常、複合体として一緒に機能するが、独立して機能することもできる。 著者らは、クロマチンリモデリングにおけるPontinとReptinの役割に焦点を当てている。 また、PontinとReptinが、MYCやβ-cateninなどのいくつかのがん原遺伝子の転写活性をどのように調節しているかも論じている。 MaoとHouryは、PontinとReptinが、PIKKシグナル伝達複合体、テロメラーゼ、有糸分裂紡錘体、RNAポリメラーゼII、snoRNPsの構築に必要であることが判明したことを解明している。 著者らは、新規抗癌剤として開発されるPontinとReptinの阻害剤を特定することを目的とした現在の取り組みの概要で締めくくられている。 現在進行中のクライオ電子顕微鏡革命(Egelman, 2016)の間に、この分野がどのように発展していくのか、私たちは期待している。 クライオ電子顕微鏡によって、これらの魅力的な分子機械が多様な状況でどのように作動するのか、より深い理解が可能になると期待しています(Gates et al., 2017; Puchades et al, 2017)。
Author Contributions
記載されたすべての著者は、この仕事に対して実質的、直接的、知的な貢献をし、出版を承認しています。
利益相反声明
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
謝辞
この領域におけるホワイトの研究室の仕事は、カナダ保健研究所研究プロジェクト助成金(PJT-148564)によって資金提供されている。 JSはNIHグラントR01GM099836の支援を受けています。
Egelman, E. H. (2016). Cryo-EMの現在の革命。 Biophys. J. 110, 1008-1012. doi: 10.1016/j.bpj.2016.02.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Erzberger, J.P., and Berger, J.M. (2006). AAA+タンパク質の進化的関係と構造的メカニズム。 Annu. Rev. Biophys. Biomol. Struct. 35, 93-114. doi: 10.1146/annurev.biophys.35.040405.101933
PubMed Abstract | CrossRef Full Text | Google Scholar
Finn, R. D., Attwood, T. K., Babbitt, P. C., Bateman, A., Bork, P., Bridge, A. J., and al. (2017).を参照。 2017年のInterPro-beyond protein family and domain annotations. Nucleic Acids Res. 45, D190-D199. doi: 10.1093/nar/gkw1107
PubMed Abstract | CrossRef Full Text | Google Scholar
Gates, S. N., Yokom, A. L., Lin, J., Jackrel, M. E., Rizo, A. N., Kendsersky, N. M., et al(2017).の記事。 AAA+分解酵素Hsp104のラチェット状ポリペプチドのトランスロケーション機構。 Science 357, 273-279. doi: 10.1126/science.aan1052
PubMed Abstract | CrossRef Full Text | Google Scholar
Hanson, P.I., and Whiteheart, S.W. (2005). AAA+ タンパク質:エンジンがあれば、仕事はできる。 Nat. Rev. Mol.Cell Biol. 6, 519-529. doi: 10.1038/nrm1684
PubMed Abstract | CrossRef Full Text | Google Scholar
Olivares, A.O., Baker, T.A. and Sauer, R.T. (2016). バクテリアのAAA+プロテアーゼとタンパク質リモデリングマシンに関するメカニズム的洞察。 Nat. Rev. Microbiol. 14, 33-44. doi: 10.1038/nrmicro.2015.4
PubMed Abstract | CrossRef Full Text | Google Scholar
Puchades, C., Rampello, A. J., Shin, M., Giuliano, C. J., Wiseman, R. L., Glynn, S.E., et al. (2017). ミトコンドリア内膜AAA+プロテアーゼYME1の構造から、基質処理に関する知見が得られた。 Science 358:eaao0464. doi: 10.1126/science.aao0464
PubMed Abstract | CrossRef Full Text | Google Scholar
Ripstein, Z. A., Huang, R., Augustyniak, R., Kay, L. E., and Rubinstein, J. L. (2017). 基質をアンフォールディングする過程のAAA+アンフォールダーゼの構造。 Elife 6:e25754. doi: 10.7554/eLife.25754
PubMed Abstract | CrossRef Full Text | Google Scholar
Snider, J., Thibault, G., and Houry, W.A. (2008). 機能的に多様なタンパク質であるAAA+スーパーファミリー。 Genome Biol. 9:216. doi: 10.1186/gb-2008-9-4-216
PubMed Abstract | CrossRef Full Text | Google Scholar
Zehr, E., Szyk, A., Piszczek, G., Szczesna, E., Zuo, X. and Roll-Mecak, A. (2017)(2019. Katanin spiral and ring structures shed light on power stroke for microtubule severing.カタニンのスパイラルとリングの構造は、微小管切断のパワーストロークに光を当てる。 Nat. Struct. Mol. Biol. 24, 717-725. doi: 10.1038/nsmb.3448
PubMed Abstract | CrossRef Full Text | Google Scholar
.