はじめに
セロトニン(5-ヒドロキシトリプタ-ン)|Serotonin (5-hydroxytryptamine, 5-HT)2C受容体(5-HT2CR)は脳内に広く分布し、不安、睡眠、ホルモン分泌、摂食行動、運動活性、さらに学習・記憶プロセスに対する5-HTの調節作用を媒介します(Bagdy, 1998; Chagraoui et al., 2016). 5-HT2CRの機能不全は、不安やうつ病などの病的状態に関与している(Chagraoui et al., 2016; Di Giovanni and De Deurwaerdere, 2016)。 一方、多数の抗うつ薬、抗不安薬、抗精神病薬は5-HT2CRに親和性を有しており、これらの薬剤の治療効果に関与していると考えられる(Bagdy et al, 2001; Chagraoui et al, 2016; Di Giovanni and De Deurwaerdere, 2016)。 したがって、5-HT2CRは、いくつかの神経精神疾患の治療における有望な薬理学的標的である(Chagraoui et al, 2016; Di Giovanni and Deurwaerdere, 2016)。
5-HT2CRの刺激は不安を生じさせ、その結果、SB-242084などのサブタイプ選択的5-HT2CR-アンタゴニストは著しい抗不安作用を及ぼすことが記載されている(Dekine et al, 2000; Bagdy et al, 2001; Kantor et al.、2005)。 選択的5-HT2CR-拮抗薬RS-102221およびSB-242084は、マウスにおいて速効性の抗うつ様効果をもたらした(Opalら、2014年)。 また、5-HT2CR-拮抗薬は、選択的セロトニン再取り込み阻害薬(SSRI)であるフルオキセチンの抗不安および抗うつ効果を増強し、さらに、マウスの運動副作用を軽減した(Demirevaら、2018年)。 重要なことは、5-HTとドーパミン(DA)系の相互作用がこれらの効果に寄与することが示唆されている(De Deurwaerdere and Di Giovanni, 2017)<7701><6910>覚醒時と睡眠時の脳波上の様々なパラメータは、うつ病のバイオマーカーや抗うつ薬の個別化治療の指標になると言われている(Steiger and Kimura, 2010)。 ガンマ振動は、脳波の比較的高い周波数(>30 Hz)成分であり、神経細胞集団のダイナミクスに関する重要な手がかりを与える(Buzsaki and Wang, 2012)。 ガンマ振動は、動物やヒトの感覚・認知機能、神経可塑性や記憶と関連している(Cardin, 2016)。 一方、異常なガンマ活性は、いくつかの精神疾患と関係しています(Cardin, 2016)。 うつ病の病理メカニズムにガンマが関与していることを示唆する証拠が増えていることに基づき、ガンマ振動の変化は、最近、大うつ病の新しいバイオマーカー(またはエンドフェノタイプ)として、さらには抗うつ薬治療のフォローアップのために提案されています(Fitzgerald and Watson, 2018)。 いくつかの抗うつ薬は、ガンマ活性を変化させることが示されている(Fitzgerald and Watson, 2018)。 例えば、SSRIのエスシタロプラムは、急性期の治療では急速眼球運動睡眠(REMS)中のガンマパワーを減少させ、慢性期のエスシタロプラムは徐波睡眠段階でのガンマパワーを増加させることがわかっている(Papp et al.、2018年)。 しかし、異なる警戒段階における薬剤によるガンマ活動の変化が、治療作用の指標または原因メディエーターであるか、あるいは副作用の兆候であるかは、まだ未解決の問題である(Fitzgerald and Watson, 2018)
我々の知識によれば、ヒトおよび齧歯類のガンマ振動に対する選択的5-HT2CR-拮抗薬の効果に関する文献には隙間が存在する。 そこで、ここでは、(i)高選択性5-HT2CR拮抗薬SB-242084の急性投与、(ii)広く用いられているSSRIエスシタロプラムの慢性投与、(iii)およびそれらの併用により、警戒段階ごとにガンマ出力(30-60 Hz)がどのように変化するかを調べた。
方法
地元の動物施設 (Semmelweis University, Budapest, Hungary) から購入したWistar雄ラットが実験に使用された。 動物は制御された環境条件下(21±1℃,12/12時間明暗サイクル,午前10時点灯)で飼育され,標準的なげっ歯類の餌と水道水を自由に利用できるようにした。 すべての飼育条件および動物実験は、EU指令2010/63/EUおよび米国国立衛生研究所「実験動物ケアの原則」(NIH出版物番号85-23、改訂1985)、ならびに特定の国内法(動物実験に関するハンガリー政府規則40/2013)に従って実施された。 実験は、動物実験に関する国立科学倫理委員会によって承認された。 動物の痛みと不快感を最小限に抑えるためにあらゆる努力が払われた。
脳波(EEG)および筋電図(EMG)電極は、先に述べたように2%ハロタン麻酔下で埋め込んだ(Jakusら、2003年)。 ラットの体重は手術時に250-280gであった。 EEGは、左前頭葉(L: 2.0 mm, A: 2.0 mm to bregma)、左頭頂葉(L: 2.0 mm, A: 2:0 mm to lambda)、小脳(グラウンド電極)にステンレス製のスクリュー電極を硬膜外から挿入した。 EMGについては、一対のEMG電極(シリコンゴムで覆われたステンレス製スプリング電極、Plastics One Inc.、Roanoke, VA, USA)を頸部の筋組織に設置した。 回復後(7日間)、ラットはケージの上に固定された記録ケーブルと電動スイベルによってEEGシステムに接続された。
慢性前処置として、ラットに浸透圧ミニポンプ(2ML4, ALZET, 2.5 μl/h, DURECT Corporation, USA)を介して10 mg/kg/dayのescitalopram-oxalate溶液 (ESC Gedeon Richter Plc., Hungary; 0.3 N HCl in distilled waterの溶液)かvEH (0.3N HCl in distilled waterの溶液)を21日間投与した。 21日目に、ラットに1mg/kgのSB-242084またはビヒクルを1ml/kg体重の容量で腹腔内注射を行った。 ラットを以下のようにランダムに4群に分けた。 VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6), ESC+SB (n = 6).
EEG, EMG, 運動活性は注射後少なくとも3時間、光の入射から記録されました。 信号はアナログフィルター(Coulburn Lablinc System, USA;0.50Hz以下と100Hz以上を6dB/オクターブでフィルタリング)で増幅し、サンプリングレート128Hzでアナログ→デジタル変換(MVRD-2200 V, Canopus, Japan)に供した。 7701>
Sleep Sign for Animal (Kissei Comtec America Inc., USA) ソフトウェアの自動採点機能により、4秒ごとのポリグラフ記録を採点し、目視で確認した。 従来の基準(Kantor et al., 2004)に基づき、以下のように6つの警戒段階を区別した(代表的な痕跡は補足図1参照)。 能動的覚醒(AW)では、脳波は、激しいEMGと運動活性に加えて、ベータ(14-29 Hz)とアルファ(10-13 Hz)周波数での低振幅の活動によって特徴づけられる。 受動的覚醒(PW)では、脳波パターンはAWと同様であり、比較的高いEMG活動を伴い、運動活動は最小限か全くない。 軽度の徐波睡眠(SWS-1)では、脳波は紡錘体(6-15 Hz)で中断された高振幅の徐波皮質波(0.5-4 Hz)が特徴で、EMG活動の低下と運動活性を伴うことはない。 深部徐波睡眠(SWS-2)では、脳波は連続した高振幅の徐波皮質波に支配され、EMGは減少し、運動活動はない。 REMSの前後に多く発生する中間期睡眠(IS)では、脳波は高振幅の紡錘波とシータ波(5-9Hz)の連合によって特徴づけられる。 REMSでは、脳波は、無音の筋電図と時折筋収縮(痙攣)を伴う運動活動に加え、規則的なシータ波を伴う低振幅・高周波の活動によって支配される。 アーチファクトで汚染されたエポックや警戒段階間の移行を含むエポックは破棄した。
定量的EEG(qEEG)分析は、高速フーリエ変換(ハニング窓、周波数分解能0.25Hz)により0.5〜60Hzの周波数範囲で連続した4秒間のエピックを計算した。 隣接する0.25Hzのビンを合計して1Hzのビンとし、その上限をマークした。 AW、PW、SWS-1、SWS-2、IS、REMSの各エポックのパワー値を、それぞれ処理後3時間、あるいは1時間目、2時間目、3時間目に平均化し、これらの睡眠覚醒段階のパワー密度値を得た。 本報告では、脳波パワースペクトルの30-60Hzの周波数帯域に注目した。 電気ネットワークからの50Hzの干渉ノイズの混入を避けるため、49-51Hz以内のデータは解析から除外した。 すべてのデータは解析前に対数変換した。
パワースペクトル解析については、群間の比較は2つの主因子:治療(非反復)およびガンマ周波数ビン(反復)を用いた反復測定に関する二元配置分散分析によって行い、その後ボンフェローニ・ポストホック検定を行った。 各時間における治療効果を調べるために、要約された30-60Hzのパワーデータ(49-51Hzのものを除く)は、AW、PW、SWS-1、SWS-2、IS、REMSそれぞれについて、一元配置分散分析を用いて解析された。 有意な主処置効果の検出後、ポストホックニューマン-キールズ検定を実施した。 p < 0.05のとき統計的有意性が認められた。
我々の実験デザインでは、対照ラット(VEH+veh)は薬剤投与ラットと同じ処置にさらされることになった。 このように、薬剤投与群と対照群の比較は、注射やミニポンプの存在による苦痛を最小限に抑え、薬剤の効果を検討することを目的としている。 スペクトルグラフでは、視認性を高めるために(脳波のパワーデータは周波数が高くなると減少する傾向にあるため)、薬剤投与ラットのパワー値を対照群(VEH+veh群)のパワースペクトルの平均値で正規化し、相対データを表示した。 絶対値データは、パワー値をまとめた棒グラフで示した。 データは1群6匹の平均±SEMで表した。
結果
受動相の最初の3時間のパワーデータを平均して、6つの警戒段階について30-60Hzガンマ領域のqEEGに対する薬剤(急性SB-242084、慢性エスカチオラムおよびそれらの併用)の影響を個別に評価した(図1)。 解析の結果、すべての薬剤がこの周波数帯域において、VEH+veh群と比較して、各ステージで上昇する傾向を示し、警戒ステージに依存した変化を引き起こすことが明らかになった。
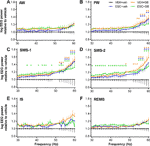
Figure 1 受動相の最初の3時間に急性期のSB-242084(VEH+SB)、慢性期のescitalopram(ESC+veh)およびそれらの組み合わせ(ESC+SB)を投与後のガンマ周波数範囲(30〜60Hz)における脳波パワー変化を示す。 パワースペクトルは、以下の6つの警戒段階において示した。 (A)活動的覚醒(AW)と受動的覚醒(PW)、(C)軽睡眠(SWS-1)と深徐波睡眠(D)、(E)中間期(IS)と急速眼球運動睡眠(REMS)の6段階のパワースペクトルを示す。 EEGパワーデータは、VEH+veh対照群に対する平均±SEMで示した(各群n = 6匹)。 *コントロールと比較した有意なポストホック結果、p < 0.05。
AW中、ANOVAの結果は有意な変化を示さなかった(処置効果。 治療効果:F3,20 = 1.917, p = 0.1594;治療×頻度相互作用。 F81,540 = 1.218, p = 0.1081; Figure 1A)。 しかし、PW時には、SB群では中程度のパワーラインの上昇が見られ、ESC+veh群でも高い周波数で見られた(治療効果。 F3,20 = 2.217, p = 0.1176;有意な治療 x 周波数の相互作用。
最も顕著な効果は徐波睡眠段階で観察され、急性期のSB-242084、慢性期のエスシタロプラム、および複合治療がパワーの上昇を引き起こした。 これは、SWS-1における有意なANOVA結果によって支持された(治療効果。 SWS-1における有意なANOVA結果(治療効果:F3,20 = 3.692, p = 0.0290;有意な治療×頻度相互作用。 図1C)、およびSWS-2(有意な治療効果。 F3,20 = 4.787, p = 0.0113;有意な処理 x 頻度相互作用。 F81,540 = 1.911, p < 0.001; 図1D)。
IS中のガンマパワーの増加は有意ではなかった(治療効果。 F3,20 = 2.349, p = 0.1031、治療 x 周波数の相互作用。 F81,540 = 1.241, p = 0.0878;図1E)。 最後に、REMSの間、急性SB-242084も慢性エスシタロプラムも、この周波数域のEEGパワーに影響を与えなかった(治療効果。 F3,19 = 2.515, p = 0.0891; 治療 x 周波数の相互作用。 F81,513 = 1.226, p = 0.1014;図1F)。 ESC+SB群では、1頭がこの時間間隔においてREMSで時間を過ごさなかったため、n=5頭のみのデータを用いたことに留意されたい。
上記の有意な二元配置分散分析の結果に続く有意なボンフェローニのポストホックの差については、各警戒ステージについて図1を参照されたい。 VEH+SB対ESC+veh、VEH+SB対ESC+SB、ESC+veh対ESC+SBの比較については、いずれのステージにおいても、それぞれ有意なポストホック差は見られなかった。
総ガンマパワーに対する薬剤の睡眠覚醒ステージ依存的な効果については、毎時間分析を行った。 一元配置分散分析により、SWS-1の1時間目では治療効果はまだ有意ではなかったが(F3,20 = 2.544, p = 0.0851)、2時間目(F3,20 = 3.331, p = 0.0403) と3時間目(F3,20 = 4.607, p = 0.0131 )にはパワー上昇が有意であることが明らかになった。 SWS-2 では、ANOVA により、各 h において有意な処理効果が認められた (F3,18 = 4.062, p = 0.0228; F3.20 = 5.348, p = 0,0072; F3,20 = 4.910, p = 0.0102, それぞれ)。 また、ISの2時間目には有意な効果が認められたが(F3,20 = 3.452, p = 0.0360)、1、3時間目には認められなかった。最後に、AW、PW、REMSではこれらの時間には有意な治療効果は認められなかった。 有意なポストホック結果については、各警戒段階について図2を参照。
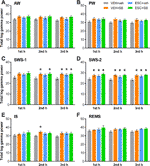
Figure 2 急性期のSB-242084(VEH+SB)、慢性期のエスシタロプラム(ESC+veh)、およびそれらの組み合わせ(ESC+SB)を投与した後のガンマ周波数領域(30-60 Hz)における総電波パワーは第1、第2時間に見られた。 受動相の2時間目、3時間目、(A)能動覚醒(AW)と受動覚醒(PW)、(C)軽睡眠(SWS-1)と深徐波睡眠(D)、(E)中間期(IS)、(F)急速眼球運動睡眠(REMS)中であった。 EEGパワーデータの要約は平均±SEMで示した(各群n = 6匹)。 *対照群(VEH+veh)と比較した有意なポストホック結果、p < 0.05。
考察
これは、異なる警戒段階における脳波スペクトルのガンマ周波数帯に対する選択的5-HT2CR-antagonist SB-242084の急性作用を調査した最初の研究である。 さらに、慢性的なSSRIの前処理を行った場合と行わない場合の試験も行った。 ここでは、ラットの急性期SB-242084(1 mg/kg、ip.)投与後のSWS-2、SWS-1、PW中のガンマバンドパワーの増強について報告する。 さらに、21日間のエスシタロプラム(10 mg/kg/day、浸透圧ミニポンプ)前処置の結果、SB-242084は慢性抗うつ薬治療によって変化したガンマパワーをさらに変化させないことが明らかになった。 さらに、SB-242084の急性効果とエスシタロプラムの慢性効果は、ほとんどの警戒段階において、ガンマパワーに非常に類似しているように思われた。 しかし、これら2つの治療の組み合わせによる効果は、相加的なものとは考えられなかった。
ガンマ活性に関連する脳機能については、序章で述べたとおりである。 ガンマ振動は、新皮質、内嗅皮質、海馬、視床、扁桃体、嗅球、線条体など、脳の複数の領域で報告されている。 その発生には、体細胞周囲の抑制、中でもγ-アミノ酪酸(GABA)Aシナプスを介したパーバルブミン陽性介在ニューロンの活動が関係しています(Buzsaki and Wang, 2012)。 ガンマ振動はうつ病に重要な役割を果たすと考えられており、このことはヒトと動物の両方の知見から支持されています。 すなわち、うつ病患者においてガンマの異常が測定され、また、うつ病の動物モデルにおいても、ガンマの変化が治療的回復と関連している(Khalidら、2016;Nodaら、, 2017; Fitzgerald and Watson, 2018)。
うつ病の様々な薬理学的治療(セロトニン、ノルアドレナリン、ドーパミン、グルタミン酸系を標的とする)及び非薬理学的治療は、ガンマ活性を変化させることがわかっている(Fitzgerald and Watson, 2018)。 例えば、セロトニン作動系に作用するSSRI抗うつ薬として広く用いられているエスシタロプラムは、急性投与によりREMS時のガンマパワーを減少させる一方、慢性投与により徐波睡眠期のガンマパワーを増加させることがラットで示されています(Papp et al.) 重要なのは、レボキセチンやデシプラミンなどのノルアドレナリン系に作用する抗うつ薬は、急性投与後に海馬中隔系でガンマ(シータと同様に)パワーを増加させたが、SSRIのフルボキサミンは同じ試験でそのような効果を発揮できなかったことだ(Hajos et al, 2003a)。 ケタミンやその代謝物(2R,6R)-ヒドロキシノルケタミンのような次世代の抗うつ剤とされるものは、抗うつ剤に相当する用量を適用すると、ガンマパワーを顕著に高めることが示されてきた。 これらの効果、またそれらの抗うつ薬様作用は、α-アミノ-3-ヒドロキシ-5-メチル-4-イソキサゾールプロピオン酸受容体(AMPAR)阻害剤による前処理によって防止された(Zanos et al.、2016)。 最後に、FitzgeraldとWatsonは最近、彼らの仮説によれば、すべてのクラスの抗うつ剤が辺縁系回路に共通の最終的な効果を有する可能性があるため、ガンマシグナリングがすべてのクラスの抗うつ剤の効果のバイオマーカーとなり得ることを提案している(Fitzgerald and Watson,2019)。
本研究では、5-HT系に作用する薬剤、すなわち5-HT2CRのアンタゴニストと、5-HT-トランスポーターを介したシナプス再取込みを阻害して5-HTの細胞外レベルを増加させる作用を主作用とするSSRIについて検討しました。 選択的5-HT2CR拮抗薬の効果はまだ臨床試験で検証されていませんが、5-HT2CR拮抗薬がうつ病や不安障害の治療に有益な効果をもたらす可能性を示唆する証拠が増えつつあります。 5-HT2CR拮抗薬とSSRIの併用の重要性を裏付けるものとして、ラットのマイクロダイアリシス研究において、選択的5-HT2CR拮抗薬SB-242084またはRS-102221とSSRIのシタラムの急性同時投与は、うつ病性障害の病態生理に関与する領域におけるシタラム誘発の5-HTレベルの上昇を増大させた(Cremersら、2004年)。 また、SB-242084の前処理により、ラットの急性シタロプラムによる恐怖発現の増強が逆転した(Burghardtら、2007年)。 さらに、最近の論文では、マウスにおいて、慢性(21日間)フルオキセチン投与後の急性SB-242084投与が不安・うつ様行動を軽減し、SSRI誘発性の副作用を改善することが示されている(Demireva et al, 2018)。
本研究では、かつてのネズミの行動(Kennett et al., 1997; Martin et al., 2002; Opal et al., 2014)および睡眠および/または脳波(Popa et al., 2005; Sorman et al., 2011; Bogathy et al., 2019)研究に基づいて、1 mg/kg SB-242084投与量が選択された。 重要なのは、Kantorらが、Sprague-Dawleyラットにおいて、0.3及び1.0 mg/kgの用量は同様の抗不安作用をもたらしたが、高用量のみが睡眠覚醒アーキテクチャに顕著な影響(SWS-2の減少を伴う目覚まし促進効果)を与えたことを実証している(Kantorら, 2005年)。 また、Wistarラットの1mg/kg投与でREMS減少作用が認められ、AW中やREMS中のシータパワーの上昇も観察された(Kostyalik et al.、2014)。
脳機能や関連振動活動、神経伝達物質レベルがステージ間で特徴的な違いを示すことから、警戒ステージにおいてSB-242084とescitalopramのガンマ活性に対する影響を個別に分析した。 集中的な注意、認知、感覚処理など覚醒に関連する機能におけるガンマ振動の役割はよく知られているが(Cardin, 2016)、睡眠中の機能的重要性はあまり理解されていない。 REMS中、記憶の定着における(シータを超えた)ガンマ振動の役割が示唆されている(Montgomery et al.、2008)。 最近の論文では、ある領域の位相的REMS微小状態におけるガンマパワーの増加が、ヒトの場合、感情処理と関連していることが提案されています(Simor et al.、2019)。 非REMS時、ガンマ振動は、低速振動時の神経活動の位相的増加に関連している可能性があります(Valderrama et al.、2012)。 サルとヒトの微小電極研究は、非REMS時のガンマ(およびベータ)振動の役割をさらに強調しており、すなわち、高い振動コヒーレンスは、非REMS時の記憶定着へのガンマの寄与a contributionを示唆している(Quyen et al.)。
我々は、SB-242084の単回投与が、SWS-2、SWS-1、および-より少ない程度-PW中にガンマパワーを上昇させ、REMS、IS、およびAW中には上昇しないことを見いだした。 このように、5-HT系は睡眠覚醒行動(Monti, 2011)や脳振動の重要な調節因子と考えられてきたが、これらのプロセスに関与する細胞機構や受容体は複雑であり、十分に解明されていない(Puig and Gener, 2015)。 5-HTそれ自体は、5-HT2CRではなく、5-HT1ARおよび5-HT2ARを介してラット前頭前野のガンマ活性に影響を与え、その結果、麻酔下のラットにおいて全体的に振幅が減少することが分かっている(Puigら、2010年)。 さらに、高速スパイクする介在ニューロンの同期におけるDA系の重要性を支持する証拠が増えつつあり、その結果、ガンマ振動を生成/制御している (Furth et al., 2013)
5-HT2CR は、おそらく脳内で最も広く分布する5-HT受容体サブタイプである。 多くの部位のGABA作動性介在ニューロンで報告されており、DAニューロンでも発現している。 しかし、この受容体サブタイプは、5-HTおよびノルアドレナリン作動性(NA)ニューロンでは発現していない。 モノアミン作動性、および興味深いことにDA系の調節における5-HT2CRの役割は、いくつかの前臨床研究によって強調されている(Di Giovanni and De Deurwaerdere, 2016; De Deurwaerdere and Di Giovanni, 2017)。 特定の脳領域における5-HT2CRの局所刺激は、領域依存的に不安を生じさせ、その結果、SB-242084のようなサブタイプ選択的5-HT2CR-アンタゴニストは、著しい抗不安作用を発揮した(Bagdyら、2001; Di Giovanni and De Deurwaerdere, 2016)。 いくつかの抗不安薬および抗うつ薬は、5-HT2CRアンタゴニスト特性を有し、例えば、多数の三環系抗うつ薬、ミアンセリン、ミルタザピン、トラゾドン、ネファゾドン、フルオキセチン、およびアゴメラチン(マーティンら、2014)である。 一方、選択的5-HT2CR拮抗薬は、前臨床試験に基づいて、推定速効性抗うつ薬として示唆されている(Opal et al., 2014)<7701><6910>5-HT2CR拮抗薬の定性的(睡眠覚醒構造に影響)及び定量的(パワースペクトル、すなわち振動に影響)睡眠覚醒作用に関していくつかの研究が発表されており、特にSB-242084は、その効果が注目されている。 Kantorらは、ラットにおける不安、警戒、30Hz以下のEEGスペクトルに対するSB-242084の用量依存的な効果を調査した。 彼らは、0.1mg/kgの用量でも、覚醒時のシータパワーの増加(シータ活性は学習および記憶プロセスに関連しているため、認知機能増強効果の可能性を示唆している)を見いだした。 一方、1mg/kg投与時のみ、受動相の最初の1時間で覚醒度が上昇し、SWS-2が抑制された。 覚醒時、REMS時、SWS-1時、SWS-2時のデルタ、アルファ、ベータ周波数帯については、本論文で有意な変化は報告されていない(Kantor et al.) Kostyalik らは、SB-242084 が PW 時間を延長し、REMS を抑制することを報告しているが、この効果は ESC の慢性前処置により減弱された。 qEEGについては、AW中およびREMS中にシータパワーの増強が認められ、エスシタロプラムの慢性的な前処理によってさらに変化することはなかった(Kostyalikら、2014年)。 5-HT2CR-拮抗薬のシータ増強効果、したがってシータ活動の調節における5-HT2CRの役割は、Hajosら(2003b)によって支持されている。
ヒトおよびげっ歯類の睡眠覚醒構造およびEEGパラメータに対するエスシタロプラムおよび他のSSRIの効果は、より広範囲に研究されている(Wilson and Argyropoulos, 2005; Vas et al, 2013; Fitzgerald and Watson, 2019)。 最近、我々はラットへの急性(REMS中の減少)および慢性(SWS-1およびSWS-2中の上昇)投与後のガンマパワー変化を報告した(Papp et al., 2018)
興味深いことに、SB-242084の急性作用は慢性escitalopramによるものと類似し、言い換えれば、5-HT2CRに対する選択的アンタゴニズムによって5-HT-トランスポーターおよび追加効果の慢性ブロックがエスカイトランプが及ぼすガンマ活性に対する同様の作用がもたらされた。 その場合、5-HTの効果、すなわち5-HT1AR(およびおそらく5-HT2ARも)の脱感作は、私たちが以前の論文(Papp et al., 2018)で提案したように、それらの段階におけるガンマパワーの増加を説明することができると推定される<7701><6910>私たちの結果を説明するには、5-HT2CRが5-HT、NA、および重要なDAニューロン活性を調節できることを考慮に入れておくべきである<ディジョバンニおよびデ・デュールワエルデール、2016年)。 5-HT2CRの定常的な活性は、DAニューロン活性に抑制的な制御を及ぼすことが報告されており、これは5-HT2CR拮抗薬の全身投与によって逆転されることがわかった。 SB-242084とSB-206553は、ラット脳のDA神経支配領域において、基礎DA放出を有意に増強した。 しかし、SB-242084で誘発されるDA放出はSB-206553と比較して小さく、最大値に達した(De Deurwaerdereら、2004)。 興味深いことに、SSRIもDA作動性シグナルを調節することが示唆されている(このことは、今回調査した2つの薬物の共通の特徴の可能性を示しているかもしれない)が、利用可能な文献データはあいまいである。 急性期のエスシタロプラムは腹側被蓋野のニューロンの発火率とバーストを増加させることが報告されているが(Schilstromら、2011)、別の研究では、麻酔下のラットにおいて、2週間にわたるエスシタロプラムの投与がこれらのニューロンの発火率とバーストを減少させることが示されている(Dremencovら、2009)<7701><6910>この研究の結果はいくつかの限界という文脈で解釈すべきです。 SB-242084は1回のみ投与され、本剤のガンマ増強作用が用量依存的であるかどうかは検証していない。 さらに,公称サンプリングレートによるナイキスト限界のため,我々の解析は最大60Hzに制限されており,より速いガンマ周波数,高周波振動(HFO)およびリップルを調べるにはさらなる研究が必要である。
総合すると,我々の発見は急性SB-242084と慢性エスシタロプラムがガンマ活性に対して同様の効果を示したことを示しており,急性または短期の5-HT2CR拮抗薬の治療が抗うつ作用を持つかもしれないという非臨床(および間接臨床)エビデンスを支持している。 従って、我々の研究は、5-HT2CR-拮抗薬がうつ病や不安症の治療に有益であるという証拠をさらに提供するかもしれない。 ガンマ活性の変化が治療薬の作用のマーカーであるか、治療効果のメディエーターであるかは未解決の問題であり、さらなる研究が必要である。
Data Availability Statement
The datasets generated and analyzed during this study is not publicly available due to creating future publication, but is available from the corresponding author upon reasonable request.The data sets are upgraded in research.
Ethics Statement
すべての飼育条件および動物実験は、EU指令2010/63/EUおよび国立衛生研究所「実験動物飼育の原則」(NIH出版物第85-23、改訂1985)、ならびに特定の国内法(動物試験に関するハンガリー政府規則40/2013)に従って実施された。 実験は、動物実験に関する国立科学倫理委員会によって承認され、政府によって許可された(中央農務局フードチェーン安全および動物衛生総局、許可番号22.1/1375/2010)
Author Contributions
GB と TK は実験を設計した。 DK、SV、PPが実験手順を実行した。 GB、DK、SV、NPはデータ解析に貢献した。 NP、SK、SV、GBは結果を解釈した。 NP、SK、GBは原稿の第一稿を執筆した。 最終原稿は全著者が読み、承認した。
Funding
この研究は、国家開発庁(KTIA_NAP_13-1-2013-0001)ハンガリー脳研究プログラム(助成番号:Grant No. KTIA_13_NAP-A-II/14)、NAP 2.0(Grant No.2017-1.2.1-NKP-2017-00002); Semmelweis大学ITM/NKFIH Thematic Excellence Programme、およびEMMIのSE-神経FIKP助成金によって行われた。
Conflict of Interest
著者らは、本研究が潜在的な利益相反と解釈される商業的または金銭的関係がない状態で実施されたことを宣言している。
謝辞
実験および/またはデータの分析にご協力いただいたZita Kátai氏とEmese Bogáthy氏に感謝します。
補足資料
この論文の補足資料は、以下のサイトに掲載されています。 https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G, Graf, M., Anheuer, Z. E., Modos, E. A., Kantor, S. (2001). fluoxetine、sertraline、m-CPPの急性投与により誘発される不安様作用は、5-HT2C受容体拮抗薬SB-242084の前処理により逆転するが、5-HT1A受容体拮抗薬WAY-100635の前処理は逆転しない。 Int. J. Neuropsychopharmacol. 4 (4), 399-408. doi: 10.1017/S1461145701002632
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagdy, G. (1998). セロトニン、不安、ストレスホルモン。 5-HT受容体サブタイプ、種差、性差に着目して。 Ann. N. Y. Acad. Sci. 851, 357-363. doi: 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L. , Vas, S. , Bagdy, G. (2019). 睡眠覚醒周期の調節に対する5-HT2CおよびCB1受容体遮断の相加効果。 BMC Neurosci. 20 (1), 14. doi: 10.1186/s12868-019-0495-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., LeDoux, J. E. (2007). 急性選択的セロトニン再取り込み阻害剤は条件付恐怖発現を増加させる:5-HT(2C)受容体アンタゴニストによる阻害。 Biol. Psychiatry 62 (10), 1111-1118. doi: 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X.J. (2012). ガンマ振動のメカニズム. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
PubMed Abstract | CrossRef Full Text | Google Scholar
Cardin, J. A. (2016). Snapshots of the brain in action: Local circuit operations through the lens of gamma oscillations(動作中の脳のスナップショット:ガンマ振動を通じた局所的な回路動作)。 J. Neurosci. 36 (41), 10496-10504. doi: 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). 精神疾患における5-HT2C受容体:レビュー。 Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi: 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A.、他 (2004).The 5HT2C receptors in psychiatric disorders: review. 5-HT(2C)受容体の不活性化は、セロトニン再取り込み阻害の結果を増強する。 Neuropsychopharmacology 29 (10), 1782-1789. doi: 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Di Giovanni, G. (2017). セロトニン作動性による中脳ドパミン作動性システムの活性調節:治療的意義。 Prog. Neurobiol. 151, 175-236. doi: 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W.P., Spampinato, U. (2004). セロトニン2C受容体の恒常的活性は、ラット線条体および側坐核におけるin vivoドーパミン放出を抑制する。 J. Neurosci. 24 (13), 3235-3241. doi: 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M.J. (2000). Citalopramはセロトニン(5-HT)(2C)受容体の活性化により、ラットの社会的相互作用を低下させる。 Neuropharmacology 39 (6), 1114-1117. doi: 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al.(2018).の項を参照。 5-HT2C受容体遮断は、SSRIに関連する基底核機能不全を逆転させ、治療効果を増強する。 Mol. Psychiatry. doi: 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., De Deurwaerdere, P. (2016). 精神神経疾患における5-HT2C受容体リガンドの新たな治療機会. ファーマコル. Ther. 157, 125-162. doi: 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). ラット腹側被蓋野のドーパミンニューロンの発火に対する持続的なセロトニン再取り込み阻害の効果。 J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). 大うつ病のバイオマーカーとしてのガンマ振動:新たなトピック。 Transl. Psychiatry 8 (1), 177. doi: 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). 抗うつ薬の効果を示すin vivo電気生理学的記録。 Exp. Brain Res. 237 (7), 1593-1614. doi: 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth,K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). ドーパミン、認知機能、およびガンマ振動:D4受容体の役割。 Front. Cell Neurosci. 7, 102. doi: 10.3389/fncel.2013.00102
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W.E., Robinson, D.D., Yu, J.H., Hajos-Korcsok, E. (2003a). ノルエピネフリンではなくセロトニン再取り込み阻害剤が海馬septo系のシータおよびガンマ活性を増強する。 Neuropsychopharmacology 28 (5), 857-864. doi: 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Weaver, R. J. (2003b). 5-hydroxytryptamine(2C)受容体による中脳海馬の活動制御。 J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi: 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., and al. (2003). 欠神てんかんの遺伝的ラットモデルにおいて、5-HT2C受容体はスパイク波放電の発生を抑制し、5-HT1A受容体は活性化することを示した。 Exp. Neurol. 184 (2), 964-972. doi: 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S.Jakus, R.Balogh, B.Benko, A.Bagdy, G. (2004). サブタイプ選択的拮抗薬SB-215505による5-HT2B受容体の遮断後の覚醒度、運動活性の上昇とシータ活性の減少。 Br. J. Pharmacol. 142 (8), 1332-1342. doi: 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S.Jakus, R.Molnar, E.Gyongyosi, N.Toth, A.Detari, L.ら (2005). 5-hydroxytryptamine2C受容体拮抗薬SB-242084 indoline]とchlordiazepoxideは、同様の抗不安作用にもかかわらず、脳波パワースペクトルに差違効果を生じた。 J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi: 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G.A., Wood, M.D., Bright, F., Trail, B., Riley, G., Holland, V., et al. SB 242084, a selective and brain penetrant 5-HT2C receptor antagonist(選択的脳内受容体拮抗薬). Neuropharmacology 36 (4-5), 609-620. doi: 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung,K. H., Chu, K., et al. (2016). マウスの慢性拘束ストレスによって誘発される抑うつ行動の自然寛解には、脳機能ネットワークにおけるガンマ振動が関与している。 BMC Neurosci. 17, 4. doi: 10.1186/s12868-016-0239-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E.ほか, (2014).(2014). エスシタロプラムの慢性投与は、レム睡眠、覚醒およびシータ波活動におけるセロトニン(5-HT)2C受容体拮抗誘発効果に解離性適応を引き起こした。 Exp. Brain Res. 232 (3), 935-946. doi: 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., Higgins, G. A. (2002). 5-HT2C受容体拮抗薬SB-242084の不安検査における影響。 Pharmacol. Biochem. Behav. 71 (4), 615-625. doi: 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin,C. B., Hamon, M., Lanfumey, L., Mongeau, R. (2014). 抗うつ薬の作用機序における5-HT(2C)受容体の役割に関する論争. Neurosci. Biobehav. Rev. 42, 208-223. doi: 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008年). 覚醒時および急速眼球運動睡眠時の海馬ネットワークのシータとガンマの協調。 J. Neurosci. 28 (26), 6731-6741. doi: 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). 睡眠覚醒行動のセロトニン制御。 Sleep Med. Rev. 15 (4), 269-281. doi: 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). うつ病患者における高周波左背外側前頭前野rTMS後の安静時脳波ガンマパワーとシータ・ガンマ結合の増強。 Clin. Neurophysiol. 128 (3), 424-432. doi: 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D.ほか (2014). セロトニン2C受容体拮抗薬は速効性の抗うつ作用を誘発する。 Mol. Psychiatry 19 (10), 1106-1114. doi: 10.1038/mp.2013.144
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018).セロトニン 2C 拮抗薬は、抗うつ効果の速やかな発現をもたらす。 急性および慢性のエスシタロプラムは脳波ガンマ振動を異なる形で変化させる:治療効果との関連性。 Eur. J. Pharm. Sci. 121, 347-355. doi: 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P.ら (2005). 5-HT2受容体サブタイプの睡眠覚醒および呼吸制御への寄与、および5-HT2A受容体欠損ノックアウトマウスの機能適応。 J. Neurosci. 25 (49), 11231-11238. doi: 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). Serotonin modulation of preronto-hippocampal rhythms in health and disease(健康と疾患における海馬前部リズムのセロトニン調節)。 ACS Chem. Neurosci. 6 (7), 1017-1025. doi: 10.1021/cn500350e
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig,M. V., Watakabe,A., Ushimaru,M., Yamamori,T., Kawaguchi,Y. (2010). セロトニンは5-HT1Aおよび5-HT2A受容体を介して、ラット前頭前野の高速スパイク型介在ニューロンおよび同期活動を調節する。 J. Neurosci. 30 (6), 2211-2222. doi: 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M.L. V., Muller, L.E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al (2016). 覚醒-睡眠サイクル中のヒトとサルの新皮質における高周波振動。 Proc. Natl.Acad. Sci. U. S. A. 113 (33), 9363-9368. doi: 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M. , et al. S-citalopram、citalopram、R-citalopramが腹側被蓋野のドーパミンニューロンの発火パターン、内側前頭前野のN-methyl-D-aspartate受容体による伝達、ラットの認知機能に対して及ぼす影響。 Synapse 65 (5), 357-367. doi: 10.1002/syn.20853
PubMed Abstract | CrossRef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Kovacs, I. (2019年).(英語). 位相性微小状態と緊張性微小状態における振動活動と皮質同期に照らした急速眼球運動睡眠のパラドックス(The paradox of rapid eye movement sleep in the light of oscillatory activity and cortical synchronization during phasic and tonic microstates). Neuroimage 202, 116066. doi: 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D. , Hajos, M. , Kocsis, B. (2011). セロトニンによる海馬のシータリズムの制御:5-HT2c受容体の役割。 Neuropharmacology 61 (3), 489-494. doi: 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). 覚醒・睡眠脳波はうつ病のバイオマーカーとなる。 J. Psychiatr. Res. 44 (4), 242-252. doi: 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C.他 (2012). 徐波睡眠中のヒトのガンマ振動。 PloS One 7 (4), e33477. doi: 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P.、他 (2013)(2012). 慢性治療後のエスシタロプラムのレム睡眠潜時、中間期、シータパワー効果の適応の違い。 J. Neural Transm. (Vienna) 120 (1), 169-176. doi: 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). 抗うつ薬と睡眠:文献の質的レビュー。 Drugs 65 (7), 927-947. doi: 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P.J., Georgiou, P., Fischell, J., Elmer, G. I., et al(2016)。 ケタミン代謝物のNMDAR阻害非依存性抗うつ作用。 Nature 533 (7604), 481-486. doi: 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar
.