Introduction
自然療法の利用は古くから現在も行われており、>世界人口の60%が、がんも含めた様々な健康問題に伝統医学を第一選択として取り組んでいます(Sultana et al.、2014). しかし、がん治療は複雑であり、患者さんの年齢、性別、全身の健康状態に加え、がんの種類やステージによって現在の可能性が異なります。 化学療法は通常、がんの初期段階で成功しますが、その効果は薬剤の投与方式と患者の生理状態に左右されます。 しかし、化学療法の最大の懸念はその毒性であり、使用される薬剤はがん細胞だけでなく正常細胞にも作用し、高い増殖指数を持つため、患者さんに付随するダメージを与える可能性があります。 また、がん細胞は治療抵抗性を獲得し、転移を起こすため、治療効果が低下し、無病生存の可能性が低くなります。 そのため、創薬における重要な課題の1つは、化学療法剤の毒性をなくし、治療、回復時間、および患者の全体的な生活の質を改善する、より効果的で効率的な薬剤を開発することである
天然物は、抗がん剤治療の開発において、化学構造の豊富な情報源を提供してきました。 腫瘍薬学の分野では、化学療法で採用されている薬剤の49%が、植物、微生物、海洋生物などの天然源に由来するか、それに触発されています(Newman and Cragg, 2016)。 例としては、ポドフィロトキシン、アントラサイクリン、エトポシド(トポイソメラーゼ阻害剤)に加え、ビンカアルカロイドやタキサン(チューブリン結合剤)などがあります(Da Rochaら、2001; Nobiliら、2009)。 これらの例は、創薬における天然物の可能性を示している。
AA類は、アンノーン科(図1)が産生する二次代謝産物である。 伝統医学では、アンノナ属の果実は発熱、痛み、リューマチ、下痢、関節炎の治療に、その葉は糖尿病、頭痛、不眠症に用いられている(Moghadamtousi et al.、2015a)。 Annona reticulateはアフリカで抗下痢症や抗蠕虫治療薬として採用されており、A. squamosaはインドで悪性腫瘍を含む様々な症状の治療に使用されている(Savithramma et al.、2011)。 さらに,A. muricataはアメリカ,アフリカ,インドで癌の治療薬として普及しており(Moghadamtousi et al., 2015a),メキシコではA. macroprophyllata,A. muricata,A. purpureaが皮膚腫瘍や胃癌の治療薬として使用されています(Alonso-Castro et al., 2011; Brindis et al.、2013)。 メキシコの薬用植物の民族薬理学的レビューによると、Annona属はまた、大腸癌の治療のために探索され得る(Jacobo-Herrera et al.、2016)。 この証拠は、AAが重要な生物活性の可能性を有する分子であることを示している<5268><3975><1239><6346>図1アセトジェニン核:線状、エポキシ、モノテトラヒドロフラン(THF)、ビスTHF、およびトリスTHF。
現在までに500以上のAAが記載されている。これらの化合物は、α、β-不飽和γ-ラクトン環および0-3テトラヒドロフラン(THF)環を有する長い脂肪族鎖によって特徴付けられる(Yuan et al, 2015)、異なるヒト癌細胞株(すなわち、肺、乳房、結腸、腎臓、膵臓、前立腺、肝臓、および膀胱)に対する細胞毒性活性を示している(総説:Zeng et al, 1996; Chávez and Mata, 1998; Wang et al., 2002; Yuan et al., 2003; Mangal et al., 2016; Miao et al., 2016a; Miao et al., 2016b)以外にin vivo抗腫瘍活性(Chen et al., 2012a;Chenら, 2012b)。 ここでは、創薬-がん領域におけるAAに関する最新の報告をレビューする。
Materials and Methods
以下のキーワードでPubMedデータベースで検索を行った。 「アセトジェニンとがん」、「アセトジェニンの抗腫瘍活性」、「アセトジェニンの細胞毒性」、「アセトジェニンの作用機序」などを組み合わせて検索しました。 過去15年間に発表された論文のうち、「薬用植物」と「バイオアッセイガイド分画法」の2つの基準で検討した結果、「薬用植物」が最も多く、「バイオアッセイガイド分画法」が最も多かった。 5268>
Results and Discussion
In Vitro Studies
天然物の分野では、生物活性分子の探索は、活性を担うマスター分子または分子を見つけるために抽出物のバイオアッセイガイド分画を伴う傾向がある。 しかし、多くの二次代謝産物は、癌の複数の特徴をターゲットにすることができる。 一般に、製薬業界では、複数の分子相互作用を示し、さまざまな分子標的を包含する薬剤に関心があります。
アセトジェニンは、将来のがん治療に大きな可能性を持つ分子です。 その最も顕著な生物学的活性は、bis-THF構造によるミトコンドリア複合体Iの阻害である。 実際、ラクトン部位とTHF基を結ぶアルキル鎖を有するモノTHF AAsは、呼吸鎖の複合体I(すなわち、NADH:ユビキノン酸化還元酵素)の非競合的阻害剤であり、リン酸化の阻害とそれに続くATP産生の減少をもたらすことが既に報告されている(Tormoら、1999;Chenら、2012)。 このような阻害は、アポトーシスおよびオートファジーを含む細胞死を誘導し、または乳酸脱水素酵素A酵素の阻害剤として、抗酸化剤として、または細胞周期を停止させることによって他の代謝ネットワークに作用し得る経路の大きなグループを含む
さらに、A. muricata(Moghadamtousi et al, 2015a)およびA. squamosa L. (Chen et al., 2012a; Chen et al., 2012b; Chen et al., 2012c; Chen et al., 2016)は、いくつかのヒトまたは他の哺乳類の癌細胞株に対して細胞毒性活性を有すると報告されている。 特に、AAであるアノスクアチンA(1)およびB(2)は、それぞれMCF-7およびA-549細胞株に対して選択性を示す(Chen et al.、2012c)。 表 1 は、細胞毒性活性を示す最も最近発見された AA に加えて、in vivo で抗腫瘍活性を示す他のあまり最近の化合物 (表 2) を示しています。
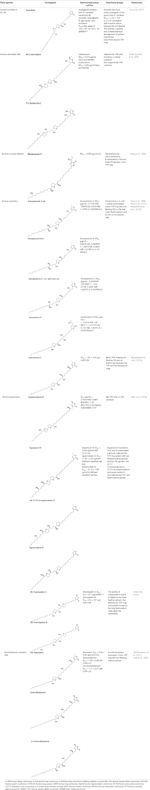
Table 1 異なる癌細胞株におけるアセトジェニン類の細胞毒性活性 in vitro.

Table 2 アセトジェニンおよびアセトジェニンを豊富に含む抽出物の生体内での抗腫瘍活性
アポトーシスとは、不要または損傷した細胞を殺す自然死の戦略のことです。 このプロセスに関与する主な遺伝子は、p53とbcl2ファミリーです。前者は腫瘍抑制因子であり、後者はプロアポトーシス(特にBAD、BAX、BAK)またはアンチアポトーシス(bcl2、bcl-x)のいずれかになります(岡田とマック、2004年)。 p53の主な機能は、DNA損傷を受けた細胞の複製を阻止することである。 そのため、p53が不活性になると、損傷を受けた細胞は増殖を続け、DNAの変異を複製して、がんなどの病気を引き起こす(Igney and Krammer, 2002; Okada and Mak, 2004)。 このように、これまでの研究は、アポトーシス誘導とアポトーシス耐性機構の2つに大別されます。
現在のアポトーシス誘導化学療法は、患者さんに重篤な二次的影響を及ぼします。 そのため、より毒性の低い薬剤の探索が優先されており、天然物はアポトーシスを調節する薬剤の開発を助けると期待されています。 その中で、AAsはカスパーゼ3および8(アポトーシスエフェクター)の活性をアップレギュレートし、一方でサバイビンやBcl-2の発現をダウンレギュレートすることでアポトーシスを促進させることが知られています。 AAであるannonacin(3)はカスパーゼ3およびBax経路を活性化することでがん細胞のアポトーシスを促進し(Yuan et al.、2003)、squamocinは膀胱T24がん細胞においてプロアポトーシス遺伝子BaxおよびBadの発現により、PARPが切断されカスパーゼ3の活性が上昇し、アポトーシスを誘導する(Yuan et al.) これは、スクアモシンが乳がん細胞においてアポトーシスを誘導せず、G1期の細胞周期を阻害することで増殖を抑制したという以前の結果と対照的である(Raynaud et al., 1999)。
A. reticulataのメタノール抽出物は結腸および肝がん細胞においてカスパーゼ6および9の発現を阻害する (Mondal et al., 1999)。 2007)、A. squamosaの有機および水性抽出物は乳がん細胞MCF-7および白血病細胞K-562のBcl-2の発現を低下させ、アポトーシス誘導剤としての効果を示す(Pardhasaradhiら、2005)。 また、A. muricataの葉抽出物は、MIA PaCa-2細胞においてカスパーゼ3および9の発現を誘導し、phospho-ERKおよびphospho-AKTを低下させて細胞増殖を抑制する(Yiallouris et al., 2018)
AAsは周期停止ももたらし、腫瘍細胞の増殖に関与していることが示されている。 AAsは、ヒト肝細胞癌細胞においてサイクリンD1の発現を阻害することにより、G1/S遷移における細胞周期を制御する(Qian et al.、2015)。 この文脈では、A. muricata抽出物は、細胞周期の重要な制御タンパク質であるサイクリンD1の発現を低下させることにより、濃度依存的に細胞周期をG1期で停止させ、S期の細胞数を減少させる(Torres et al.、2012)。 同様の結果は、T24膀胱癌細胞においてG1期に細胞を停止させるスクアモシンでも観察された(Yuan et al.、2006年)。 細胞周期の関連性にもかかわらず、AAがこの機構にどのように影響するかを扱った研究はほとんどない。
酸素のない状態でエネルギーを得るために腫瘍細胞が用いる機構である好気性解糖(Figueroa-Gonzálezら、2016;García-Castilloら、2017)も、AAの標的である。 腫瘍の好気性解糖に関与する重要な転写因子であるHIF-1により、がん細胞では様々なタンパク質や解糖酵素がアップレギュレートされる。 興味深いことに、A. muricata抽出物は、膵臓がん細胞において、HIF-1αおよびNF-κBの発現、グルコーストランスポーターGLUT1およびHKIIとLDHA酵素のレベルを低下させました(Torres et al.) また、A. muricataの葉抽出物は、がん細胞株において抗増殖作用を示し、NKAポンプおよびSERCAポンプの阻害により細胞死を促進しました(Yiallouris et al, 2018)。一方、MDR1遺伝子は、抗がん剤を細胞内から押し出す重要なトランスポータータンパク質である細胞膜糖タンパク質Pをコードしており、これにより細胞内への蓄積を制限し毒性を低下させる(Figueroa-Gonzálezら、2012)。 フラボノール、ジンセノサイド、ポリフェノール、アルカロイド、樹脂配糖体などの二次代謝産物は、がん細胞株におけるP-gpを調節する興味深い結果を示している(Phang et al., 1993; Beck et al., 1988; Silva et al., 2001; Jodoin et al., 2002; Zhou et al., 2004; Figueroa-González et al., 2012)。 さらに、AAは、薬剤耐性ヒト肝細胞癌におけるMDR1およびMRP1遺伝子の発現、ならびにトポイソメラーゼIIαおよびグルタチオンSトランスフェラーゼの発現をダウンレギュレートできる(Qianら、2015)
近年、オートファジーは細胞死のメカニズムとして関心を集めていた。 オートファジーは、真核細胞が細胞の飢餓や病原体の存在などのストレス下にあるときに活性化する異化プロセスである(He and Klionsky, 2009)。 このプロセスの間、細胞は、最終的に細胞の恒常性を回復するために、リソソーム分解を含む多段階のプロセスでタンパク質または非機能性オルガネラを再利用します(Kenific and Debnath, 2015)。 このように、高分子、非機能性オルガネラ、およびタンパク質のリサイクルは、細胞増殖のための高い代謝要件をがん細胞に与えるため、オートファジーフラックスの調節不全は、がんにつながる可能性があります(Kenific and Debnath, 2015; García-Castillo et al.、2017)。 このシナリオでは、オートファジーは魅力的な治療標的となっており、AAsはこのプロセスを阻害することができるかもしれません。 Liuら(2012)は、化合物AA005(アセトゲニンアナログ)がATP産生を阻害し、AMPKを活性化し、mTOR Complex 1経路をブロックして最終的に結腸癌細胞にオートファジーを誘導し、細胞周期をG1期に停止させることを報告しました。 この化合物は、2つのTHF環の代わりにエチレングリコールエーテルユニットを用いた、AAsの模倣品である。 5268>
Antitumor Activity of Acetogenins in Animal Models
AAs とAnnona抽出物の抗がん活性に関するデータは、これらの化合物が動物モデルで抗腫瘍活性を示したことから特に有望であると考えられています。 生体内での研究は、生物全体における薬剤の性能に関する重要な情報を提供し、抗腫瘍効果だけでなく、異なる臓器における毒性も評価することができます。 5268>
AAs 12,15-cis-squamostatin-A (4) と bullatacin (5) を豊富に含む A. squamosa の酢酸エチル抽出物は、陽性対照 (cyclophosphamide) に対して最大 69.55% の抑制率で、マウスにおける肝細胞腫瘍の成長を抑制しました (Chen et al.)。 2012b). これは、成分の1つにおけるシス配置が、ハーブ調剤の細胞毒性活性に関与している可能性が示唆された。 さらに、A. squamosa から単離された bullatacin (5) は、15 μg/kg の用量で、S180 と HepS 異種移植片を持つマウスの腫瘍成長をそれぞれ 65.8 と 63.4% 効果的に減少させた。 これらの結果は、より高濃度のタキソール(40μg/kg)を使用して得られた結果よりも優れています。 Bullatacin(5)は、隣接するbis-THF部位と3つのヒドロキシ基を有し、これが生物活性構造を構成すると考えられる(Chenら、2012a)。
A. squamosaの種子油はH22細胞を有するマウスの腫瘍成長を53.54%抑制し(Chenら、2016)、IL-6、Jak、様々なリン酸化シグナルトランスデューサーおよび転写活性因子p-Stat3経路の発現量を減少させた。 また、AAに存在するα、β-不飽和γ-ラクトン部位はマイケル反応受容体であり(Ji et al., 2012)、細胞増殖、アポトーシス、炎症、血管新生に関わる治療標的であるStat3活性化を阻害することが報告された(Cafferkey and Chau, 2016)。 A. muricataの抽出物は、膵臓異種移植片における腫瘍の成長を遅くした(Yiallouris et al., 2018)、メタロプロテアーゼ-9のレベルを低下させることによる転移の抑制、ネクローシスによるがん細胞の死滅の促進(Torres et al.) 前立腺異種移植片では、フラボノイドで濃縮したA.ムリカタ抽出物は、AAで濃縮した抽出物よりもバイオアベイラビリティを改善し、低い毒性を示した(Yang et al., 2015)。
ラヘラドゥリン(6)およびチェリモリン2(7)が薬草A. diversifoliaから分離され、子宮頸および大腸癌細胞に対してin vivo試験された(Schlie-Guzmán et al., 2009)。 両AAは、ドキソルビシンと同程度の値でHeLa腫瘍のサイズを縮小した。両化合物はまた、同じ癌細胞株に対してin vitroで抗増殖活性を発揮した。 これらの結果は、最も活性の高い分子が、隣接するbis-THF部位とβ-hydroxy γ-methyl γ-lactone構造を有するlaherradurin(6)であると報告された他の報告と一致している。一方、隣接しないbis-THF部位とγ-lactoneユニットを含むcherimolin-2(7)は抗腫瘍活性を低下させている。 表2は、動物モデルにおける様々なAAの抗腫瘍活性の概要を示している。
毒性試験
動物を用いた実験では、化学物質を試験し、毒性の兆候を観察するために、急性経口毒性プロトコルを含むべきである。これにより、必要な動物の数を最小限に抑え、実験での正しい用量投与を保証し、苦痛を避ける(OECD、2008)。 しかし、現在までのところ、AAsやアンノナ抽出物の毒性に関する情報はほとんどない。 例えば、Sousaら(2010)によると、A. muricataのエタノール抽出物のマウスにおけるLD50は1.67 g/kgであった。 Arthurら(2011)は水性抽出物のLD50(<5 g/kg)を報告し、それ以上の投与は腎臓を損傷する可能性があると記録している。 また、A. squamosaの種子抽出物は肝障害を引き起こす可能性があることが観察され(Miaoら、2016b)、フラボノイドに富むA. muricata抽出物は、前立腺異種移植において低減した毒性を示した(Yangら、2015年)。 A. diversifoliaから単離されたCherimolin-2は、5mg/kg/日を超える用量でSW480異種移植片に毒性作用と死亡を示した(Schlie-Guzmán et al., 2009)
前に説明したように、AAsはミトコンドリアにおける電子鎖輸送を介して呼吸鎖の複合体1を阻害することが可能である。 AAsは、通常がん細胞で過剰発現しているNADH酵素と結合してブロックし、ATP産生を阻害し、最終的に細胞死に至らせるのです。
結論
化学療法はがん細胞に特異的ではなく、正常な組織や臓器にダメージを与えるなど、いくつかの望ましくない副作用を引き起こします。 しかし、従来の化学療法の最も重要な側面は、かなりの数のケースで、がん細胞が腫瘍の進行と転移を可能にする耐性メカニズムを開発することです。
自然界における新薬の探索は新しいものではありません。 現在、天然物質のいくつかの誘導体が、さまざまな病気の治療に使われている。 例えば、伝統的な知識によって発見されたタキソール(パクリタキセル)は、市場で最も収益性の高いがん治療薬とされています。 興味深いことに、パクリタキセルは細胞培養では細胞増殖を抑制する抗力剤ですが、腫瘍では多極化を誘導することが証明されており、これは分子がin vitroや患者の状態によっていかに異なる作用機序を持ち得るかを示しています。 このアルカロイドは30年の歴史があり、天然物を使用する際の主な障害である、生物学的な利用可能性の制限や生産コスト、またがん細胞を殺す驚くべき有効性を示しています。 アセトジェニンは、様々なメカニズムで腫瘍細胞を死滅させる万能の抗がん分子で、がん細胞から化学治療薬を排除する機能を調節し、強力なアポトーシス誘導剤でもあります。 その生物活性の柔軟性は、細胞をG1期に停止させることによる細胞周期の制御、様々なタンパク質の阻害によるアポトーシスの促進、さらにはオートファジーの誘導などの能力に反映されています。 さらに、その代謝的相互作用、特に転写因子HIF1およびSTAT3と関連し、エネルギー消費、血管新生、炎症および転移におけるその反響が際立っている。 AAsのin vivoでの抗腫瘍活性は有望である(bullatacin, laherradurin, cherimolin-2がその例である)。 しかし、前臨床試験データは、AAsの薬理学的および動力学的な理解を得るには十分ではなく、安全性を保証し、ヒトでの臨床試験の可能性を高めるためには、より多くの急性毒性試験や溶解度試験が必要である。 さらに、異なるリガンド(すなわち、抗体、ビタミン、ペプチド)の組み込みや腫瘍特異的な誘導体の調製は、AA活性を向上させ、より適した薬剤を生み出す可能性がある
植物抽出物は化学的に複雑で、その治療効果はしばしば、化合物間の相互作用や抽出物内の割合に依存する。 癌におけるAAsの影響については、まだ多くの発見があります。 この分野は、この複雑な病気の治療のための新しい分子を見つける機会を与えてくれる。 したがって、抽出物の標準化は、特に薬理活性が複数の化合物の組み合わせに基づいている植物において、ハーブサプリメントを使用する代替案となり得るものである。 このミニレビューでは、抗腫瘍活性を示し、癌の臨床研究において将来を期待できる、これまでに研究されたいくつかの AA をリストアップしています。
Funding
この研究は、Consejo Nacional de Ciencia y Tecnología (CONACYT), Mexico (grant number 285884)の支援を受けたものである。 VC-TはCONACYT(PhD助成番号267787)の助成を受けた。
Conflict of Interest Statement
著者らは、本研究が、潜在的利益相反と解釈できるいかなる商業または金銭的関係もない状態で行われたことを宣言している。
謝辞
NJ-H は、プロジェクトに資金を提供してくれたCONACYTに感謝します。
Alonso-Castro, A. J. Villarreal, M. L., Salazar-Olivo, L. A., Gómez-Sánchez, M., Domínguez, F., García-Carrancá, A. (2011). がん治療に用いられるメキシコの薬用植物:薬理学的、植物化学的、民族植物学的研究。 J. Ethnopharmacol. 133, 945-972. doi: 10.1016/j.jep.2010.11.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Arthur, F., Woode, E. , Terlabi, E. , Larbie, C. (2011). 動物におけるAnnona muricata (Linn).水性抽出物の急性及び亜慢性毒性評価. Eur. J. Exp. Biol. 1 (4), 115-124.
Google Scholar
Beck, W.T., Cirtain, M.C., Glover, C.J., Felsted, R.L., Safa, A.R. (1988). インドールアルカロイドの多剤耐性への影響とvinblastineの光親和性アナログによるP-糖蛋白の標識化(Effects of indole alkaloids on multidrug resistance and labeling of P-glycoprotein by a photo affinity analog of vinblastine). Biochem. Biophys. Res. Commun. 153, 959-966. doi: 10.1016/S0006-291X(88)81321-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Brindis, F., González-Trujano, M. E., González-Andrade, M., Aguirre-Hernández, E. , Villalobos-Molina, R. (2013). Annona macroprophyllata の水性抽出物:潜在的な α-グルコシダーゼ阻害剤。 Biomed Res. Int. 443 (2), 495-499. doi: 10.1155/2013/591313
CrossRef Full Text | Google Scholar
Cafferkey, C., Chau, I. (2016). 胃がんを治療するための新規STAT3阻害剤。 Expert Opin. Investig. Drugs 25, 1023-1031. doi: 10.1080/13543784.2016.1195807
PubMed Abstract | CrossRef Full Text | Google Scholar
Chávez,D.,Mata,R. (1998). パープレニオリンとパープレニン、Annona purpureaの種子からの2つの新しい細胞毒性隣接ビス-テトラヒドロフランアノン性アセトジェニン。 J. Nat. Prod. 61, 580-584. doi: 10.1021/np970410
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Xu, S., Wang, Y., Li, X., Cai, B., et al. また、このような環境下において、「環境調和型社会」を実現するためには、「環境調和型社会」の実現が不可欠である。 Bioorg. Med. Chem. 22, 2717-2719. doi: 10.1016/j.bmcl.2012.02.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Sh, Xu, Chen, J., Wang, Y., Xu, H., Fan, N.他 (2012b).Onc. Annonaceous acetogenin compoundsを含むAnnona squamosa種子エキスの抗腫瘍活性。 J. Ethnopharmacol. 142, 462-466. doi: 10.1016/j.jep.2012.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Wang, Y. , Xu, S. , Li, X. (2012c). を用いた細胞毒性アセトジェニンの探索を行った。 Food Chem. 135, 960-966. doi: 10.1016/j.foodchem.2012.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Y., Shi, Y., Ch, Ma, Wang, X., Li, Y.、他 (2016).。 Annona squamosa種子油の抗腫瘍活性. J. Ethnopharmacol. 193, 362-367. doi: 10.1016/j.jep.2016.08.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Da Rocha, A. B., Lopes, R. M., Schwartsmann, G. (2001). 抗がん剤治療における天然物。 Curr. Opin. Pharmacol. 1, 364-369. doi: 10.1016/S1471-4892(01)00063-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Elisya, Y., Kardono, L. B. S., Simanjuntak, P. (2014). サワーソップ(Annona muricata L).の葉の酢酸エチル可溶性抽出物のタブレット製剤化。 AJAS 2 (3), 323-329.
Google Scholar
Figueroa-González, G., Jacobo-Herrera, N., Zentella-Dehesa, A., Pereda-Miranda, R.(2012).:。 ヒト乳癌細胞におけるアサガオ樹脂配糖体による多剤耐性の回復。 J. Nat. Prod. 75 (1), 93-97. doi: 10.1021/np200864m
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueroa-González, G….., García-Castillo, V., Coronel-Hernández, J., López-Urutida, E., León-Cabrera, S., Arias-Romero, L. E., et al. (2016). 大腸炎関連大腸がんに対する3剤併用療法の抗炎症・抗腫瘍活性。 J. Cancer 7 (12), 1632-1644. doi: 10.7150/jca.13123
PubMed Abstract | CrossRef Full Text | Google Scholar
García-Castillo, V…, López-Urutia, E., Villanueva-Sánchez, O., Ávila-Rodríguez, MÁ, Zentella-Dehesa, A., Cortés-González, C., et al. (2017).です。 マウスモデルにおけるトリプルネガティブ乳がんの代謝リモデリングを標的とする。 J. Cancer 8 (2), 178-189. doi: 10.7150/jca.16387
PubMed Abstract | CrossRef Full Text | Google Scholar
He, C., Klionsky, D.J. (2009). オートファジーの制御機構とシグナル伝達経路. Annu. Rev. Genet. 43, 67-93. doi: 10.1146/annurev-genet-102808-114910
PubMed Abstract | CrossRef Full Text | Google Scholar
Igney, F. H., Krammer, P. H. (2002). 死と反死:アポトーシスに対する腫瘍の抵抗性。 Nat. Rev. Cancer 2 (4), 277-288. doi: 10.1038/nrc776
PubMed Abstract | CrossRef Full Text | Google Scholar
Jacobo-Herrera, N.J., Jacobo-Herrera, F. E., Zentella-Dehesa, A., Andrade-Cetto, A., Heinrich, M., Pérez-Plasencia, C.(2016). “Death “と “anti-death “の違い。 メキシコの伝統医学で大腸癌の治療に用いられる薬用植物。 J. Ethnopharmacol. 179, 391-402. doi: 10.1016/j.jep.2015.12.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Ji, L., Yuan, Y., Luo, L., Chen, Z., Ma, X., Ma, Z,など(2012年). 抗炎症活性を有するフィサリンは、Physalis alkekengi var. franchetiiに存在し、マイケル反応受容体として機能することができる。 Steroids 77, 441-447. doi: 10.1016/j.steroids.2011.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Jodoin, J., Demeule, M., Béliveau, R. (2002). 緑茶ポリフェノールによる多剤耐性P糖タンパク質活性の阻害. Biochim. Biophys. Acta 1542 (1-3), 149-159. doi: 10.1016/S0167-4889(01)00175-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenific,C. M., Debnath, J. (2015). がん細胞におけるオートファジーの細胞・代謝機能. Trends Cell Biol. 25 (1), 37-45. doi: 10.1016/j.tcb.2014.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Ko, Y. M., Wu, T. Y., Wu, Y. C. H., Chang, F.r., Guh, J.Y., Chuang, L. Y. (2011). アンノナシンは、MCF-7 細胞において、エストロゲン受容体-α関連経路の細胞周期依存的な成長停止とアポトーシスを誘導する。 J. Ethnopharmacol. 137, 1283-1290. doi: 10.1016/j.jep.2011.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Lima, L. A. R. S., Alves, T. M. A., Zani, C. L., Júnior, P. A. S., Romanha, A. J., Johann, S., et al. (2014). Annona cornifolia A. St.-Hil. から分離したアセトジェニンのin vitro細胞毒性、抗真菌活性、トリパノシダー活性、リーシュマニシダー活性。 (アンノナ科). An. Acad. Bras. Cienc. 86 (2), 829-839. doi: 10.1590/0001-3765201420130048
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Cheng, X., Guo, L. X., Ch, Mao, YJ, Chen, Liu, H. X.、他 (2012)(2012). 大腸がん細胞におけるAMPK活性化およびオートファジー誘導物質としての環状アセトジェニン模倣物質、AA05の同定。 PLoS One 7 (10), e47049-e-47049. doi: 10.1371/journal.pone.0047049
CrossRef Full Text | Google Scholar
Mangal, M., Khan, M.I. , Agarwal, S.M. (2016). 潜在的な抗がん剤としてのアセトジェニン。 Anticancer Agents Med. Chem. 16, 138-159. doi: 10.2174/1871520615666150629101827
CrossRef Full Text | Google Scholar
Miao, Y.J., Shi, Y.Y., Xu, X.F., Chen, Y., Chen, J.W., Li, X. (2016a). Annona squamosaの種子から得られた3種の細胞毒性Annonaceousアセトジェニン. Phytochem. Lett. 16, 92-96. doi: 10.1016/j.phytol.2016.03.006
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Li, F. Q., Shan, C. h. X., Chen, Y., Chen, J. W., et al (2016b). 高速液体クロマトグラフィー高精細度質量分析法とパターン認識法および代謝経路解析法を組み合わせたAnnona Squamosaの毒性に関するメタボロミクス研究. J. Ethnopharmacol. 184, 187-195. doi: 10.1016/j.jep.2016.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Fadaeinasab, M., Nikzad, S., Mohan, G., Ali, H. M., Kadir, H. A. (2015a). Annona muricata (Annonaceae): その伝統的な使用、単離されたアセトジェニンおよび生物学的活性のレビュー。 Int. J. Mol. Sci. 16, 15625-15658. doi: 10.3390/ijms160715625
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Rouhollahi, E., Karimian, H., Fadaeinasab, M., Firoozinia, M., Abdulla, M. A., et al. (2015b). ラットのアゾキシメタン誘発大腸異常クリプト病巣に対するAnnona muricata葉の化学ポテンシャル効果とHT-29細胞におけるアセトジェニンアノムリシンEのアポトーシス効果:バイオアッセイガイドアプローチ. PLoS One 10 (4), e0122288. doi: 10.1371/journal.pone.0122288
PubMed Abstract | CrossRef Full Text | Google Scholar
Mondal, S. K., Mondal, N. B. , Mazumder, U. K. (2007). Annona reticulataの葉のin vitro細胞毒性およびヒト遺伝子組み換えカスパーゼ効果。 インド J. Pharmacol. 39, 253-254. doi: 10.4103/0253-7613.37279
CrossRef Full Text | Google Scholar
Newman, D. J., Cragg, G. M. (2016). 1981年から2014年までの新薬の供給源としての天然物。 J. Nat. Prod. 79 (3), 629-661. doi: 10.1021/acs.jnatprod.5b01055
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobili, S., Lippi, D., Witort, E., Donnini, M., Bausi, L., Mini, E.、他 (2009). 癌の治療と予防のための天然化合物。 Pharmacol. Res. 59, 365-378. doi: 10.1016/j.phrs.2009.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
OECD (2008). 「テキストNo.425:急性経口毒性:アップダウン手順” OECD Guildelines for the testing of chemicals, Section 4. OECDiLibrary. https://www.oecd-ilibrary.org/environment/test-no-425-acute-oral-toxicity-up-and-down-procedure_9789264071049_en
Google Scholar
Okada, H., Mak, T. W. (2004). 腫瘍細胞におけるアポトーシス死と非アポトーシス死の経路。 Nat. Rev. Cancer 4 (8), 592-603. doi: 10.1038/nrc1412
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardhasaradhi, B. V., Reddy, M., Ali, A. M., Kumari, A. L., Khar, A. (2005). ヒト腫瘍細胞株に対するAnnona squamosa種子抽出物の異なる細胞毒性効果:活性酸素種とグルタチオンの役割. J. Biosci. 30, 237-244. doi: 10.1007/BF02703704
PubMed Abstract | CrossRef Full Text | Google Scholar
Phang, J. M., Poore, M., Lopaczynska, J., Yeh, G. C. (1993). 多剤耐性乳癌細胞におけるフラボノール刺激による7,12-ジメチルベンズ(a)アントラセンの排出。 Cancer Res. 53, 5977-5981.
PubMed Abstract | Google Scholar
Qian, J. Q., Sun, P., Pan, Z. Y., Fang, Z. Z. (2015).フラボノールによる7,12-ジメチルベンズ(a)アントラセンの排出促進。 Annonaceous acetogenins reverse drug resistance of human hepatocellular carcinoma BEL-7402/5-FU and HepG2/ADMセルライン.アンノーンアセトゲニンは薬物耐性を回復させる。 Int. J. Clin. Exp. Pathol. 8 (9), 11934-11944.
PubMed Abstract | Google Scholar
Raynaud, S., Némati, F., Miccoli, L., Michel, P., Poupon, M. F., Fourneau, C., et al.(1999).。 親細胞株および多剤耐性MCF7(ヒト乳腺癌)細胞株に対するスクアモシンの抗腫瘍効果。 Life Sci. 65 (5), 525-533. doi: 10.1016/S0024-3205(99)00273-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Savithramma, N., Rao, M. L., Suhrulatha, D. (2011). 二次代謝産物に関する薬用植物のスクリーニング。 MEJSR 8 (3), 579-584.
Google Scholar
Schlie-Guzmán, M. A., García-Carrancá, A., González-Esquinca, A. R. (2009).を参照。 このような状況下において、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」の一環として、「震災復興に向けた取り組み」を行うこととした。 Phytother. Res. 23, 1128-1133. doi: 10.1002/ptr.2760
PubMed Abstract | CrossRef Full Text | Google Scholar
Silva, G. L., Cui, B., Chávez, D., You, M., Hee-Byung, C., Rasoanaivo, P., et al. Erythroxylum pervillei 由来の新しいトロパンアルカロイド芳香族エステルによる多剤耐性表現型の調節。 J. Nat. Prod. 64 (12), 1514-1520. doi: 10.1021/np010295+
PubMed Abstract | CrossRef Full Text | Google Scholar
Sousa, O. V., Vieira, G. D., Pinho, JJRGd, Yamamoto, C. H., Alves, M. S. (2010). Annona muricata L.葉のエタノール抽出物の動物モデルにおける抗侵害受容および抗炎症活性. Int. J. Mol. Sci. 11 (5), 2067-2078. doi: 10.3390/ijms11052067
PubMed Abstract | CrossRef Full Text | Google Scholar
Sultana, S., Asif, H. M., Nazar, H. M. I., Akhtar, N., Rehman, J. U., Rehman, R. U.(2014年). 癌と闘う薬用植物-緑の抗癌剤のアプローチ。 アジアン・パック。 J. Cancer P 15 (11), 4385-4394. doi: 10.7314/APJCP.2014.15.11.4385
CrossRef Full Text | Google Scholar
Tantithanaporn, S., Wattanapiromsakul, C., Itharat, A., Keawpradub, N. (2011). Goniothalamus undulatus Ridl.根抽出物から分離したアセトジェニンとスチリルラクトンの肺がん細胞株(COR-L23)に対する細胞毒性活性。 Phytomedicine 18, 486-490. doi: 10.1016/j.phymed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Tormo, J. R., Gallardo, T., Aragón, R., Cortes, D., Estornell, E. (1999). ミトコンドリア複合体 I の阻害剤としてのモノテトラヒドロフラン環状アセトジェニンの特異的相互作用. Chem. Biol. Interact. 122, 171-183. doi: 10.1016/S0009-2797(99)00120-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Torres, M. P., Rachagani, S., Purohit, V., Pandey, P., Joshi, S., Moore, E.D., et al. グラビオラ:細胞代謝の変化によりin vitroおよびin vivoで膵臓がん細胞の腫瘍形成と転移を抑制する新規有望天然由来薬物である。 Cancer Lett. 323 (1), 29-40. doi: 10.1016/j.canlet.2012.03.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, L.Q., Min, B.S., Li, Y., Nakamura, N.、 Qin, G.W., Li, C.J., et al. Annona montana の葉に含まれるアンノナ類アセトジェニン。 Bioorg. Med. Chem. 10, 561-565. doi: 10.1016/S0968-0896(01)00303-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Gundala, R., Mukkavilli, R., Vangala, S., Reid, M.D., Aneja, R.(2015年). Graviola (Annona muricata) の葉に含まれるフラボノイドとアセトジェニンの相乗的相互作用は、前立腺癌に対する保護を与える。 Carcinogenesis 36 (6), 656-665. doi: 10.1093/carcin/bgv046
PubMed Abstract | CrossRef Full Text | Google Scholar
Yiallouris, A., Patrikios, I., Johnson, E. O. , Sereti, E. , Dimas, K., De Ford, C. , et al. (2018). アンノナシンは、NKA依存性およびSERCA依存性経路を介して選択的ながん細胞死を促進する。 セルデス・ディズ。 9 (764), 13. doi: 10.1038/s41419-018-0772-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, F., Bai, G., Chen, Y., Miao, Y., Chen, J., Li, X. (2015年). 多剤耐性ヒト肺がん細胞株A549/Taxolに対する多様なACGの構造活性相関(Structure-activity relationships of diverse ACGs against multidrug resistant human lung cancer cell line A549/Taxol. Bioorg. Med. Chem. Lett. 25, 787-790. doi: 10.1016/j.bmcl.2014.12.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S., Chang, H. L., Chen, H. W., Yeh, Y. T., Kao, Y. H., Lin, K. H.、他 (2003). モノテトラヒドロフランのアセトゲニンであるAnnonacinは、がん細胞をG1期に停止させ、Bax. およびカスパーゼ-3関連経路で細胞毒性を引き起こす。 Life Sci. 72, 2853-2861. doi: 10.1016/S0024-3205(03)00190-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S.S…, Chang, H. L., Chen, H. W., Kuo, F. c. h., Liaw, C. h. C. h., Su, J. H., et al. スクアモシンは、Bax、Bad、カスパーゼ-3関連経路を介して、S期のT24膀胱癌細胞に対して選択的な細胞毒性を示す。 Life Sci. 78, 869-874. doi: 10.1016/j.lfs.2005.05.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, L., Wu, F.E., Oberlies, N.H., McLaughlin, J.L., Sastrodihajo, S. (1996). を用いた,5 種類の新規モノテトラヒドロフラン環状アセトジェニンの合成に成功した. J. Nat. Prod. 59, 1035-1042. doi: 10.1021/np960447e
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, S., Lim, L. Y., Chowbay, B. (2004). P糖タンパクの薬草による調節。 Drug Metab. Rev. 36 (1), 57-104. doi: 10.1081/DMR-120028427
PubMed Abstract | CrossRef Full Text | Google Scholar
.