Introduction
前立腺癌(PCa)は欧米の国で最も多く見られる悪性腫瘍で、男性の癌関連死亡の第2位の原因となっています(1)。 PCa発症の危険因子として最も認識されているのは、年齢の上昇、民族的起源、家族歴である(2)。 家族性素因は、この病気に遺伝的要素があることを示唆していますが(3)、PCa症例の少数(5-10%)しか占めていません。 そのため、ほとんどの患者さんの素因となる環境因子や遺伝因子はまだ不明です(4, 5)。 AB0血液型は、いくつかの悪性腫瘍の発生率および予後と関連する遺伝的特性である(6-8)。 AB0血液型とがんの関連については、炎症、悪性腫瘍に対する免疫監視、細胞間接着、膜シグナル伝達など、いくつかのもっともらしいメカニズムが提唱されている。 表現型のA抗原とB抗原は、一連の特異的な糖転移酵素によって触媒される単糖の付加によって合成される末端糖鎖である。 表現型0は、AおよびBの糖転移酵素が存在しないため、タンパク質の骨格であるH抗原のみが存在することが特徴である。 赤血球抗原は、膜構造の完全性、膜を介した分子の輸送、接着など、様々な機能を持つ(9)。 ABH抗原は、赤血球上の発現と同時に、尿路上皮、胃腸粘膜、肺などの様々な上皮細胞にも発現している。 いくつかの研究では、腫瘍の悪性度や病気の進行度によって、がん細胞におけるABHの発現パターンが変化することが示され、AB0血液型といくつかの上皮性悪性腫瘍のリスクとの間に関連がある可能性が示唆されている(8, 10)。 最近の研究では、血液型がA、AB、Bの人は、血液型が0の人に比べて膵臓癌の発生率が高く、中でも血液型Bが最もリスクが高いことが明らかになった(8)。 同様に、血液型Aは、胃癌、乳癌、卵巣癌のリスクが高いことが報告されている(11)。 一方、血液型0型は経尿道的膀胱切除術後の再発率および進行率が最も高く、筋層非浸潤性膀胱尿路上皮癌患者の予後を悪化させるという相関があることがわかった(6)。
いくつかの悪性腫瘍における血液型の予測的役割の現在の証拠に基づいて,我々は,PCa患者の手術後のリスク評価を容易にし予後を推定するのに役立つ,追加のパラメータとして血液型のタイプを使用することができると仮定した。 現在の文献では、一般的に血液型とPCaに関する臨床エビデンスは限られており、賛否両論の結果が示されている(12-14) さらに、現在、根本的前立腺切除術(RP)後の患者の予後に及ぼす血液型の影響に特に焦点を当てた研究は1件のみである(13)。 RPを受けたPCa患者555人を対象に、著者らはAB0血液型が多変量解析において生化学的再発(BCR)の独立した予測因子であることを示したが、単変量解析では示さなかった。
そこで本研究の目的は、3,574人の患者を含む大規模な単一施設のデータセットを用いて、RPを受けた限局性PCa患者のAB0/Rh血液型とPCa患者内の分布、腫瘍病理、再発、死亡率の相関を分析し、進行中の議論にさらに情報を加えることであった。
材料と方法
研究対象
この研究は、施設審査委員会によって承認された。 2009年から2010年にかけて当院でRPを受けた臨床的限局性PCa患者3,582名を研究対象としてスクリーニングを行った。
根治的前立腺摘除術は、前述(15)のように、開腹による後腹膜アプローチ(n = 3,220)またはロボット支援腹腔鏡アプローチ(n = 354)を用いて実施された。 リンパ節郭清は、欧州泌尿器科学会(EAU)のPCaに関するガイドラインに従って、D’Amicoの中リスク患者と高リスク患者に実施された(16)。 手術標本は標準的な病理組織学的手順に従って処理され、大規模施設(>年間2000件の前立腺切除術標本)の経験豊富な泌尿器病理医により評価された。 腫瘍は2007年米国がん合同委員会TNM病期分類に従って分類され、病理組織学的悪性度はグリーソンシステム(17)に従って割り当てられた。
すべての参加者がRPに先立って血清学的検査を受けた。 AB0とRh血液型の実験室での確認は、ハンブルク・エッペンドルフ大学病院輸血医学科から得た。 対照としてドイツ国民のAB0基準分布を用いた(18)。
研究変数
研究変数は、AB0/Rh血液型、年齢、術前の前立腺特異抗原(PSA)、前立腺容量(経直腸超音波)、Gleasonスコア(標本)、pT期、pN期、外科的マージン、BCRおよびRP後の死亡率であった。 患者のフォローアップはRP後2年間、3~6カ月ごとにPSA検査を行い、BCRはPSA値≧0.2 ng/mlと定義した。
AB0血液型と臨床病理学変数の関係はカイ2乗検定とt検定を用いて評価した。 Cox回帰多変量解析(log-rank検定)において、血液型、術前PSA、グリソンスコア、pT期、pN期、手術マージンがBCRなし生存に与える影響を評価し、生存の予後値を評価した。 BCR-free生存の確率はKaplan-Meier解析とlog-rank検定を用いて0、A、B、AB群で比較した。
すべての検定は両側で、p値<0.05は統計的に有意とした。 統計解析は、JMPソフトウェアv9.0.2(SAS Institute, Inc, Cary, NC, USA)およびR v2.13.1(R Project for Statistical Computing, www.R-project.org) を用いて行った。
結果
臨床的限局性PCa患者3,574人が最終解析に適格であり,手術時の年齢中央値は65歳(範囲:38~80),追跡期間中央値は36.9カ月であった(表1)。 根治的前立腺摘除術を受けた患者3,574人の臨床病理学的特徴とAB0血液型およびRh因子の関連性
Distribution of AB0/Rh Blood Group in Patients with PCa
RP前のPCa患者におけるAB0血液型分布は以下の通りであった。 0が1,350人(38%),Aが1,605人(45%),Bが445人(12%),ABが174人(5%)で,Rh陽性が83%であった(表1)。 ドイツ国民の参考分布は(18)のように、0が41%、Aが43%、Bが11%、ABが5%、Rhs陽性:85%となっています。
AB0/Rh血液型によるPCa患者の臨床病理学的特徴に有意差なし
患者の大半は臨床的に限局したPCaで、中リスクプロファイルであった。 Gleason scoreは3 + 4(66.9%)が最も多く,術前PSA値は4-10 ng/mlの範囲にある患者が63.3%を占めた。pT2腫瘍は68.7%で検出され,81.3%で陰性縁が達成された。 前立腺容積の中央値は40mlで、224人(6.3%)の患者でリンパ節転移が診断された(表1)。 臨床病理学的特性は、AB0血液型の違いによる有意差は認められなかった。 血液型0、A、Bに比べ、血液型ABの患者では進行腫瘍期(≧pT3b)の割合がわずかに増加した(それぞれ16.1、12.6、9.9、13.7%、p=0.033)。 AB型の患者集団は、他の血液型(16.9%、p=0.01)と比較して、Rh因子陰性(21.8%)の割合も中等度以上に高かった(表1)。
No Significant Prognostic Value of Blood Group for BCR-Free Survival after RP
A multivariable cox regression analysisによると、術前PSA、グリソンスコア、pT-stage、pN status、surgery marginは有意かつ独立してBCR-free survivalに相関した(すべてp < 0.05)(表2)。 しかし、AB0血液型がBCR率に与える影響は観察できなかった(図1)。 さらに、血液型0が0以外の血液型と比較して、また代替血液型A/B/ABの中で予後を評価したが、重要な結果は得られなかった(表2)。 マージン状態が陽性または陰性の患者のみを対象としたサブ解析を行った場合でも、AB0/RhのBCRへの影響は重要でないままであった(図2A、B)。 さらに、患者のアカゲザルの有無もBCRなしの生存率に影響を与えなかった(p=0.74)。
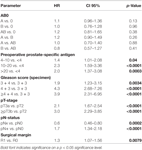
Table 2. AB0と生化学的無再発生存率の標準的予後因子の多変量COX回帰モデル。
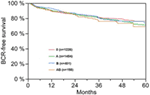
Figure 1. AB0血液型で層別した根治的前立腺摘除術後の生化学的無再発(BCR)生存率(p=0.572)
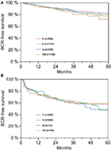
Figure 2.血中濃度が高いほど無再発生存率が高い。 (A,B)手術マージン陰性および陽性の患者におけるAB0血液型により層別化した根治的前立腺切除術後の生化学的再発(BCR)-無再生期間。
考察
AB0血液型と、膵臓癌、大腸癌、胃癌などいくつかの上皮性悪性腫瘍リスクには関連性があることが頻繁に報告されている(19、20)。 さらに、AB0/Rh血液型は外科的手術の前にほとんどの患者から入手可能であるため、追加の検査工程を必要としない理想的な補助マーカーであることが示唆された。
数十年前、免疫組織化学的研究により、患者由来のPCa細胞が正常/良性前立腺細胞とは異なるABH発現パターンを示すことが示された(21)。 AB0血液型とその組織上の抗原発現は、いくつかの悪性腫瘍の発生率、疾患の進行および転帰と関連することが報告されている(8、22、23)ため、前立腺組織におけるABH抗原の発現の変化は、前立腺細胞の悪性転換に血液型が影響を及ぼす可能性を示唆した。 著者らは,攻撃性PCa患者2,774人とPCaを持たない患者4,443人を対照とするデータセットを分析した。 これらのデータを用いた結果、AB0血液型、あるいはAまたはB対立遺伝子の「量」と侵攻性PCaリスクとの間に有意な相関は示されなかった。 著者らは、血液型によって層別化したがん特異的死亡率および全死亡率も報告しているが、この研究にはPCaの治療に関する情報は含まれていない。 さらに、攻撃的な腫瘍を持つ患者のみが含まれており、血液型の違いによる潜在的な影響を隠している可能性がある。
これらの結果は、Kvistらが行った研究で、AB0血液型と、経過観察で管理するPCa患者の生存率との間に相関がないことを示したことと一致する。 この研究は主に症例数が少ない(n=279)ことが制約となった(12)。 興味深いことに、555人の日本人患者を含むRP後の患者に焦点を当てた唯一の研究は、最近、血液型0が単変量解析ではなく多変量解析でRP後のBCRのリスク低下と有意に関連すると報告している(13)。 手術断端陰性患者のサブ解析では、血液型0型の5年BCRなし率はA群より有意に高かった(91.2 vs. 71.0%; p = 0.026)。 この研究コホートでは、臨床病期がT1cであった患者が74.2%であったにもかかわらず、46.3%の患者が切除断端陽性状態であった。
臨床的限局性PCa患者3,574人のレトロスペクティブコホートは、AB0およびRh血液型の両方が腫瘍特性およびRP後の転帰に及ぼす影響の可能性を明らかにするために、これまでに分析された最大のコホートである。 本研究では、患者の大多数がpT2腫瘍(68.7%)であり、18.6%がマージン陽性であった。 これらのデータを用いて、AB0/Rh血液型が臨床病理学的特性(術前PSA、グリーソンスコア、前立腺体積、pT期、pN状態、切除縁)および治癒的RP後のBCRなし生存に及ぼす有意な影響を示すことはできなかった。 さらに、マージン状態が陽性または陰性の患者のみを対象としたサブ解析を行った場合、AB0/RhのBCRに対する影響は重要でないままであった。 したがって、日本の研究(13)の結果を再現することはできなかった。 膵臓がんや膀胱がんなどの他の悪性腫瘍とは対照的に、AB0/Rh血液型はPCaにおいて予後を規定しないことが明らかになった。 何よりもまず,レトロスペクティブな解析に固有の限界と,対照群の欠如である。 さらに,本研究のコホートには低~中リスクプロファイルの限局性PCaが多く含まれており(グリソンスコア3+4が66.9%,術前PSA 4~10ng/mlが63.3%,pT2が68.7%,切除縁陰性が81.3%の患者),予後の良い患者の事前選択を行うことが可能である。 また、AB型の分布は、他の血液型と異なり、全般的に低頻度(4.9%)であった。 AB型患者のRh因子陰性比率が他の血液型(16.9%、p=0.01)に比べて中程度に高いことなどは、Rh陰性AB型の希少性のために、このサブグループ内での相関を統計的に有意に検出できないために、そのような傾向がある可能性があります。 最後に、それぞれの血液型の遺伝子型に関する情報が欠けていた。
上記の特徴に加え、AB0型血液型とがんの相関を論じる上で、環境、地理、人種の問題は決して無視することができない。 血液型およびPCaにおける人種的・民族的な違いはよく知られている(24, 25)。 PCaが最も一般的な悪性腫瘍であり、男性の癌関連死亡原因の第2位であるヨーロッパでは(1)、最も多い血液型はAと0で、西から東へ向かって対立遺伝子Bへと増加している。 一方、PCaの発生率が低く、悪性度の低いアジア諸国では、B型の出現率が高く、0型の頻度が相対的に低く、Rh因子陰性の人口が少ないという特徴がある(26)。 この点で、我々の結果は、治癒的RP後のマージン状態やBCRが相対的に高い日本人患者を対象とした今回の研究とは異なる(13)。
血液型ががんの発生や進行に影響を与えるメカニズムについては、いくつか提案されているが、まだ不明である。 膀胱癌の場合、AB0遺伝子が染色体9q34に位置し、この領域は膀胱癌で頻繁に変化していることから、染色体異常が示唆された(27)。 AB0遺伝子は、実はH抗原(0)への糖の転移を触媒する糖転移酵素をコードしているので、膀胱癌の発生は血液型0型と相関がある可能性があるのである。 一方、0型以外の血液型(A、AB、B)では胃がんの発症リスクが高いことが報告されており、血液型のがん特異的な役割を示している。
PCaに関しては、治療後の生存における血液型の役割を明らかにするためのいくつかの取り組みが進められている。 血液型が0型でない患者はRP後の静脈血栓塞栓症リスクが高くなるはずであり、予後に影響を与える可能性があることは既に報告されている(28)。 最近発表された研究でも、血液型Aに対する血清抗体がPROSTVAC-VF(進行性PCaの治療のために第III相臨床試験中のポックスウイルスに基づく治療用がんワクチン)の生存率を予測することが示され、PROSTVAC-VFの新しい潜在的予測バイオマーカーとして考慮されるべきです(29)。 我々の研究では、AB0/Rh血液型と腫瘍の病態および転帰との間に明確な関連性は認められなかったが、このような証拠は、特に治療効果の観点から、PCaの疫学および臨床結果における血液型の予測的役割を依然として示唆するものである。
3,574人の患者を対象とした本研究は、RP後の病理学的および転帰に対するAB0またはRh血液型の影響を分析したこれまでで最大のものであり、文献に重要な知識を追加した。
結論として、他のいくつかの悪性腫瘍とは異なり、AB0/Rh血液型と臨床病理学的腫瘍特性または術後の腫瘍学的転帰の関連性を示唆しないことが我々のデータで示された。
インフォームドコンセント
本研究に参加したすべての参加者からインフォームドコンセントを得た。
倫理声明
ヒトが参加する研究で行われたすべての手順は、機関および/または国の研究委員会の倫理基準、1964年のヘルシンキ宣言とその後の修正または同等の倫理基準に従ったものである
著者貢献
SO、DT、TS:研究の構想または設計、研究の草稿、出版するバージョンの最終承認に多大な貢献をした。 PM:研究の着想または設計、原案作成、掲載版の最終承認に多大な貢献をした。 FC: 研究のためのデータの取得、分析、解釈、重要な知的コンテンツのための重要な改訂、出版されるバージョンの最終承認。 また、本論文は、重要な知的財産権の内容を反映させるために重要な改訂を行い、最終的に出版することを承認した。 SP: 本業務におけるデータの取得、分析、解釈、重要な知的内容のために重要な修正を行い、出版されるバージョンを最終的に承認した。 JLH、JH、MG: 研究のためのデータの取得、分析、解釈、重要な知的内容のために重要な修正を行い、出版されるバージョンの最終承認を得た。 すべての著者は、本研究のいかなる部分の正確性または完全性に関する疑問が適切に調査され解決されることを保証するために、本研究のあらゆる側面について責任を負うことに同意した。
利益相反声明
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
取り扱い編集者は、著者数名(FC、SP、JH、DT)と他の協力関係はないものの共通の所属を宣言している。 Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Risk factors for prostate cancers.The Risk Factors for the American Cancer, 2014. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ、Isaacs WB、Stanford JL. 遺伝性前立腺癌の遺伝的病因。 Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported Family History of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial(前立腺、肺、直腸、卵巣癌スクリーニング試験で、報告されたがんの家族歴). Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5.このような場合、その家族歴の有無を確認する必要があります。 Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. がんの原因における環境要因と遺伝的要因-スウェーデン、デンマーク、フィンランドの双子のコホートの分析-. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Primary nonmuscle invasive bladder cancers in patientsにおけるABO血液型と予後の影響. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. ABO組織血液型およびFUT座における変動と欧州集団のびまん性および腸胃癌リスクとの関連性. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium.膵臓癌のリスクとABO血液型の対立:膵臓癌コンソーシアムからの結果。 Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9.膵臓癌リスクとABO血液型対立遺伝子:膵臓癌コンソーシアムの結果。 Reid ME. I型血液型抗原をコードする遺伝子:I for an eyeのレビュー。 Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. 大腸癌組織における血液型抗原A、B、Hの発現は大腸癌患者の予後不良と相関している。 J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO血液型と上皮性卵巣癌の発生率。 Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12.を参照。 Kvist E, Krogh J, Hjortberg P. Prognostic variables in patients with prostate cancer: influence of blood group ABO (H), the Rhesus system, age, differentiation, tumour stage and metastases. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
十三. 大野雄一郎、大堀雅彦、中島淳一、大久保秀夫、佐竹直人、滝沢一郎、他 ABO血液型と根治的前立腺切除術後の生化学的再発の関連性. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14.を参照。 Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO血液型対立遺伝子と前立腺がんリスク:乳がんおよび前立腺がんコホートコンソーシアム(BPC3)からの結果。 Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15.を参照。 Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerve-sparing frequency and reducing positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
十六. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. 前立腺がんに関するガイドライン2015. 欧州泌尿器科学会(2015).
Google Scholar
17.泌尿器科学会(2015).
Google Scholar
17. Gleason D, Mellinger G. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18.前立腺癌の予後。 Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blood group determinates incidence for pancreatic cancer in Germany.ドイツにおける血液型による膵臓癌の発生率。 Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19.膵臓癌の発生率は、血液型によって決定される。 Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO血液型と癌. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20.を参照。 マーカスDM. ABOおよびルイス式血液型システム。 免疫化学、遺伝学およびヒトの病気との関係。 N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21.マーカスDM.は、ABOとルイス血群システム。 Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detection of blood group antigens in frozen sections of prostatic epithelium. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22.泌尿器科領域における血液型抗原の検出。 乳癌患者の予後因子としてのABH/Lewis関連抗原の発現. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23.を参照。 Orntoft TF, Meldgaard P, Pedersen B, Wolf H. The blood group ABO gene transcript is down-regulated in human bladder tumors and growth-stimulated urothelial cell lines. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. 前立腺癌の日米比較研究。 総説。 Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25.日本人の前立腺癌と米国人の前立腺癌の比較研究。 Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Model-based patterns in prostate cancer mortality worldwide(モデルに基づく世界の前立腺癌死亡率のパターン)。 Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26.を参照。 Garratty G, Glynn SA, McEntire R. 米国における異なる人種/民族集団のABOおよびRh(D)表現型頻度。 Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27.を参照。 膀胱原発腫瘍における組織血液型ABO(H)の遺伝子型および表現型の特徴。 Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
二八. Clyne M. Prostate cancer: non-O blood type is VTE risk factor after radical prostatectomy. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29.を参照。 Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. 血液型Aに対する血清抗体はPROSTVAC-VFでの生存率を予測する。 Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar
.