赤血球の主要な機能成分で酸素運搬タンパク質として、1分子が4つのモノマーからなる4量体で弱い結合でつながっているタイプのヘモタンパク質である。 鉄とプロトポルフィリン分子からなるヘム分子が結合したグロビンというポリペプチド鎖が2本一組で構成されている。 記号 Hb.
鉄原子は自由原子価を持ち、酸素1分子と結合できる。 したがって、ヘモグロビン1分子は1分子の酸素と結合することができる。 1つの単量体が酸素を結合すると、4量体中の他の単量体の酸素に対する親和性が高くなる。 このため、ヘモグロビンは、ミオグロビンのような単量体タンパク質よりも効率的な輸送タンパク質となる。
酸素を含むヘモグロビン(オキシヘモグロビン)は明るい赤色で、酸素と結合していないヘモグロビン(デオキシヘモグロビン)は黒っぽい色をしています。 このため、動脈血は明るい赤色をしており、ヘモグロビンは約97%が酸素で飽和されている。 静脈血は、組織での酸素消費量にもよるが、20〜70%程度しか飽和していないため、色が濃くなる。 ヘモグロビンの一酸化炭素に対する親和力は、酸素に対する親和力の210倍である。 形成された複合体(カルボキシヘモグロビン)は、酸素を運搬することができない。 また、ヘモグロビンのうち、鉄原子が+3酸化状態に酸化されたメトヘモグロビンも、酸素運搬ができないヘモグロビンである。 赤血球の寿命が120日である間に、ヘモグロビンは徐々に酸化されてメトヘモグロビンになる。 メトヘモグロビンは、少なくとも4種類の酵素系によってヘモグロビンに戻される。 ヘモグロビンの二次的な機能として、血液の緩衝系がある。 グロビン鎖のヒスチジン残基は、肺で酸素が吸収され二酸化炭素が放出されるとき、また組織から酸素が供給され二酸化炭素が取り込まれるときに起こる血液のpHの変化を最小限に抑える弱塩基として働く。
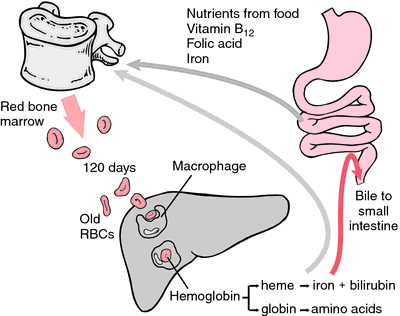
赤血球は消耗するか損傷すると、網状内皮系のマクロファージに吸収される。 ヘムのポルフィリン環は、胆汁色素のビリルビンに変換され、肝臓から排泄される。 鉄は骨髄に運ばれ、新たに形成された赤血球のヘモグロビンに取り込まれる。
血液中のヘモグロビン濃度はヘマトクリット値によって変化する。 血中ヘモグロビン濃度の正常値は、男性で13.5~18.0g/100ml、女性で12.0~16.0g/100mlである。 赤血球内の濃度である平均体ヘモグロビン濃度の正常値は32~36g/100mlである。
突然変異による異常ヘモグロビンが多く発見されている。 酸素親和性が変化するもの、不安定なもの、鉄原子が酸化されて先天性メトヘモグロビン血症になるものなどがある。 また、ヘモグロビンの合成速度が低下する突然変異もある。
最も一般的なヘモグロビン異常症は鎌状赤血球症で、β鎖の6番目のアミノ酸(通常はグルタミン酸)がバリンに置き換わる変異によって起こる。 ヘモグロビンα2βS2の変異体はHb Sと呼ばれる。一方の鎖の合成が低下した変異体はサラセミアと呼ばれる。 鎖の遺伝子の欠失や、鎖の合成を制御する調節遺伝子の変異によって生じる。
。