A: De zuurtegraadconstante bepalen
Het is u ongetwijfeld bekend dat sommige zuren sterker zijn dan andere. De relatieve zuurgraad van verschillende verbindingen of functionele groepen – met andere woorden, hun relatieve vermogen om onder identieke omstandigheden een proton af te staan aan een gemeenschappelijke base – wordt gekwantificeerd door een getal dat de zuurgraadconstante wordt genoemd, afgekort Ka. De gemeenschappelijke basis die voor de vergelijking is gekozen is water.
We zullen azijnzuur als ons eerste voorbeeld beschouwen. Als we een verdunde oplossing van azijnzuur in water maken, ontstaat er een zuur-base reactie tussen het zuur (proton-donor) en water (proton-acceptor).
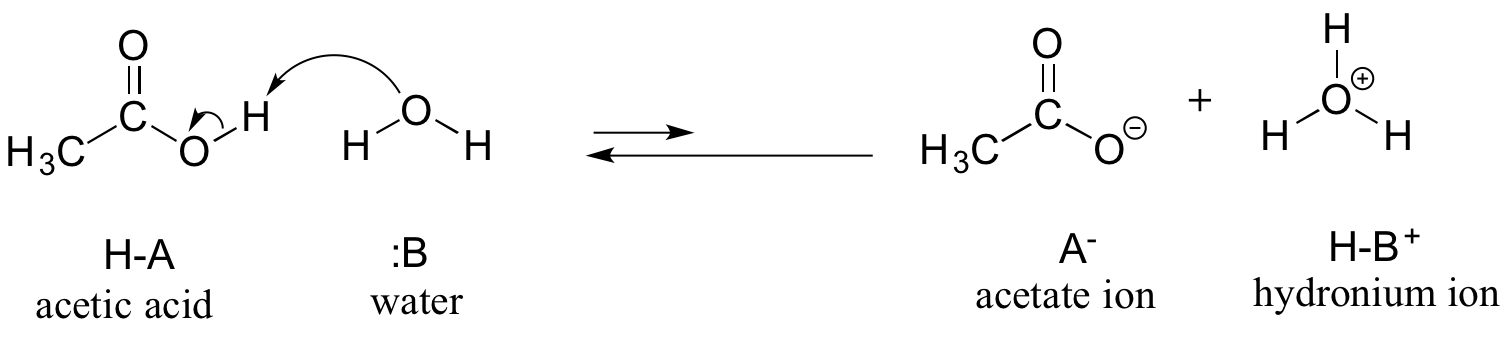
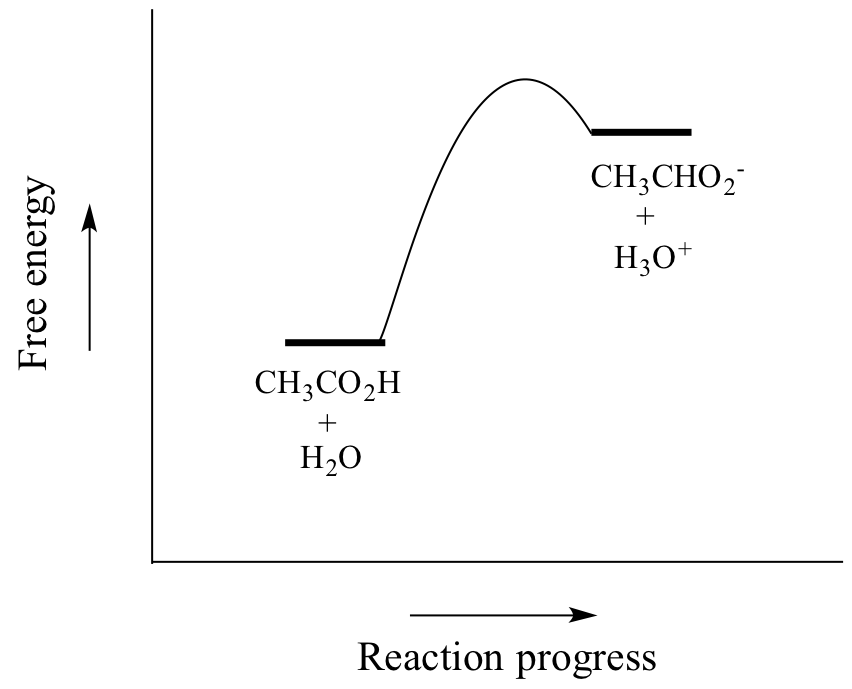
Azijnzuur is een zwak zuur, zodat het evenwicht reactanten bevoordeelt ten opzichte van producten – het is thermodynamisch “bergop”, zoals in de bovenstaande figuur wordt aangegeven door de relatieve lengte van de voorwaartse en omgekeerde reactiepijlen, en in het reactiecoördinatendiagram hieronder waarin producten een hogere energie hebben dan reactanten.
Zoals u weet is de evenwichtsconstante Keq gedefinieerd als:
![]()
Elke evenwichtsconstante-uitdrukking is eigenlijk een verhouding van de activiteiten van alle bij de reactie betrokken soorten. Om het gebruik van activiteiten te vermijden en de experimentele metingen te vereenvoudigen, benadert de evenwichtsconstante van concentraties de activiteiten van opgeloste stoffen en gassen in verdunde oplossingen met hun respectieve molariteiten. De activiteiten van vaste stoffen, zuivere vloeistoffen en oplosmiddelen worden echter niet benaderd met hun molariteiten. In plaats daarvan worden deze activiteiten gedefinieerd als gelijk aan 1 (één).
Dus, als we erkennen dat de activiteit van water in een verdunde oplossing wordt benaderd met de waarde van eenheid (1), kunnen we delen door 1 om de gebruikelijke vorm te krijgen van de uitdrukking voor Ka, de zuurconstante voor azijnzuur:
}{(1)} = \dfrac{}{}
In feite wordt voor een verdunde waterige oplossing de activiteit van water benaderd met de waarde 1, zodat de algemene dissociatieconstante voor een gegeven zuur HA of HB+ wordt uitgedrukt als:
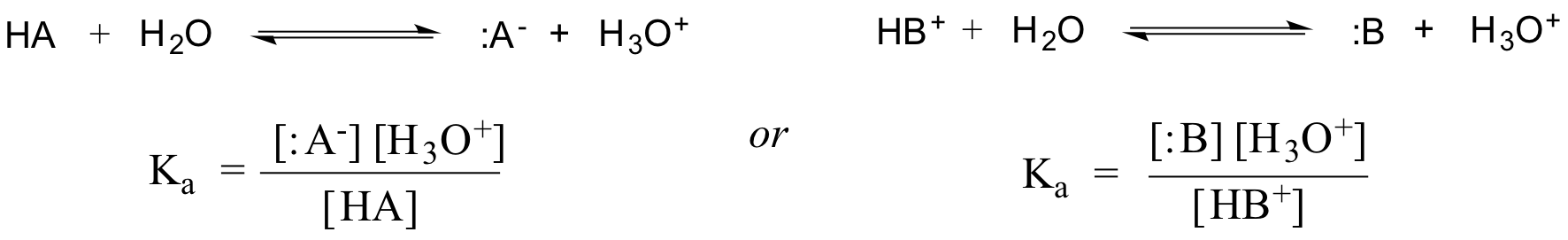
De waarde van Ka voor azijnzuur is 1.75 x 10-5 – veel minder dan 1, wat aangeeft dat er veel meer azijnzuur in oplossing is bij evenwicht dan acetaat en hydroniumionen.
Omgekeerd ondergaan zwavelzuur, met een Ka van ongeveer 109, of zoutzuur, met een Ka van ongeveer 107, beide een vrijwel volledige dissociatie in water: het zijn zeer sterke zuren.
Een getal als 1,75 x 10- 5 is niet erg gemakkelijk om uit te spreken, te onthouden, of te visualiseren, dus chemici gebruiken gewoonlijk een handigere term om de relatieve zuurgraad uit te drukken. De pKa waarde van een zuur is eenvoudig de log (basis 10) van zijn Ka waarde.
pKa = -log Ka Ka = 10-pKa
Doen we de wiskunde, vinden we dat de pKa van azijnzuur is 4,8. De pKa van zwavelzuur is -10, en van zoutzuur is -7. Het gebruik van pKa waarden stelt ons in staat om de relatieve zuurgraad van veel voorkomende verbindingen en functionele groepen uit te drukken op een numerieke schaal van ongeveer -10 (voor een zeer sterk zuur) tot 50 (voor een verbinding die helemaal niet zuur is). Hoe lager de pKa waarde, hoe sterker het zuur.
De ioniseerbare (proton donerende of accepterende) functionele groepen die relevant zijn voor de biologische organische chemie hebben over het algemeen pKa waarden variërend van ongeveer 5 tot ongeveer 20. De belangrijkste worden hieronder opgesomd, met zeer ruwe pKa waarden voor de geconjugeerde zuurvormen. Meer zure groepen met pKa waarden dicht bij nul zijn ook opgenomen ter referentie.
Geschatte pKa-waarden om te weten
hydroniumion (H3O+) : 0
geprotoneerde alcohol: 0
geprotoneerde carbonyl: 0
carboxylic zuren: 5
geprotoneerde imines: 7
geprotoneerde aminen: 10
fenolen: 10
thiolen: 10
water: 14
alcoholen: 15-18
alpha-koolstofzuren*: 20
*alfa-koolstofzuren komen later in dit hoofdstuk aan de orde
Het is sterk aan te bevelen deze ruwe waarden nu uit het hoofd te leren – als je dan een preciezere waarde nodig hebt, kun je die altijd opzoeken in een pKa-tabel.
Waarschuwing! pKa is niet hetzelfde als pH!
Het is belangrijk te beseffen dat pKa niet hetzelfde is als pH: de eerste is een inherente eigenschap van een verbinding of functionele groep, terwijl de laatste een maat is voor de hydroniumionenconcentratie in een gegeven waterige oplossing:
pH = -log
Kennis van pKa-waarden stelt ons niet alleen in staat om de sterkte van zuren te vergelijken, maar ook om de sterkte van basen te vergelijken. Het belangrijkste idee om te onthouden is dit: hoe sterker het geconjugeerde zuur, hoe zwakker de geconjugeerde base. We kunnen bepalen dat het hydroxide-ion een sterkere base is dan ammoniak (NH3), omdat het ammoniumion (NH4+, pKa = 9,2) een sterker zuur is dan water (pKa = 14,0).
Oefening 7.2.1
Wat is de sterkere base, CH3O- of CH3S-? Acetaat ion of ammoniak? Hydroxide-ion of acetaat-ion?
Oplossing
Laten we ons begrip van het pKa-concept eens gebruiken in de context van een complexer molecuul. Wat is bijvoorbeeld de pKa van de onderstaande verbinding?
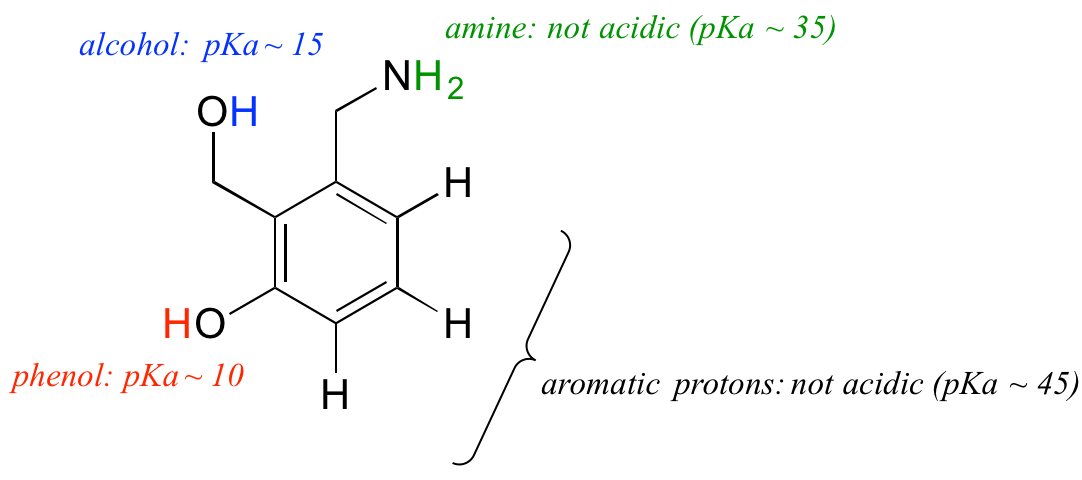
We moeten de potentiële zuurgraad van vier verschillende soorten protonen op het molecuul evalueren, en de zuurste vinden. De aromatische protonen zijn niet allemaal zuur – hun pKa is ongeveer 45. De aminegroep is ook niet zuur, zijn pKa is ongeveer 35. (Onthoud dat ongeladen amines basisch zijn: het zijn positief geladen geprotoneerde amines, met pKa-waarden rond 10, die zwak zuur zijn). Het proton van de alcohol heeft een pKa van ongeveer 15, en het proton van het fenol heeft een pKa van ongeveer 10: de zuurste groep op het molecuul hierboven is dus het fenol. (Zorg ervoor dat je het verschil tussen een fenol en een alcohol kunt herkennen – onthoud dat in een fenol de OH groep direct aan de aromatische ring gebonden is). Als dit molecuul zou reageren met één molair equivalent van een sterke base zoals natriumhydroxide, dan zou het fenolproton worden afgestaan om een fenolaatanion te vormen.
Oefening 7.2.2
Benoem de meest zure functionele groep op elk van de onderstaande moleculen, en geef bij benadering zijn pKa.

Oplossing