The Brønsted-Lowry definition of acidity and basicity
We beginnen onze discussie over zuur-base chemie met een paar essentiële definities. De eerste werd in 1923 voorgesteld door de Deense scheikundige Johannes Brønsted en de Engelse scheikundige Thomas Lowry, en is bekend geworden als de Brønsted-Lowry-definitie van zuurtegraad en basischheid. Een zuur, volgens de Brønsted-Lowry definitie, is een stof die optreedt als proton-donor, terwijl een base een proton-acceptor is. We hebben in het vorige hoofdstuk al een van de bekendste voorbeelden van een Brønsted-Lowry zuur-base reactie besproken, tussen zoutzuur en hydroxide-ion:
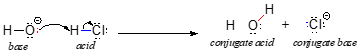
In deze reactie wordt een proton overgedragen van HCl (het zuur, of de proton-donor) naar hydroxide-ion (de base, of proton-acceptor). Zoals we in het vorige hoofdstuk hebben geleerd, geven gebogen pijlen de beweging van elektronen weer in dit bindings-brekende en bindingsvormende proces.
Nadat een Brønsted-Lowry zuur een proton afstaat, wordt wat overblijft de geconjugeerde base genoemd. Het chloride-ion is dus de geconjugeerde base van zoutzuur. Omgekeerd, wanneer een Brønsted-Lowry base een proton accepteert, wordt het omgezet in zijn geconjugeerde zure vorm: water is dus het geconjugeerde zuur van hydroxide-ion.
Hier volgt een organische zuur-basereactie, tussen azijnzuur en methylamine:
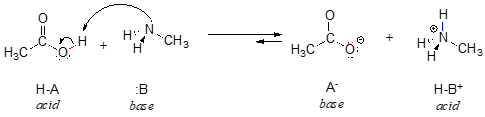
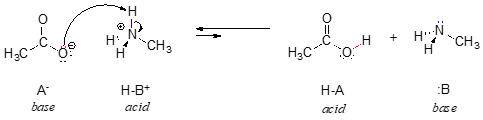
In het omgekeerde van deze reactie is het acetaation de base en het methylammoniumion (geprotoneerd methylamine) het zuur.
Wat maakt een verbinding zuur (waarschijnlijk een proton afstaan) of basisch (waarschijnlijk een proton accepteren)? Het beantwoorden van die vraag is een van onze belangrijkste taken in dit hoofdstuk, waarbij we gebruik moeten maken van veel van wat we in de eerste twee hoofdstukken hebben geleerd over de organische structuur, en van de ideeën over thermodynamica die we in hoofdstuk 6 hebben behandeld.
Laten we voor nu eens kijken naar één gemeenschappelijke eigenschap van basen: om als base te kunnen fungeren, moet een molecuul een reactief elektronenpaar hebben. In alle zuur-base reacties die we in dit hoofdstuk zullen zien, heeft de basische soort een atoom met een lone paar elektronen. Wanneer methylamine als base fungeert, bijvoorbeeld, wordt het eenzame elektronenpaar op het stikstofatoom gebruikt om een nieuwe binding met een proton te vormen.
Het is duidelijk dat methylammoniumion niet als base kan fungeren – het heeft geen reactief elektronenpaar waarmee het een proton kan accepteren.
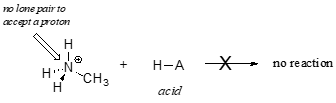
Later, in hoofdstuk 14, zullen we reacties bestuderen waarbij een elektronenpaar in een binding van een alkeen of aromatische ring basisch werkt – maar voor nu zullen we ons concentreren op de basische werking van niet-bindende (lone pair) elektronen.
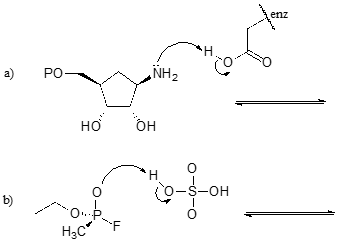
Oefening
Voltooi de onderstaande reacties – met andere woorden, teken de structuren voor de ontbrekende geconjugeerde zuren en geconjugeerde basen die uit de gegeven gebogen pijlen voortvloeien.