Gezien de relatieve structurele eenvoud en het repetitieve karakter van DNA, zou daaruit volgen dat eiwitten die zich specifiek aan dit DNA binden, gemeenschappelijke DNA-bindende domeinmotieven zouden kunnen hebben, maar met specifieke aminozuren zijketens die specifieke bindingsinteracties mogelijk maken.
- helix-turn-helix: aangetroffen in prokaryotische DNA-bindende proteïnen.
Figuur: helix-turn-helix
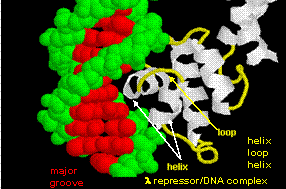
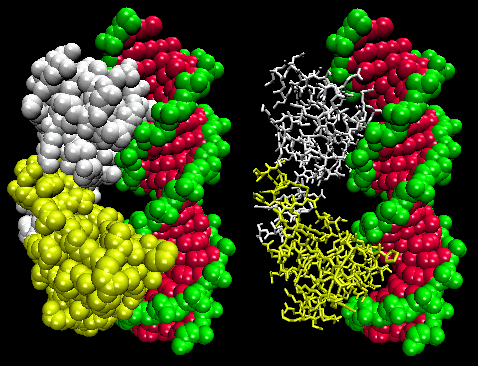
De figuren tonen twee van dergelijke proteïnen, de cro-repressor van bacteriofaag 434 en de lambda-repressor van de bacteriofaag lambda. (Bacteriofagen zijn virussen die bacteriën infecteren.) Merk op hoe de specificiteit wordt bereikt, gedeeltelijk, door de vorming van specifieke H-bindingen tussen het eiwit en de hoofdgroef van het operator-DNA.
Figuur: Lambda Repressor/DNA Complex
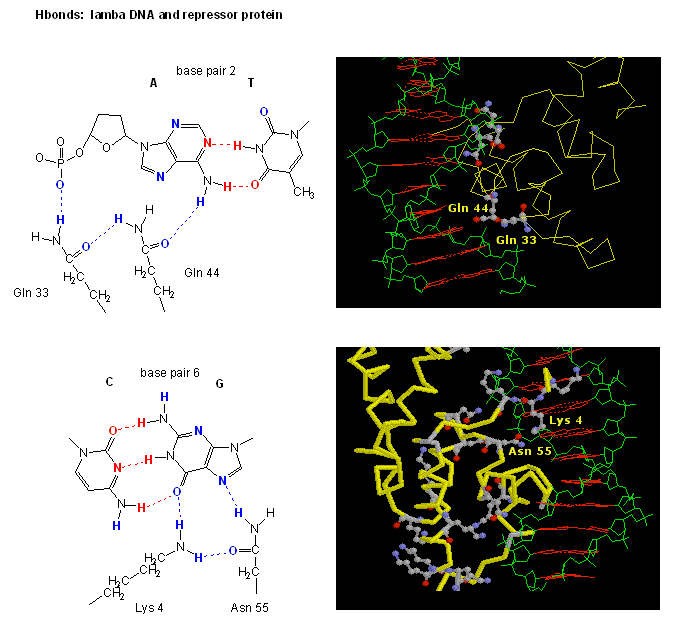
Figuur: H-bond interacties tussenλ repressor en DNA
![]() Jmol: Bijgewerkt Lambda Repressor/DNA complex Jmol14 (Java) | JSMol (HTML5)
Jmol: Bijgewerkt Lambda Repressor/DNA complex Jmol14 (Java) | JSMol (HTML5)
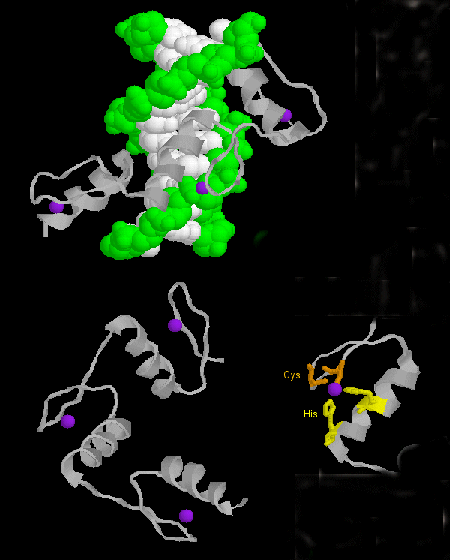
- zinkvinger: (eukaryoten) Deze eiwitten hebben een gemeenschappelijk sequentiemotief van X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4- waarin X een willekeurig aminozuur is. Zn2+ is tetrahedraal gecoördineerd met de Cys en His zijketens, die respectievelijk op één van twee antiparallelle beta strengen en een alpha helix liggen. De zinkvinger, gestabiliseerd door het zink, bindt zich aan de hoofdgroef van het DNA. ]
Figuur: zinkvinger
![]() Jmol: Updated Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Jmol: Updated Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Zn finger eiwitten, waarvan er 900 in het menselijk genoom zijn gecodeerd (waaronder het hierboven beschreven eukaryote insulatoren bindende eiwit CTCF) kunnen worden gemobiliseerd om specifieke mutaties in cellen daadwerkelijk te repareren, waardoor specifieke genetische ziekten, zoals sommige vormen van ernstige gecombineerde immunodeficiëntie, zouden kunnen worden genezen, indien dit in een voldoende hoog percentage van de gemuteerde cellen wordt uitgevoerd. In deze nieuwe techniek (Urnov et al, 2005) worden meerdere gekoppelde Zn finger bindingsdomeinen (één van de natuurlijk voorkomende of in het lab geproduceerde gemuteerde vormen), elk specifiek voor een bepaalde nucleotide-sequentie, gekoppeld aan een niet-specifiek endonuclease, afgeleid van het enzym FokI. Het nuclease is actief in dimere vorm, zodat het actieve complex twee endonuclease-domeinen, elk gebonden aan vier verschillende Zn-finger-domeinen, nodig heeft om zich op de doelplaats te verzamelen. De specificiteit van de binding wordt bereikt door selectie door de Zn-finger domeinen. Vervolgens wordt door het nuclease een inkeping in het DNA gemaakt, waarna herstelmechanismen in de gastheercel volgen. Dit proces omvat strengscheiding, homologe recombinatie van de vernauwde regio met complementair DNA binnen de cel, en herstel van de vernauwing. Als een overmaat wild type (niet-gemuteerd) DNA aan de cellen wordt toegevoegd en als sjabloon wordt gebruikt, zou de normale DNA-reparatiemutatie de mutatie repareren. Urnov et al. hebben aangetoond dat tot 20% van de gekweekte cellen die een mutatie bevatten, in het lab kunnen worden hersteld. Als deze cellen een selectief groeivoordeel krijgen, zouden de gemuteerde cellen uiteindelijk worden vervangen door wild-type cellen.
- steroïde hormoonreceptoren: (eukaryoten) In tegenstelling tot de meeste hormonen, die zich binden aan receptoren op het celoppervlak, passeren steroïdhormonen (derivaten van cholesterol) het celmembraan en binden zich aan cytoplasmatische receptoren via een hormoonbindend domein. Hierdoor verandert de vorm van de receptor, die zich vervolgens via een DNA-bindend domein bindt aan een specifieke plaats op het DNA (hormoon-respons-element). In een structuur naar analogie van de zinkvinger is Zn 2+ tetrahedraal gecoördineerd met 4 Cys, in een bolvormige structuur die zich als een dimeer bindt aan twee identieke, maar omgekeerde sequenties van DNA (palindroom) binnen de hoofdgroef. (Voorbeelden van palindromen: Able was I ere I saw Elba; Dennis and Edna dine, said I, as Enid and Edna sinned.
Overweeg de glucocorticoid receptor (GR) als een specifiek voorbeeld. Het bindt DNA als een dimeer. De twee DNA-bindende domeinen van het dimeer associëren zich met twee aangrenzende grote groeven van het DNA in de GR-bindingssequentie (GBS), een korte sequentie van DNA binnen de promotor. Meijsing e.a. hebben ontdekt dat de GBS niet alleen fungeert als bindingsplaats voor GR, waardoor transcriptie van genen mogelijk wordt, maar dat het ook de conformatie van de receptor beïnvloedt, waardoor gen-transcriptie op een andere manier wordt gereguleerd. De groep construeerde luciferase “reporters genen” die GBS gekoppeld hebben aan het gen voor het eiwit luciferase, die het eiwit luciferase (dat fluoresceert) tot expressie zouden brengen als ze getranscribeerd werden, met het GBS. Zij ontdekten dat de relatieve transcriptionele activiteit niet correleerde met de relatieve bindingsaffiniteit van GR met het GBS. GBS’s die veel actiever waren dan andere bonden vergelijkbaar met die met een lagere activiteit, terwijl GBS’s met een vergelijkbare transcriptionele activiteit bonden met verschillende affiniteiten. Dit toont aan dat het GBS een unieke functie verleent aan het GR dat ermee verbonden is (m.a.w. de transcriptie wordt niet louter beïnvloed door het feit of het GR al dan niet aan het GBS gebonden is). Een �lever arm� van de receptor bleek conformatieveranderingen te ondergaan wanneer hij aan DNA gebonden was, met veranderingen die specifiek waren voor de sequentie waaraan hij gebonden was. Een mutant eiwit, GR-γ, werd identiek gemaakt aan het wild-type eiwit, GR-α, behalve in de hefboomarm bleek een verschillende transcriptionele activiteit te hebben, hoewel ze aan dezelfde plaats op het DNA bonden, wat aantoont dat de hefboomarm en zijn conformatie de transcriptie beïnvloeden.
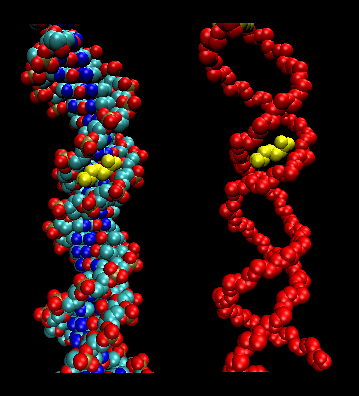
- leucine ritsen (of scharen): (eukaryoten) Deze proteïnen bevatten stukken van 35 aminozuren waarin Leu herhaaldelijk wordt aangetroffen met 7 aminozuurintervallen. Deze delen van het eiwit vormen amfifiele helices, met Leu op één zijde en één Leu na twee windingen van een helix. Twee van deze eiwitten kunnen een dimeer vormen, gestabiliseerd door de binding van deze apolaire, leucinerijke amfifiele helices aan elkaar, waardoor een spiraal wordt gevormd, ongeveer zoals in het spiereiwit myosine. De leucine-rits vertegenwoordigt het eiwitbindende domein van het eiwit. Het DNA-bindende domein wordt gevonden in de eerste 30 N-terminale aminozuren, die basisch zijn en een alfa-helix vormen wanneer het eiwit zich aan DNA bindt. De leucine-rits fungeert dan om twee DNA-bindende proteïnen samen te brengen, waardoor de N-terminale basische helixen op een basisspecifieke manier kunnen interageren met de hoofdgroef van het DNA. Valine en isoleucine, samen met leucine, worden vaak gevonden in stukken van aminozuren die kunnen interageren om andere soorten opgerolde spoelen te vormen.
Figuur: leucine ritsen (gemaakt met VMD)
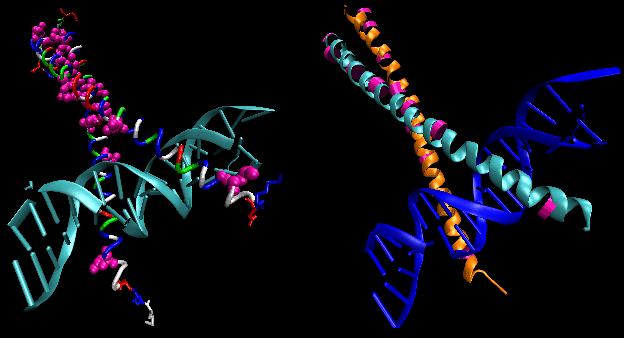
![]() Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
Net zoals Zinkvingernucleasen zijn gebruikt om herstel van mutaties te induceren, zijn in een andere studie van het rattengenoom speciaal ontworpen ZFN’s gebruikt om breuken in ds-DNA te veroorzaken die mutaties bevatten van onnauwkeurige DNA-herstelmechanismen (door NHEJ) en dus specifieke mutaties bevatten (Geurts, et al. 2009). Dit proces, �knock-out van het gen,� verhindert de productie van het eiwit dat normaal door het doelgen wordt getranscribeerd. Vijf- en zesvingerige ZFN’s werden gebruikt om een hoge mate van specificiteit te bereiken bij de gerichte binding aan het gen voor drie verschillende eiwitten: groen fluorescent eiwit (GFP), immunoglobuline M (IgM) en Rab38. De knock-out was succesvol bij 12% van de geteste ratten; deze dieren hadden geen wild-type eiwit en geen expressie. De ZFN’s waren voldoende specifiek dat er geen mutaties werden waargenomen op een van de 20 voorspelde niet-doelsites. Deze studie ondersteunt de levensvatbaarheid van controle van transcriptie en expressie voor de behandeling van ziekten en het belang van specifieke binding.
We hebben gezien dat twee belangrijke factoren bijdragen aan de specifieke herkenning van DNA door eiwitten; de vorming van waterstofbruggen aan specifieke nucleotide donors en acceptors in de hoofdgroef, en volgorde-afhankelijke vervormingen van de DNA helix tot veranderde vormen met verhoogde affiniteit van eiwit liganden. Zo kan bijvoorbeeld het Tata Binding Protein (TBP) interageren met een verbrede kleine groef in de TATA box. Nieuwe bevindingen ondersteunen dat daarnaast eiwitten in staat zijn gebruik te maken van informatie in kleine groeven die “versmald” zijn, afhankelijk van de nucleotidenvolgorde.
Sporen DNA verrijkt met A kunnen leiden tot verdraaiende conformaties die inter-basenpaar waterstofbinding veroorzaken in de grote groeven, resulterend in de versmalling van kleine groeven. Grote hoeveelheden AT basenparen zijn geconcentreerd in smalle kleine groeven (breedte <5.0 �) en CG basenparen worden vaker gevonden in brede kleine groeven.
Hoe beïnvloedt het versmallen van de kleine groef de DNA herkenning? Smalle kleine groeven verhogen het negatieve elektrostatische potentieel van het DNA, waardoor het een meer specifieke en herkenbare plaats wordt. De ruggengraatfosfaten van het DNA bevinden zich dichter bij het midden van de groef wanneer deze smal is, waardoor smalle kleine groeven in verband worden gebracht met een negatiever elektrostatisch potentieel.
De kleine groef-interagerende delen van eiwitten bevatten arginine waarvan de zijketen kan worden ondergebracht in de meer smalle en negatieve kleine groef. Arginines kunnen zich binden en in sommige gevallen invoegen als korte sequentiemotieven die de specificiteit van de herkenning van de DNA-vorm vergroten. Arg heeft de voorkeur boven Lys omdat de effectieve stralen van de lading in Arg groter zijn dan die van de ladingsdrager in Lys. Dit zou leiden tot een verminderde desolvatie-energie voor Arg, wat zijn binding aan de vernauwde hoofdgroef zou bevorderen. Deze ontdekking toont aan dat “de rol van de DNA-vorm in aanmerking moet worden genomen bij het annoteren van het volledige genoom en het voorspellen van bindingsplaatsen voor transcriptiefactoren”.
Figuur: Arg in T3c Transposase binding in versmalde kleinere bos van T3c Transposon
- Glijdend model voor eiwit/DNA interacties
Bijdragers en toeschrijvingen
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)