Introduction
Serotonine (5-hydroxytryptamine, 5-HT) 2C receptoren (5-HT2CRs) zijn wijdverspreid in de hersenen, en bemiddelen bij regulerende effecten van 5-HT op angst, slaap, hormonale secretie, voedingsgedrag, bewegingsactiviteit, alsmede leer- en geheugenprocessen (Bagdy, 1998; Chagraoui et al., 2016). 5-HT2CR disfunctie is geïmpliceerd in pathologische aandoeningen, zoals angst en depressie (Chagraoui et al., 2016; Di Giovanni en De Deurwaerdere, 2016). Anderzijds hebben talrijke antidepressiva, anxiolytica en antipsychotica affiniteiten met de 5-HT2CRs, die betrokken kunnen zijn bij de therapeutische effecten van deze geneesmiddelen (Bagdy et al., 2001; Chagraoui et al., 2016; Di Giovanni en De Deurwaerdere, 2016). 5-HT2CR is dus een veelbelovend farmacologisch doelwit bij de behandeling van verschillende neuropsychiatrische aandoeningen (Chagraoui et al, 2016; Di Giovanni en De Deurwaerdere, 2016).
Stimulatie van 5-HT2CRs is beschreven om angst te produceren, en op hun beurt, subtype-selectieve 5-HT2CR-antagonisten zoals SB-242084 oefenden duidelijke anxiolytische effecten uit (Dekeyne et al., 2000; Bagdy et al., 2001; Kantor et al., 2005). De selectieve 5-HT2CR-antagonisten RS-102221 en SB-242084 veroorzaakten snel intredende antidepressivumachtige effecten bij muizen (Opal et al., 2014). Ook versterkte 5-HT2CR-antagonisme de anxiolytische en antidepressieve effecten van fluoxetine, een selectieve serotonine heropname remmer (SSRI), bovendien verminderde het de motorische bijwerkingen bij muizen (Demireva et al., 2018). Belangrijk is dat de interactie van 5-HT en dopamine (DA) systemen is gesuggereerd om bij te dragen aan deze effecten (De Deurwaerdere en Di Giovanni, 2017).
Verschillende parameters op het elektro-encefalogram (EEG) tijdens zowel waakzaamheid als slaap zijn beschreven om biomarkers van depressie en van geïndividualiseerde antidepressieve therapie te bieden (Steiger en Kimura, 2010). Gamma oscillaties zijn relatief hoogfrequente (>30 Hz) componenten van het EEG, die belangrijke aanwijzingen geven over de dynamiek van neuronale populaties (Buzsaki en Wang, 2012). Gamma-oscillaties zijn in verband gebracht met zintuiglijke en cognitieve functies, evenals neurale plasticiteit en geheugen bij dieren en mensen (Cardin, 2016). Aan de andere kant is abnormale gamma-activiteit geïmpliceerd in verschillende psychiatrische aandoeningen (Cardin, 2016). Op basis van de groeiende hoeveelheid bewijs die de betrokkenheid van gamma in het pathomechanisme van depressie suggereert, zijn veranderingen in gamma oscillaties onlangs voorgesteld als een nieuwe biomarker (of endofenotype) voor major depressie en zelfs voor de follow-up van de antidepressieve therapieën (Fitzgerald en Watson, 2018). Van verschillende antidepressiva is aangetoond dat ze de gamma-activiteit veranderen (Fitzgerald en Watson, 2018). Van de SSRI escitalopram is bijvoorbeeld gevonden dat het gammavermogen tijdens rapid eye movement sleep (REMS) afneemt bij acute behandeling, terwijl chronisch escitalopram het gammavermogen verhoogt tijdens slow-wave slaapstadia (Papp et al., 2018). Het is echter nog steeds een open vraag of de drug-geïnduceerde veranderingen van gamma-activiteit in verschillende waakfasen indicatoren of oorzakelijke mediatoren van therapeutische werking zijn, of tekenen van bijwerkingen (Fitzgerald en Watson, 2018).
Volgens onze kennis is er een hiaat in de literatuur met betrekking tot de effecten van selectieve 5-HT2CR-antagonisten op gamma-oscillaties bij mensen en bij knaagdieren. Daarom onderzoeken we hier hoe gamma-vermogen (30-60 Hz) verandert in verschillende waakzaamheidsfasen (i) door acute toediening van de zeer selectieve 5-HT2CR-antagonist SB-242084, (ii) door chronische toediening van de veelgebruikte SSRI escitalopram, (iii) en door hun combinatie.
Methoden
Mannelijke Wistar ratten, gekocht van de lokale dierenfaciliteit (Semmelweis Universiteit, Boedapest, Hongarije), werden gebruikt in de experimenten. De dieren werden gehouden onder gecontroleerde omgevingscondities (21 ± 1 ° C, 12/12 uur licht-donker cyclus met lichten aan om 10 uur), en kregen vrije toegang tot standaard knaagdier chow en leidingwater. Alle huisvestingsomstandigheden en dierproeven werden uitgevoerd in overeenstemming met de EU-Richtlijn 2010/63/EU en de “Principles of Laboratory Animal Care” van de National Institutes of Health (NIH Publications No. 85-23, herzien 1985), alsook specifieke nationale wetten (de Hongaarse Regeringsverordening inzake dierproeven 40/2013). De experimenten werden goedgekeurd door het Nationaal Wetenschappelijk Ethisch Comité voor Dierproeven. Alles werd in het werk gesteld om pijn en ongemak van de dieren tot een minimum te beperken.
Electro-encefalografische (EEG) en elektromyografische (EMG) elektroden werden geïmplanteerd onder 2% halothaan anesthesie, zoals eerder beschreven (Jakus et al., 2003). De ratten wogen 250-280 g bij de operatie. Voor EEG, werden roestvrij staal schroef elektroden epidurally ingebracht over de linker frontale cortex (L: 2,0 mm, A: 2,0 mm tot bregma), linker pariëtale cortex (L: 2,0 mm, A: 2:0 mm tot lambda), en over het cerebellum als een grond elektrode. Voor EMG werden een paar EMG-elektroden (roestvrijstalen veerelektroden bedekt met siliconenrubber, Plastics One Inc., Roanoke, VA, USA) in de nekmusculatuur geplaatst. Na herstel (7 dagen) werden de ratten aan het EEG-systeem gekoppeld met een opnamekabel en een elektrische draaikoppeling die boven de kooien was bevestigd. De dieren bleven gedurende de gehele studie aangesloten.
Voor de chronische voorbehandeling kregen de ratten 10 mg/kg/dag escitalopram-oxalaat-oplossing (ESC Gedeon Richter Plc., Hongarije, opgelost in een oplossing van 0,3 N HCl in gedestilleerd water) of voertuig (VEH; oplossing van 0,3 N HCl in gedestilleerd water) via osmotische minipomp (2ML4, ALZET, 2,5 μl/h, DURECT Corporation, USA) gedurende 21 dagen. Op de 21e dag kregen de ratten intraperitoneale injecties van 1 mg/kg SB-242084 of het medium in een volume van 1 ml/kg lichaamsgewicht. De ratten werden willekeurig in de volgende vier groepen verdeeld: VEH+veh (n = 6), VEH+SB (n = 6), ESC+veh (n = 6), en ESC+SB (n = 6).
EEG, EMG, en motorische activiteit werden opgenomen gedurende ten minste 3 uur na de injecties, te beginnen bij het begin van het licht. De signalen werden versterkt door analoge filters (Coulburn Lablinc System, USA; filtering onder 0,50 Hz en boven 100 Hz bij 6 dB/octaaf) en onderworpen aan analoog naar digitaal conversie (MVRD-2200 V, Canopus, Japan) met een bemonsteringsfrequentie van 128 Hz. De gegevens werden opgeslagen op een computer voor verdere verwerking.
De polygrafische opnamen werden gescoord met behulp van de geautomatiseerde scoring functie van Sleep Sign for Animal (Kissei Comtec America Inc, USA) software voor 4-s epochs, gevolgd door visueel toezicht. Zes waakzaamheid stadia werden onderscheiden op basis van conventionele criteria (Kantor et al., 2004) als volgt (zie Supplementary Figuur 1 voor representatieve sporen). In actieve waakzaamheid (AW), wordt het EEG gekenmerkt door lage-amplitude activiteit op beta (14-29 Hz) en alpha (10-13 Hz) frequenties, in aanvulling op intense EMG en motorische activiteit. Bij passieve waakzaamheid (PW) is het EEG-patroon vergelijkbaar met AW, gepaard gaande met een relatief hoge EMG-activiteit en minimale of geen motorische activiteit. In de lichte trage slaap (SWS-1) wordt het EEG gekenmerkt door trage corticale golven met hoge amplitude (0,5-4 Hz) onderbroken door spindels (6-15 Hz), vergezeld van verminderde EMG-activiteit en geen motorische activiteit. In de diepe trage slaap (SWS-2) wordt het EEG gedomineerd door continue trage corticale golven met hoge amplitude, met verminderde EMG en zonder motorische activiteit. In de intermediaire fase van de slaap (IS), die meestal voor of na REMS optreedt, wordt het EEG gekenmerkt door een associatie van spindels met hoge amplitude en theta (5-9 Hz) golven. In REMS wordt het EEG gedomineerd door lage-amplitude en hoogfrequente activiteit met regelmatige theta-golven, naast de stille EMG en motorische activiteit met af en toe een spiercontractie (twitching). Epochs die waren vervuild met artefacten of bevatten overgang tussen waakzaamheid stadia werden verwijderd.
De kwantitatieve EEG (qEEG) analyse werd berekend voor opeenvolgende 4-s epochs in het frequentiegebied van 0,5-60 Hz door middel van snelle Fourier transformatie (Hanning venster, frequentieresolutie van 0,25 Hz). Aangrenzende bins van 0,25 Hz werden samengeteld tot bins van 1 Hz, die door hun bovengrens worden gemarkeerd. De macht waarden van epochs in AW, PW, SWS-1, SWS-2, IS, en REMS werden afzonderlijk gemiddeld in de samengevatte 3 h, of in de eerste, tweede, en derde h respectievelijk, na behandelingen om macht dichtheid waarden voor deze slaap-waak stadia te verkrijgen. In dit rapport hebben we ons geconcentreerd op het 30-60 Hz frequentiegebied van de EEG power spectra. Gegevens binnen 49-51 Hz werden uitgesloten van de analyse om contaminatie van de 50 Hz interferentieruis van het elektrische netwerk te vermijden. Alle gegevens werden log-getransformeerd voor analyse.
Voor power spectrale analyse, vergelijkingen tussen groepen werden uitgevoerd door twee-weg ANOVA op herhaalde maatregelen met twee hoofdfactoren: behandeling (niet-herhaald) en gamma frequentie bins (herhaald), gevolgd door Bonferroni post hoc test. Om behandelingseffecten in elk uur te onderzoeken, werden de samengevatte 30-60 Hz vermogensgegevens (met uitzondering van die van 49-51 Hz) geanalyseerd met een eenweg ANOVA, betreffende respectievelijk AW, PW, SWS-1, SWS-2, IS, en REMS. Na detectie van een significant hoofdeffect van de behandeling werden post hoc Newman-Keuls tests uitgevoerd. Statistische significantie werd aanvaard wanneer p < 0.05.
In onze experimentele opzet werden de controle ratten (VEH+veh) blootgesteld aan dezelfde procedures als de met medicatie behandelde. De vergelijking van de met medicamenten behandelde groepen en de controlegroep is dus gericht op het minimaliseren van het ongemak veroorzaakt door de injecties en de aanwezigheid van de minipompen, waardoor de effecten van de medicamenten kunnen worden bestudeerd. Voor spectrale grafieken, ten gunste van een betere zichtbaarheid (als EEG-vermogen gegevens volgen een dalende tendens met toenemende frequenties), hebben we genormaliseerd vermogen waarden van de drug-behandelde ratten aan het gemiddelde vermogen spectrale waarden van de controle degenen (VEH + Veh groep), waardoor de relatieve gegevens. Absolute gegevens worden gepresenteerd op de staafdiagrammen, als samengevatte vermogenswaarden. De gegevens worden uitgedrukt als gemiddelde ± SEM van zes dieren per groep.
Resultaten
Effecten van de drugs (acute SB-242084, chronische escitalopram, en hun combinatie) op het qEEG in de 30-60 Hz gamma bereik werden afzonderlijk geëvalueerd voor de zes waakzaamheid stadia door het gemiddelde te nemen van de macht gegevens in de eerste 3 uur van de passieve fase (figuur 1). Uit de analyse bleek dat alle geneesmiddelen waakzaamheidsfase-afhankelijke veranderingen in dit frequentiegebied veroorzaakten, met een neiging tot verhoging in elke fase, in vergelijking met de VEH+veh-groep.
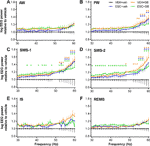
Figuur 1 EEG-vermogensveranderingen in het gammafrequentiegebied (30-60 Hz) na toediening van acute SB-242084 (VEH+SB), chronische escitalopram (ESC+veh), en hun combinatie (ESC+SB) in de eerste 3 uur van de passieve fase. Vermogensspectra worden getoond in de volgende zes waakzaamheidsfasen: (A) actieve (AW) en (B) passieve waakzaamheid (PW), (C) lichte (SWS-1) en (D) diepe slow-wave slaap (SWS-2), (E) intermediaire fase (IS), en (F) rapid eye movement sleep (REMS). De EEG-gegevens worden weergegeven als gemiddelde ± SEM, ten opzichte van de VEH+veh controlegroep (n = 6 dieren per groep). *Significante post hoc resultaten vergeleken met controle, p < 0.05.
Tijdens AW, ANOVA resultaten toonden geen significante veranderingen (behandeling effect: F3,20 = 1,917, p = 0,1594; behandeling x frequentie interactie: F81,540 = 1.218, p = 0.1081; Figuur 1A). Tijdens PW werd echter een matig verhoogde power line gezien in de SB groepen, en bij de hogere frequenties ook in de ESC+veh groep (behandelingseffect: F3,20 = 2,217, p = 0,1176; significante behandeling x frequentie interactie: F81,540 = 2,519, p < 0,001; figuur 1B).
De meest prominente effecten werden waargenomen tijdens de slow-wave slaapfasen, waar de acute SB-242084, de chronische escitalopram, en ook de gecombineerde behandeling een verhoging van het vermogen veroorzaakten. Dit werd ondersteund door significante ANOVA resultaten in SWS-1 (behandelingseffect: F3,20 = 3.692, p = 0.0290; significante behandeling x frequentie interactie: F81,540 = 2.693, p < 0.001; figuur 1C), en in SWS-2 (significant behandelingseffect: F3,20 = 4,787, p = 0,0113; significante interactie behandeling x frequentie: F81,540 = 1.911, p < 0.001; figuur 1D).
De toename van het gammavermogen was niet significant tijdens IS (behandelingseffect: F3,20 = 2,349, p = 0,1031, behandeling x frequentie interactie: F81,540 = 1,241, p = 0,0878; figuur 1E). Tenslotte had tijdens de REMS noch de acute SB-242084 noch de chronische escitalopram invloed op het EEG-vermogen in dit frequentiegebied (behandelingseffect: F3,19 = 2,515, p = 0,0891; behandeling x frequentie interactie: F81,513 = 1,226, p = 0,1014; Figuur 1F). We merken op dat de gegevens van slechts n = 5 dieren werden gebruikt in de ESC + SB-groep, zoals een dier heeft geen tijd doorgebracht in REMS in dit tijdsinterval.
Voor significante Bonferroni post hoc verschillen na de significante twee-weg ANOVA resultaten hierboven beschreven, zie figuur 1 voor elke waakzaamheid fase. Er werden geen significante post-hocverschillen gezien in een van de stadia wat betreft vergelijkingen van VEH+SB versus ESC+veh, VEH+SB versus ESC+SB, en ESC+veh versus ESC+SB, respectievelijk.
De slaap-waakstadium-afhankelijke effecten van de drugs op het totale gammavermogen werden per uur geanalyseerd. One-way ANOVA onthulde dat, hoewel in de eerste uur van SWS-1, het behandelingseffect nog niet significant was (F3,20 = 2,544, p = 0,0851), in de tweede (F3,20 = 3,331, p = 0,0403) en derde uur (F3,20 = 4,607, p = 0,0131) de vermogensstijgingen significant waren. In SWS-2 toonde de ANOVA significante behandelingseffecten in elk uur (F3,18 = 4,062, p = 0,0228; F3,20 = 5,348, p = 0,0072; F3,20 = 4,910, p = 0,0102, respectievelijk). Ook werd een significant effect gevonden in het tweede uur van IS (F3,20 = 3,452, p = 0,0360), maar niet in het eerste of derde uur. Tenslotte werd geen significant behandelingseffect gevonden in deze uren in AW, PW, en REMS. Voor significante post hoc resultaten, zie figuur 2 voor elke waakzaamheid fase.
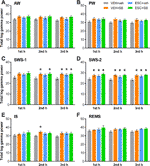
Figuur 2 Totaal EEG-vermogen in het gamma-frequentiegebied (30-60 Hz) na toediening van acute SB-242084 (VEH+SB), chronische escitalopram (ESC+veh), en hun combinatie (ESC+SB) in de eerste, tweede en derde uur van de passieve fase, tijdens (A) actieve (AW) en (B) passieve waakzaamheid (PW), (C) lichte (SWS-1) en (D) diepe slow-wave slaap (SWS-2), (E) tussenstadium (IS), en (F) rapid eye movement sleep (REMS). Samengevatte EEG-vermogen gegevens worden gepresenteerd als gemiddelde ± SEM (van n = 6 dieren per groep). *Significante post hoc resultaten vergeleken met de controlegroep (VEH+veh), p < 0.05.
Discussie
Dit is de eerste studie die de acute effecten onderzoekt van de selectieve 5-HT2CR-antagonist SB-242084 op de gamma frequentieband van de EEG spectra in verschillende waakzaamheidsstadia. Bovendien werd het getest met of zonder chronische SSRI voorbehandeling. Hier rapporteren we een verhoogd gamma band vermogen tijdens SWS-2, SWS-1, en PW na toediening van acute SB-242084, (1 mg/kg, ip.), bij ratten. Onze bevindingen over de aanvullende 21 dagen durende voorbehandeling met escitalopram (10 mg/kg/dag, osmotische minipompen) tonen aan dat SB-242084 het door de chronische behandeling met antidepressiva veranderde gammavermogen niet verder wijzigt. Bovendien leken de acute effecten van SB-242084 en de chronische effecten van escitalopram op het gammavermogen in de meeste waakzaamheidsfasen sterk overeen te komen. De effecten van de combinatie van deze twee behandelingen werden echter niet als additief beschouwd.
Hersenfuncties die verband houden met gamma-activiteit werden besproken in het inleidende gedeelte. Gamma oscillaties zijn beschreven in meerdere gebieden van de hersenen, zoals neocortex, entorhinale cortex, hippocampus, thalamus, amygdala, olfactorische bol, en striatum. Hun generatie is gebonden aan perisomatische inhibitie; vooral, de activiteit van parvalbumin-positieve interneuronen via gamma-aminoboterzuur (GABA)A synapsen (Buzsaki en Wang, 2012). Gamma oscillaties zouden een belangrijke rol spelen bij depressie, wat wordt ondersteund door zowel menselijke als dierlijke bevindingen. Namelijk, gamma-afwijkingen werden gemeten bij depressieve patiënten, en ook in diermodellen van depressie, waar veranderingen in gamma werden geassocieerd met therapeutisch herstel (Khalid et al., 2016; Noda et al., 2017; Fitzgerald en Watson, 2018).
Verschillende farmacologische (gericht op serotonine-, noradrenaline-, dopamine- en glutamaatsystemen) en niet-farmacologische behandelingen van depressie hebben aangetoond de gamma-activiteit te veranderen (Fitzgerald en Watson, 2018). Van escitalopram, het veelgebruikte SSRI antidepressivum, dat inwerkt op het serotonerge systeem, is bijvoorbeeld aangetoond dat het gammavermogen tijdens REMS vermindert door acute behandeling, terwijl de chronische toediening ervan het gammavermogen verhoogt in slow-wave slaapstadia, bij ratten (Papp et al., 2018). Belangrijk is dat antidepressiva die werken op het noradrenerge systeem, zoals reboxetine en desipramine, het gammavermogen (evenals de theta) in het septo-hippocampale systeem verhoogden na acute behandeling, terwijl de SSRI fluvoxamine een dergelijk effect in dezelfde studie niet teweegbracht (Hajos et al., 2003a). Van de veronderstelde volgende generatie antidepressiva, zoals ketamine en zijn metaboliet (2R,6R)-hydroxynorketamine, is aangetoond dat zij het gammavermogen aanzienlijk verhogen wanneer zij worden toegepast in doses die relevant zijn voor antidepressiva. Deze effecten en ook hun antidepressiva-achtige acties werden voorkomen door voorbehandeling met een α-amino-3-hydroxy-5-methyl-4-isoxazool propionzuurreceptor (AMPAR) remmer (Zanos et al., 2016). Ten slotte hebben Fitzgerald en Watson onlangs voorgesteld dat gammasignalering een biomarker kan bieden voor de antidepressieve effecten van alle klassen antidepressiva, omdat volgens hun hypothese alle klassen antidepressiva gemeenschappelijke eindeffecten kunnen hebben op het limbische circuit (Fitzgerald en Watson, 2019).
In deze studie onderzochten we geneesmiddelen die werken op het 5-HT-systeem, namelijk een antagonist van 5-HT2CR en een SSRI met als belangrijkste werking het verhogen van het extracellulaire niveau van 5-HT door de synaptische heropname ervan via de 5-HT-transporter te remmen. Er zijn steeds meer aanwijzingen dat 5-HT2CR-antagonisme gunstige effecten zou kunnen hebben bij de behandeling van depressie en angst, hoewel deze effecten van de selectieve 5-HT2CR-antagonisten nog niet in klinische studies zijn getest. De relevantie van het combineren van 5-HT2CR-antagonisten met SSRI’s wordt bevestigd door de acute gelijktijdige toediening van de selectieve 5-HT2CR-antagonisten SB-242084 of RS-102221 met de SSRI citalopram, die in een microdialyse studie bij ratten (Cremers e.a., 2004) de door citalopram veroorzaakte verhogingen van de 5-HT-spiegel deed toenemen in gebieden die betrokken zijn bij de pathofysiologie van depressieve stoornissen. De behandeling vooraf met SB-242084 heeft ook de door citalopram veroorzaakte toename van de angstgevoelens bij ratten teruggedraaid (Burghardt et al., 2007). Verder is in een recent artikel aangetoond dat acute behandeling met SB-242084 na chronische (21 dagen) behandeling met fluoxetine het angst- en depressieachtige gedrag verminderde, en de SSRI-geïnduceerde bijwerkingen bij muizen verbeterde (Demireva et al, 2018).
In de huidige studie werd de dosis van 1 mg/kg SB-242084 gekozen, gebaseerd op eerdere gedragsstudies (Kennett et al., 1997; Martin et al., 2002; Opal et al., 2014) en slaap- en/of EEG-studies (Popa et al., 2005; Sorman et al., 2011; Bogathy et al., 2019) bij knaagdieren. Belangrijk is dat Kantor et al. hebben aangetoond dat, hoewel 0,3 en 1,0 mg/kg doses van het geneesmiddel vergelijkbare anxiolytische effecten produceerden, alleen de hogere dosis de slaap-waak architectuur prominent beïnvloedde (wake-bevorderend effect met vermindering van SWS-2), bij Sprague-Dawley ratten (Kantor et al., 2005). Een REMS-verminderend effect is gevonden bij 1 mg/kg dosis in Wistar ratten, en theta power verhogingen tijdens AW en REMS zijn ook waargenomen na deze behandeling (Kostyalik et al., 2014).
Het effect van de SB-242084 en escitalopram op gamma-activiteit werd apart geanalyseerd in waakfasen, omdat hersenfuncties en bijbehorende oscillatoire activiteit, en neurotransmitter niveaus karakteristieke verschillen vertonen tussen fasen. De rol van gamma-oscillaties in functies die gekoppeld zijn aan waakzaamheid zoals gerichte aandacht, cognitie, en sensorische verwerking is goed gedocumenteerd (Cardin, 2016), hun functionele belang tijdens slaap is echter minder begrepen. Tijdens REMS, is een rol van gamma (voorbij theta) oscillaties in geheugenconsolidatie gesuggereerd (Montgomery et al., 2008). Een recent artikel heeft voorgesteld dat verhoogde gamma kracht in fasische REMS microstate in bepaalde gebieden geassocieerd is met emotionele verwerking, bij mensen (Simor et al., 2019). Tijdens niet-REMS zouden gamma-oscillaties geassocieerd kunnen zijn met fasische verhogingen van neurale activiteit tijdens langzame oscillaties (Valderrama et al., 2012). Een microelectrode-studie bij apen en mensen heeft de rol van gamma- (en bèta-) oscillaties tijdens non-REMS verder benadrukt, namelijk een hoge oscillatiecoherentie suggereert een bijdrage een bijdrage van gamma aan geheugenconsolidatie aan geheugenconsolidatie tijdens non-REMS (Quyen et al, 2016).
Wij vonden dat een enkele dosis SB-242084 het gammavermogen verhoogde tijdens SWS-2, SWS-1, en- in mindere mate- PW, maar niet tijdens REMS, IS, en AW.
5-HT neuronen vuren het actiefst tijdens waaksheid, hun activiteit neemt af tijdens slow-wave slaap, en valt stil tijdens REMS. Het 5-HT systeem wordt dus beschouwd als een belangrijke modulator van slaap-waak gedrag (Monti, 2011) en hersenoscillaties, hoewel de cellulaire mechanismen en de receptoren die betrokken zijn bij deze processen complex zijn en slecht begrepen worden (Puig en Gener, 2015). 5-HT op zich bleek de gamma-activiteit in de prefrontale cortex van de rat te beïnvloeden via 5-HT1ARs en 5-HT2ARs, maar niet via 5-HT2CRs, wat resulteert in een algehele afname van de amplitude bij verdoofde ratten (Puig et al., 2010). Verder is er toenemend bewijs voor het belang van het DA-systeem in de synchronisatie van snel-sprekende interneuronen, waardoor gamma-oscillaties worden gegenereerd/gereguleerd (Furth et al., 2013).
5-HT2CR is vermoedelijk het 5-HT receptor subtype met de meest wijdverspreide verspreiding in de hersenen. Het is beschreven op GABA-erge interneuronen in tal van regio’s, en wordt ook uitgedrukt door DA neuronen. Dit receptor subtype wordt echter niet tot expressie gebracht door 5-HT en noradrenerge (NA) neuronen. De rol van 5-HT2CRs in de modulatie van de monoaminerge, en intrigerend, de DA systemen is onderstreept door verschillende preklinische studies (Di Giovanni en De Deurwaerdere, 2016; De Deurwaerdere en Di Giovanni, 2017). Lokale stimulatie van de 5-HT2CR’s in specifieke hersengebieden produceerde angst op een regio-afhankelijke manier, en op hun beurt oefenden subtype-selectieve 5-HT2CR-antagonisten zoals SB-242084 duidelijke anxiolytische acties uit (Bagdy et al., 2001; Di Giovanni en De Deurwaerdere, 2016). Verschillende anxiolytica en antidepressiva bezitten 5-HT2CR antagonistische eigenschappen, bijvoorbeeld talrijke tricyclische antidepressiva, mianserin, mirtazapine, trazodon, nefazodon, fluoxetine, en agomelatine (Martin et al., 2014). Aan de andere kant zijn selectieve 5-HT2CR antagonisten gesuggereerd als putative fast-onset antidepressiva op basis van preklinische studies (Opal et al., 2014).
Er zijn enkele studies gepubliceerd met betrekking tot kwalitatieve (beïnvloeding van slaap-waak architectuur) en kwantitatieve (beïnvloeding van power spectra, d.w.z. oscillaties) slaap-waak effecten van 5-HT2CR antagonisten, en SB-242084 in het bijzonder. Kantor e.a. hebben de dosis-afhankelijke effecten van SB-242084 op angst, waakzaamheid en EEG-spectra onder 30 Hz bij ratten onderzocht. Zij vonden een verhoogd theta-vermogen bij waakzaamheid (dat wijst op een mogelijk cognitief versterkend effect, aangezien theta-activiteit in verband wordt gebracht met leer- en geheugenprocessen), zelfs bij een dosis van 0,1 mg/kg. Daarentegen verhoogde het geneesmiddel de waakzaamheid en onderdrukte het SWS-2 in de eerste uur van de passieve fase alleen bij een dosis van 1 mg/kg. Met betrekking tot delta, alpha, of beta frequentiebanden tijdens waakzaamheid, REMS, SWS-1, of SWS-2, werd geen significante verandering gerapporteerd in dit artikel (Kantor et al., 2005). Kostyalik et al. hebben beschreven dat SB-242084 de PW-duur verhoogde en REMS onderdrukte, welk effect werd verzwakt door chronische ESC-voorbehandeling, bij ratten. Met betrekking tot qEEG hebben zij een verhoogd theta-vermogen gevonden tijdens AW en ook tijdens REMS dat niet verder werd gewijzigd door chronische escitalopram voorbehandeling (Kostyalik et al., 2014). Het theta-verhogende effect van de 5-HT2CR-antagonist en daarmee de rol van 5-HT2CR in de regulatie van theta-activiteit zijn ondersteund door Hajos et al. (2003b).
De effecten van escitalopram en andere SSRI’s op slaap-waakarchitectuur en EEG-parameters bij mensen en knaagdieren zijn uitgebreider bestudeerd (Wilson en Argyropoulos, 2005; Vas et al., 2013; Fitzgerald en Watson, 2019). Onlangs hebben we gamma-vermogensveranderingen gemeld na acute (vermindering tijdens REMS) en chronische (verhoging tijdens SWS-1 en SWS-2) toediening aan ratten (Papp et al., 2018).
Intrigerend is dat de acute effecten van SB-242084 vergelijkbaar waren met die veroorzaakt door chronische escitalopram, met andere woorden, selectief antagonisme op 5-HT2CR produceerde vergelijkbare effecten op gamma-activiteit als de chronische blokkade van de 5-HT-transporter en aanvullende effecten die escitalopram uitoefent. In dat geval veronderstellen we dat effecten van 5-HT, namelijk de desensibilisatie van 5-HT1AR (en mogelijk ook 5-HT2AR), de toename van gammavermogen in die stadia kunnen verklaren, zoals we hebben voorgesteld in ons eerdere artikel (Papp et al., 2018).
Om onze bevindingen te verklaren, moeten we rekening houden met het feit dat 5-HT2CR’s 5-HT-, NA-, en belangrijk, DA-neuronale activiteit kunnen moduleren (Di Giovanni en De Deurwaerdere, 2016). Constitutieve activiteit van de 5-HT2CRs is gerapporteerd om remmende controle uit te oefenen op DA neuron activiteit, die werd omgekeerd door systemische toediening van 5-HT2CR antagonisten. SB-242084 en SB-206553 verhoogden significant de basale DA-afgifte in DA-geïnnerveerde gebieden van de hersenen van de rat. De door SB-242084 opgewekte DA-afgifte was echter gering, en bereikte een maximum in vergelijking met SB-206553 (De Deurwaerdere e.a., 2004). Interessant is dat SSRI’s ook betrokken zijn bij het reguleren van DA-erge signalering (wat zou kunnen wijzen op een mogelijk gemeenschappelijk kenmerk van de twee onderzochte drugs), hoewel de beschikbare literatuurgegevens ambigu zijn. Terwijl acute escitalopram het vuren en bursten van neuronen in de ventrale tegmentale zone zou verhogen (Schilstrom et al., 2011), heeft een andere studie aangetoond dat een 2 weken durende toediening van escitalopram het vuren en bursten van deze neuronen vermindert, bij verdoofde ratten (Dremencov et al., 2009).
De bevindingen van deze studie moeten worden geïnterpreteerd in de context van enkele beperkingen. SB-242084 werd slechts in één dosis toegediend, en we hebben niet getest of het gamma-verhogende effect van het geneesmiddel dosisafhankelijk is. Bovendien was onze analyse beperkt tot een maximum van 60 Hz als gevolg van de Nyquist limiet bepaald door de nominale sampling rate, dus verder werk is nodig om snellere gamma frequenties te onderzoeken, evenals hoogfrequente oscillaties (HFO) en rimpelingen.
Alles bij elkaar laten onze bevindingen vergelijkbare effecten zien tussen acute SB-242084 en chronische escitalopram op gamma-activiteit, die preklinisch (en indirect klinisch) bewijs ondersteunen dat acute of kortdurende behandeling met 5-HT2CR-antagonisten antidepressieve effecten kan hebben. Ons werk zou dus verder bewijs kunnen leveren dat 5-HT2CR-antagonisten gunstig kunnen zijn bij de behandeling van depressie en/of angst. Of veranderingen in gamma-activiteit markers zijn van therapeutische werking of mediatoren van therapeutisch effect, blijft een onopgeloste vraag die verder onderzoek vereist.
Data Availability Statement
De datasets die tijdens de huidige studie zijn gegenereerd en geanalyseerd, zijn niet voor het publiek beschikbaar vanwege de lopende analyse voor toekomstige publicatie, maar zijn op redelijk verzoek beschikbaar bij de corresponderende auteur.
Ethische verklaring
Alle huisvestingsomstandigheden en dierexperimenten werden uitgevoerd in overeenstemming met de EU-richtlijn 2010/63/EU en de National Institutes of Health “Principles of Laboratory Animal Care” (NIH Publications No. 85-23, herzien 1985), evenals specifieke nationale wetten (de Hongaarse regeringsverordeningen inzake dierstudies 40/2013). De experimenten werden goedgekeurd door het Nationaal Wetenschappelijk Ethisch Comité voor Dierproeven, en toegestaan door de overheid (Directie Veiligheid van de Voedselketen en Diergezondheid van het Centraal Landbouwbureau, Vergunning nr. 22.1/1375/7/2010).
Bijdragen van auteurs
GB en TK ontwierpen de experimenten. DK, SV, en PP voerden de experimentele procedures uit. GB, DK, SV, en NP droegen bij aan de gegevensanalyse. NP, SK, SV, en GB interpreteerden de resultaten. NP, SK, en GB schreven de eerste versie van het manuscript. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd.
Funding
Dit werk werd ondersteund door de National Development Agency (KTIA_NAP_13-1-2013-0001) Hongaarse Brain Research Program (Grant No. KTIA_13_NAP-A-II/14), NAP 2.0 (Grant No. 2017-1.2.1-NKP-2017-00002); ITM/NKFIH Thematic Excellence Programme, Semmelweis University; en de SE-Neurologie FIKP-subsidie van EMMI.
Conflict of Interest
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Wij danken Zita Kátai en Emese Bogáthy voor hun hulp bij de experimenten en/of analyse van de gegevens.
Supplementary Material
Het Supplementary Material voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fphar.2019.01636/full#supplementary-material
Bagdy, G., Graf, M., Anheuer, Z. E., Modos, E. A., Kantor, S. (2001). Anxiety-like effects induced by acute fluoxetine, sertraline or m-CPP treatment are reversed by prereatment with the 5-HT2C receptor antagonist SB-242084 but not the 5-HT1A receptor antagonist WAY-100635. Int. J. Neuropsychopharmacol. 4 (4), 399-408. doi: 10.1017/S1461145701002632
PubMed Abstract | CrossRef Full Text | Google Scholar
Bagdy, G. (1998). Serotonine, angst en stresshormonen. Focus op 5-HT receptor subtypes, species en gender verschillen. Ann. N. Y. Acad. Sci. 851, 357-363. doi: 10.1111/j.1749-6632.1998.tb09009.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bogathy, E., Papp, N., Tothfalusi, L., Vas, S., Bagdy, G. (2019). Additief effect van 5-HT2C en CB1 receptor blokkade op de regulatie van de slaap-waak cyclus. BMC Neurosci. 20 (1), 14. doi: 10.1186/s12868-019-0495-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Burghardt, N. S., Bush, D. E., McEwen, B. S., LeDoux, J. E. (2007). Acute selective serotonin reuptake inhibitors increase conditioned fear expression: blockade with a 5-HT(2C) receptor antagonist. Biol. Psychiatry 62 (10), 1111-1118. doi: 10.1016/j.biopsych.2006.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., Wang, X. J. (2012). Mechanismen van gamma oscillaties. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
PubMed Abstract | CrossRef Full Text | Google Scholar
Cardin, J. A. (2016). Snapshots van de hersenen in actie: lokale circuit operaties door de lens van gamma oscillaties. J. Neurosci. 36 (41), 10496-10504. doi: 10.1523/JNEUROSCI.1021-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Chagraoui, A., Thibaut, F., Skiba, M., Thuillez, C., Bourin, M. (2016). 5-HT2C receptoren in psychiatrische stoornissen: een overzicht. Prog. Neuropsychopharmacol. Biol. Psychiatry 66, 120-135. doi: 10.1016/j.pnpbp.2015.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Cremers, T. I., Giorgetti, M., Bosker, F. J., Hogg, S., Arnt, J., Mork, A., et al. (2004). Inactivation of 5-HT(2C) receptors potentiates consequences of serotonin reuptake blockade. Neuropsychopharmacology 29 (10), 1782-1789. doi: 10.1038/sj.npp.1300474
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Di Giovanni, G. (2017). Serotonerge modulatie van de activiteit van mesencefalische dopaminerge systemen: therapeutische implicaties. Prog. Neurobiol. 151, 175-236. doi: 10.1016/j.pneurobio.2016.03.004
PubMed Abstract | CrossRef Full Text | Google Scholar
De Deurwaerdere, P., Navailles, S., Berg, K. A., Clarke, W. P., Spampinato, U. (2004). Constitutive activity of the serotonin2C receptor inhibits in vivo dopamine release in the rat striatum and nucleus accumbens. J. Neurosci. 24 (13), 3235-3241. doi: 10.1523/JNEUROSCI.0112-04.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Dekeyne, A., Denorme, B., Monneyron, S., Millan, M. J. (2000). Citalopram vermindert sociale interactie bij ratten door activering van serotonine (5-HT)(2C) receptoren. Neuropharmacology 39 (6), 1114-1117. doi: 10.1016/s0028-3908(99)00268-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Demireva, E. Y., Suri, D., Morelli, E., Mahadevia, D., Chuhma, N., Teixeira, C. M., et al. (2018). 5-HT2C receptor blokkade keert SSRI-geassocieerde basale ganglia disfunctie om en versterkt de therapeutische werkzaamheid. Mol. Psychiatry. doi: 10.1038/s41380-018-0227-x
CrossRef Full Text | Google Scholar
Di Giovanni, G., De Deurwaerdere, P. (2016). Nieuwe therapeutische mogelijkheden voor 5-HT2C receptor liganden bij neuropsychiatrische aandoeningen. Pharmacol. Ther. 157, 125-162. doi: 10.1016/j.pharmthera.2015.11.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Dremencov, E., El Mansari, M., Blier, P. (2009). Effects of sustained serotonin reuptake inhibition on the firing of dopamine neurons in the rat ventral tegmental area. J. Psychiatry Neurosci. 34 (3), 223-229.
PubMed Abstract | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2018). Gamma oscillaties als biomarker voor major depressie: een opkomend onderwerp. Transl. Psychiatry 8 (1), 177. doi: 10.1038/s41398-018-0239-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitzgerald, P. J., Watson, B. O. (2019). In vivo elektrofysiologische opnames van de effecten van antidepressiva. Exp. Brain Res. 237 (7), 1593-1614. doi: 10.1007/s00221-019-05556-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Furth, K. E., Mastwal, S., Wang, K. H., Buonanno, A., Vullhorst, D. (2013). Dopamine, cognitieve functie, en gamma oscillaties: rol van D4 receptoren. Front. Cell Neurosci. 7, 102. doi: 10.3389/fncel.2013.00102
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Robinson, D. D., Yu, J. H., Hajos-Korcsok, E. (2003a). Norepinephrine maar niet serotonine heropname remmers verhogen de theta en gamma activiteit van het septo-hippocampale systeem. Neuropsychopharmacology 28 (5), 857-864. doi: 10.1038/sj.npp.1300116
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajos, M., Hoffmann, W. E., Weaver, R. J. (2003b). Regeling van septo-hippocampale activiteit door 5-hydroxytryptamine(2C) receptoren. J. Pharmacol. Exp. Ther. 306 (2), 605-615. doi: 10.1124/jpet.103.051169
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakus, R., Graf, M., Juhasz, G., Gerber, K., Levay, G., Halasz, P., et al. (2003). 5-HT2C receptoren remmen en 5-HT1A receptoren activeren de generatie van spike-golf ontladingen in een genetisch rattenmodel van absence epilepsie. Exp. Neurol. 184 (2), 964-972. doi: 10.1016/S0014-4886(03)00352-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Balogh, B., Benko, A., Bagdy, G. (2004). Increased wakefulness, motor activity and decreased theta activity after blockade of the 5-HT2B receptor by the subtype-selective antagonist SB-215505. Br. J. Pharmacol. 142 (8), 1332-1342. doi: 10.1038/sj.bjp.0705887
PubMed Abstract | CrossRef Full Text | Google Scholar
Kantor, S., Jakus, R., Molnar, E., Gyongyosi, N., Toth, A., Detari, L., et al. (2005). Despite similar anxiolytic potential, the 5-hydroxytryptamine 2C receptor antagonist SB-242084 indoline] and chlordiazepoxide produced different effects on electroencephalogram power spectra. J. Pharmacol. Exp. Ther. 315 (2), 921-930. doi: 10.1124/jpet.105.086413
PubMed Abstract | CrossRef Full Text | Google Scholar
Kennett, G. A., Wood, M. D., Bright, F., Trail, B., Riley, G., Holland, V., et al. (1997). SB 242084, een selectieve en hersenpenetrerende 5-HT2C receptor antagonist. Neuropharmacology 36 (4-5), 609-620. doi: 10.1016/s0028-3908(97)00038-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Khalid, A., Kim, B. S., Seo, B. A., Lee, S. T., Jung, K. H., Chu, K., et al. (2016). Gamma oscillatie in functionele hersennetwerken is betrokken bij de spontane remissie van depressief gedrag geïnduceerd door chronische dwangstress bij muizen. BMC Neurosci. 17, 4. doi: 10.1186/s12868-016-0239-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyalik, D., Katai, Z., Vas, S., Pap, D., Petschner, P., Molnar, E., et al. (2014). Chronische escitalopram behandeling veroorzaakt dissociatieve aanpassing in serotonine (5-HT) 2C receptor antagonist-geïnduceerde effecten in REM slaap, waken en theta golf activiteit. Exp. Brain Res. 232 (3), 935-946. doi: 10.1007/s00221-013-3806-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, J. R., Ballard, T. M., Higgins, G. A. (2002). Influence of the 5-HT2C receptor antagonist, SB-242084, in tests of anxiety. Pharmacol. Biochem. Behav. 71 (4), 615-625. doi: 10.1016/s0091-3057(01)00713-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, C. B., Hamon, M., Lanfumey, L., Mongeau, R. (2014). Controverses over de rol van 5-HT(2C) receptoren in de werkingsmechanismen van antidepressiva. Neurosci. Biobehav. Rev. 42, 208-223. doi: 10.1016/j.neubiorev.2014.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Montgomery, S. M., Sirota, A., Buzsaki, G. (2008). Theta en gamma coördinatie van hippocampale netwerken tijdens waken en rapid eye movement slaap. J. Neurosci. 28 (26), 6731-6741. doi: 10.1523/JNEUROSCI.1227-08.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Monti, J. M. (2011). Serotonine controle van slaap-waak gedrag. Sleep Med. Rev. 15 (4), 269-281. doi: 10.1016/j.smrv.2010.11.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Noda, Y., Zomorrodi, R., Saeki, T., Rajji, T. K., Blumberger, D. M., Daskalakis, Z. J., et al. (2017). Resting-state EEG gamma power and theta-gamma coupling enhancement following high-frequency left dorsolateral prefrontal rTMS in patients with depression. Clin. Neurophysiol. 128 (3), 424-432. doi: 10.1016/j.clinph.2016.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Opal, M. D., Klenotich, S. C., Morais, M., Bessa, J., Winkle, J., Doukas, D., et al. (2014). Serotonine 2C receptor antagonisten induceren fast-onset antidepressieve effecten. Mol. Psychiatry 19 (10), 1106-1114. doi: 10.1038/mp.2013.144
PubMed Abstract | CrossRef Full Text | Google Scholar
Papp, N., Vas, S., Bogathy, E., Katai, Z., Kostyalik, D., Bagdy, G. (2018). Acute en chronische escitalopram veranderen EEG gamma oscillaties verschillend: relevantie voor therapeutische effecten. Eur. J. Pharm. Sci. 121, 347-355. doi: 10.1016/j.ejps.2018.06.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Popa, D., Lena, C., Fabre, V., Prenat, C., Gingrich, J., Escourrou, P., et al. (2005). Contribution of 5-HT2 receptor subtypes to sleep-wakefulness and respiratory control, and functional adaptations in knock-out mice lacking 5-HT2A receptors. J. Neurosci. 25 (49), 11231-11238. doi: 10.1523/JNEUROSCI.1724-05.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Gener, T. (2015). Serotonine modulatie van prefronto-hippocampale ritmes in gezondheid en ziekte. ACS Chem. Neurosci. 6 (7), 1017-1025. doi: 10.1021/cn500350e
PubMed Abstract | CrossRef Full Text | Google Scholar
Puig, M. V., Watakabe, A., Ushimaru, M., Yamamori, T., Kawaguchi, Y. (2010). Serotonine moduleert snel-spike interneuron en synchrone activiteit in de rat prefrontale cortex via 5-HT1A en 5-HT2A receptoren. J. Neurosci. 30 (6), 2211-2222. doi: 10.1523/JNEUROSCI.3335-09.2010
PubMed Abstract | CrossRef Full Text | Google Scholar
Quyen, M. L. V., Muller, L. E., Telenczuk, B., Halgren, E., Cash, S., Hatsopoulos, N. G., et al. (2016). Hoogfrequente oscillaties in menselijke en apen neocortex tijdens de waak-slaap cyclus. Proc. Natl. Acad. Sci. U. S. A. 113 (33), 9363-9368. doi: 10.1073/pnas.1523583113
PubMed Abstract | CrossRef Full Text | Google Scholar
Schilstrom, B., Konradsson-Geuken, A., Ivanov, V., Gertow, J., Feltmann, K., Marcus, M. M., et al. (2011). Effects of S-citalopram, citalopram, and R-citalopram on the firing patterns of dopamine neurons in the ventral tegmental area, N-methyl-D-aspartate receptor-mediated transmission in the medial prefrontal cortex and cognitive function in the rat. Synapse 65 (5), 357-367. doi: 10.1002/syn.20853
PubMed Abstract | CrossRef Full Text | Google Scholar
Simor, P., van Der Wijk, G., Gombos, F., Kovacs, I. (2019). De paradox van rapid eye movement slaap in het licht van oscillatoire activiteit en corticale synchronisatie tijdens fasische en tonische microstates. Neuroimage 202, 116066. doi: 10.1016/j.neuroimage.2019.116066
PubMed Abstract | CrossRef Full Text | Google Scholar
Sorman, E., Wang, D., Hajos, M., Kocsis, B. (2011). Controle van hippocampale theta ritme door serotonine: rol van 5-HT2c receptoren. Neuropharmacology 61 (3), 489-494. doi: 10.1016/j.neuropharm.2011.01.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Steiger, A., Kimura, M. (2010). Wake and sleep EEG provide biomarkers in depression. J. Psychiatr. Res. 44 (4), 242-252. doi: 10.1016/j.jpsychires.2009.08.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Valderrama, M., Crepon, B., Botella-Soler, V., Martinerie, J., Hasboun, D., Alvarado-Rojas, C., et al. (2012). Menselijke gamma oscillaties tijdens slow wave slaap. PloS One 7 (4), e33477. doi: 10.1371/journal.pone.0033477
PubMed Abstract | CrossRef Full Text | Google Scholar
Vas, S., Katai, Z., Kostyalik, D., Pap, D., Molnar, E., Petschner, P., et al. (2013). Differential adaptation of REM sleep latency, intermediate stage and theta power effects of escitalopram after chronic treatment. J. Neural Transm. (Vienna) 120 (1), 169-176. doi: 10.1007/s00702-012-0847-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilson, S., Argyropoulos, S. (2005). Antidepressiva en slaap: een kwalitatief overzicht van de literatuur. Drugs 65 (7), 927-947. doi: 10.2165/00003495-200565070-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
Zanos, P., Moaddel, R., Morris, P. J., Georgiou, P., Fischell, J., Elmer, G. I., et al. (2016). NMDAR inhibitie-onafhankelijke antidepressieve acties van ketamine metabolieten. Nature 533 (7604), 481-486. doi: 10.1038/nature17998
PubMed Abstract | CrossRef Full Text | Google Scholar
.