- Introduction
- Materialen en methoden
- Materialen en chemicaliën
- Cellijn Voorbereiding
- Zebravis Voorbereiding
- Cell Viability Assay and Morphological Observation
- Apoptose analyse door DAPI kleuring en flowcytometrie
- Xenograft Animal Assay
- Real Time PCR (qPCR) Analysis
- Western Blot (WB) Analysis
- Statistische analyse
- Results
- Anti-Proliferatieve Effect van TF
- Pro-apoptotisch effect van TF
- In Vivo Effect van TF op Xenograft Zebrafishes
- Moleculaire werking van TF op mRNA Expressies in A375 Cellen
- Moleculaire werking van TB op Eiwit Expressies in A375 Cellen
- Discussie
- Conclusie
- Data Availability Statement
- Ethics Statement
- Author Contributions
- Funding
- Conflict of Interest
- Afkortingen
Introduction
Melanoom is een fatale vorm van huidkanker, met een hoog metastatisch potentieel en hardnekkigheid (Yang et al., 2018). Melanoompatiënten in gevorderde stadia zijn altijd onresectabel en hebben een slechtere prognose (Leonardi et al., 2018). Chemotherapie is een steunpilaar van de klinische behandeling voor melanoom, maar de werkzaamheid van chemotherapeutica is beperkt vanwege hun bijwerkingen op gezonde weefsels (Oliveira Pinho et al., 2019). Onlangs zijn verschillende immunotherapieën, waaronder CTLA-4- of PD-1-receptorremmers, ontwikkeld als nieuwe opties voor de behandeling van melanoom, maar hun doeltreffendheid is onbetrouwbaar en hun bijwerkingen zijn nog steeds niet te verwaarlozen (Rodríguez-Cerdeira et al., 2017). Daarom is er dringend behoefte aan nieuwe strategieën met een bevredigende effectiviteit en veiligheid. Traditionele Chinese geneeskunde (TCM) is een complementaire benadering en wordt al duizenden jaren klinisch toegepast en bezit een zekere werkzaamheid en minder bijwerkingen. Volgens de TCM-theorie wordt kanker geassocieerd met een ophoping van slijm, gifstoffen of ontstekingen in het lichaam, en kunnen anti-slijm, anti-gif of anti-inflammatoire kruiden kankerremmende effecten hebben (Wang en Cheng, 2019). De theorie is door vele gevallen ondersteund. Curcumine in Rhizoma Curcumae longae oefende bijvoorbeeld cytotoxische effecten uit door apoptose te induceren en angiogenese van melanoomcellen te remmen (Mirzaei et al., 2016), en vitexine in Vitex negundo onderdrukte de groei van melanoomcellen door DNA-schade te induceren en ROS-niveaus te verhogen (Liu et al., 2018). Daarom hebben TCM kruidencomponenten een groot potentieel voor de behandeling van kankers, zoals melanoom.
Thee is een van de meest voorkomende dranken ter wereld. Het is niet alleen bekend om de eigenaardige smaak, maar ook om de voordelen voor de gezondheid. Door het verschil in proces kent thee drie hoofdtypes, waaronder ongefermenteerde groene thee, gedeeltelijk gefermenteerde oolong thee en volledig gefermenteerde zwarte thee of pu-erh thee (Kuo et al., 2005). Theebladeren zijn gekarakteriseerd als een TCM kruid met anti-flegma en anti-toxische eigenschappen, wat wijst op het anti-kanker potentieel. Moderne studies hebben gemeld dat theedrank effectief is bij het voorkomen en behandelen van kanker (Jin et al., 2018). Onlangs is gebleken dat theepolyfenolen antikankeractiviteit bezitten, die een superieur effect hebben op theedrank (Mao et al., 2019). Theaflavine (TF) is zo’n polyfenolcomponent die wordt geproduceerd door oxidatie van catechinen van theebladeren tijdens fermentatie, en fungeert als een hoofdpigment voor de kleur, smaak en bioactiviteit van thee (Roberts et al., 1957). Het is in staat apoptose te induceren in een verscheidenheid van kanker cellijnen, zoals menselijke borstcarcinoom cellijnen (MCF-7, MDA-MB-231, T47D, en ZR-75-1), coloncarcinoom cellijnen (HCT-15 en HT-29), en levercarcinoom cellijnen (HCCLM3 en Huh-7), wat wijst op anti-kanker potentieel (Adhikary et al., 2009; Lahiry et al., 2010; Li et al., 2012; Shao et al., 2016). Niettemin is er tot nu toe weinig aandacht besteed aan het effect ervan op melanoom.
In het licht van de gerapporteerde pro-apoptotische effecten van TF op veel kankercellijnen (Lahiry et al., 2008), hebben we een hypothese naar voren gebracht dat TF pro-apoptotische effecten uitoefent op melanoomcellen. Om dit te verifiëren, voerden we in vitro experimenten uit om het cytotoxische pro-apoptotische effect van TF op menselijke melanoomcellen te evalueren en voerden we in vivo experimenten uit met behulp van een xenograft model in larvale zebravissen om het tumorremmende effect te bepalen. Bovendien werd het mechanisme van TF ook onderzocht.
Materialen en methoden
Materialen en chemicaliën
Theaflavine (TF, >95% van zuiverheid) werd verstrekt door Theabio Co, Ltd (Hangzhou, China) (Batchnummer: 20181211061). Dulbecco′s gemodificeerd Eagle′s medium (DMEM) met hoge glucose (4,5 g/l) werd verkregen van HyClone Laboratories (UT, VS). Fetaal runderserum (FBS) werd verkregen van Cell Max (Beijing, China). Trypsine (0,25%) werd verkregen van Gibco (NY, VS). 3-(4,5-dimethylthiazol-2-yl)-2,5-difenyltetrazoliumbromide (MTT) en dimethylsulfoxide (DMSO) werden verkregen van Sigma (St. Louis, MO, USA). Annexine-V: FITC apoptosedetectiekit werd verkregen van BD Biosciences (CA, USA). 4′-6-diamidino-2-fenylindool (DAPI) kleuroplossing werd verkregen van Thermo Fisher Scientific (MA, VS). Primaire antilichamen werden verkregen van Cell Signaling Technology (MA, USA). Trizol reagens en real-time polymerase chain reaction (real-time PCR) kit werden verkregen van TaKaRa (Dalian, China).
Cellijn Voorbereiding
Menselijke HFF-1 huid fibroblast en A375 melanoom cellijn werden verkregen uit Shanghai Cell Bank van de Chinese Academy of Sciences (Shanghai, China), en menselijke A875 melanoom cellijn werd verkregen uit Kunming Cell Bank van de Chinese Academy of Sciences (Kunming, China). Deze cellijnen werden gekweekt in DMEM-medium met 10% FBS bij 37°C in een bevochtigde 5% CO2 incubator. Het medium werd dagelijks ververst, en de cellen werden behandeld met TF in hun logaritmische groeifase.
Zebravis Voorbereiding
Wild-type AB stam van zebravissen werd verkregen van het China Zebrafish Resource Center, Institute of Hydrobiology, China Academy of Science (Wuhan, China) en geaccrediteerd door de Association for Assessment and Accreditation of Laboratory Animal Care International (SYXK 2012-0171). Larvale zebravissen op 2 dpf (dagen na de bevruchting) werden geproduceerd door natuurlijke paring en gehuisvest in een licht-gecontroleerde aquacultuurfaciliteit met een standaard 14:10 uur dag/nacht fotoperiode en gevoed met levende pekelkreeftjes tweemaal per dag en fry vlokken eenmaal per dag.
Cell Viability Assay and Morphological Observation
MTT-assays werden uitgevoerd om de remmende effecten van TF op melanoomcellijnen te bepalen, zoals eerder beschreven (Zhou et al, 2017). Cellen werden gezaaid in 96-well platen op 6×103 cellen / putje in 200 ul medium voor 24 uur hechting, gevolgd door behandeling met TF bij concentraties van 0, 50, 100, 150, 200, 250, 300 en 400 μg / ml gedurende 24, 48 en 72 uur. Vervolgens werd 20 ul MTT-oplossing (5,0 mg / ml) toegevoegd aan elk putje en geïncubeerd bij 37 ° C gedurende 4 uur. In elk putje werd DMSO (150 μl) toegevoegd en de optische-dichtheidswaarde (OD-waarde) werd gemeten bij 490 nm met de Biorad microplate reader (CA, USA). Remmingspercentage (%) = × 100%. De 50% remmende concentraties (IC50) voor 24, 48 en 72 uur werden berekend door regressieanalyse. Dienovereenkomstig werden 120, 240 en 360 μg/ml (232,3, 464,7 en 697,0 μM) aangewezen als lage, middelste en hoge doses van TF. Vervolgens werden HFF-1, A375 en A875 cellijnen gezaaid in 96-wells platen zoals hierboven beschreven, en behandeld met de middelste dosis TF gedurende 24 uur. De celmorfologie van A375 cellen werd geobserveerd onder de Carl Zeiss fluorescentiemicroscoop (Göttingen, Duitsland).
Apoptose analyse door DAPI kleuring en flowcytometrie
Cel apoptose werd bepaald door DAPI kleuring en annexine-V/PI kleuring op basis van flowcytometrie. Voor de DAPI-kleuring werden A375-cellen uitgezaaid in 96-wells-platen en gedurende 24 uur behandeld met TF bij lage, gemiddelde en hoge concentraties, gevolgd door fixatie met 4% paraformaldehyde in PBS gedurende 30 min bij kamertemperatuur en kleuring met DAPI gedurende 10 min in het donker. Na driemaal wassen werden de cellen geobserveerd met vijf dekglaasjes onder de Carl Zeiss fluorescentiemicroscoop (Göttingen, Duitsland) en werden de apoptotische cellen geteld. Flowcytometrie werd uitgevoerd volgens de instructies van de fabrikant. Kort samengevat werden A375-cellen gedurende 24 uur uitgezaaid in 6-well-platen met 3×105 cellen per putje en behandeld met TF in lage, gemiddelde en hoge concentraties gedurende nog eens 48 uur. Daarna werden de cellen tweemaal gewassen en gelabeld met annexine V-fluoresceïne-isothiocyanaatoplossing en PI in bindingsbuffer. De intensiteit van de fluorescentie van de cellen werd gedetecteerd met BD C6 flowcytometrie (CA, USA). De analyse werd herhaald en de vroege apoptotische en late apoptotische cel percentages (%) werden berekend.
Xenograft Animal Assay
Voor het bepalen van het dosisbereik van TF, werden in totaal 300 larvale zebravissen op 3 dpf gebruikt en willekeurig gekweekt in 6-well platen met 30 vissen elk. TF werden opgelost in elk putje in een dosis van respectievelijk 0, 3,47, 10,4, 31,25, 62,5, 125, 250, 500, 1.000 en 2.000 μg/ml, gedurende 24 uur. Daarna werden de vissen in elke groep geobserveerd onder een stereoscopische microscoop om de sterfte en bijwerkingen te registreren. Zoals beschreven door onze vorige studie, werd geen waargenomen nadelig effectniveau (NOAEL) van TF geschat, en 1/9 NOAEL, 1/3 NOAEL en NOAEL werden toegepast als de lage, middelste en hoge doses voor het volgende experiment (Jin et al, 2018).
Om het xenograftmodel vast te stellen, werden A375-cellen gekleurd met CM-Dil (rode fluorescentie) in een verdunning van 1:1.000 en microgeïnjecteerd in de dooierzak van larvale zebrafishes (2 dpf) in een dosis van 200 cellen / vis. Na tumorgroei gedurende 24 uur, werden alle vissen geobserveerd onder een fluorescentiemicroscoop (AZ100, Nikon, Tokyo, Japan) voor modelverificatie. De A375-dragende vissen werden gegroepeerd in 5 groepen (30 vissen elk) en behandeld met respectievelijk 0 μg/ml, 1/9 NOAEL, 1/3 NOAEL, en NOAEL van TF, evenals 15 μg/ml (50 μM) cisplatine, gedurende 24 uur. De fluorescentie-intensiteit (FI) van A375-celmassa van zebravissen werd gedetecteerd en de remmende werking werd berekend als: remmende werking (%) = × 100%.
Real Time PCR (qPCR) Analysis
Om de moleculaire acties van TF op A375-cellen te onthullen, werd qPCR gebruikt op een ABI QuantStudio™ 7 Flex Real-Time PCR System (Applied Biosystems, CA, USA). Het totale RNA van A375-cellen werd geëxtraheerd met Trizol-reagens en via omgekeerde transcriptie gesynthetiseerd tot cDNA. De qPCR-reactiesysteem had een 20,0 pi volume: 10 pi SYBR ® Premix Ex Taq II (Tli RnaseH Plus), 0,8 pi PCR forward primer, 0,8 pi PCR reverse primer, 2,0 pi template cDNA, 0,4 pi ROX referentie kleurstof, en 6,0 pi ddH 2 O. De qPCR-reactieconditie werd ingesteld op 95°C voor 30 s initiële denaturatie, 40 cycli van 95°C voor 5 s denaturatie, 60°C voor 34 s annealing, en 72°C voor 40 s extensie. Aan het eind van elke reactie werd een smeltcurveanalyse uitgevoerd. β-ACTIN werd als referentiegen gebruikt en de 2-ΔΔCT-methode werd toegepast om de relatieve expressie van elk gen te analyseren (tabel 1).

Tabel 1 Voor qPCR-analyse gebruikte primersequenties.
Western Blot (WB) Analysis
De eiwitexpressie van A375-cellen met TF-behandeling bij 0 μg/ml en 120 μg/ml (232,3 μM) werd geanalyseerd door WB-analyse. De totale eiwitten werden geëxtraheerd met behulp van een lysisbuffer (50 mM Tris-HCl pH 7,4, 150 mM NaCl, 1 mM EDTA, 1% Triton, 0,1% SDS, 5 μg/ml leupeptine, en 1 mM PMSF) gedurende 30 min op ijs met herhaaldelijk bevriezen en ontdooien. Gerichte eiwitten werden gescheiden met behulp van denaturerende natriumdodecylsulfaat polyacrylamide gelelektroforese (SDS-PAGE) (8 ~ 12%) en vervolgens overgebracht op een polyvinylideenfluoride (PVDF) membraan (Millipore, MA, USA). Het membraan werd geblokkeerd met 5% vetvrije melk gedurende 2 uur, gevolgd door overnacht incubatie bij 4°C met de antilichamen tegen: ACTIN, ASK1, ATM, gefosforyleerd ATM (p-ATM), ATR, gefosforyleerd ATR (p-ATR), gekloofd caspase 3 (c-CASP3), gekloofd caspase 8 (c-CASP8), CHK1, CHK2, gefosforyleerd CHK1 en CHK2 (p-CHK1 en p-CHK2), JNK, gefosforyleerd JNK (p-JNK), C-JUN, gefosforyleerd C-JUN (p-C-JUN), gekloofd PARP (poly ADP-ribose polymerase), P53, en gefosforyleerd P53 (p-P53). Na incubatie met het secundaire antilichaam werden deze eiwitten gevisualiseerd met een versterkte chemiluminescentiekit (Amersham Pharmacia Biotech, Little Chalfort, UK) en gedetecteerd met een chemiluminescentie-analysator.
Statistische analyse
De gegevens werden uitgedrukt als gemiddelde waarden ± SD en onderworpen aan eenzijdige ANOVA, gevolgd door de vergelijking met Fisher’s minst significante verschil (LSD). Alle analyses werden uitgevoerd met behulp van een bijgewerkte versie van DPS software (Tang en Zhang, 2013).
Results
Anti-Proliferatieve Effect van TF
Zoals aangetoond in figuur 1A, TF bij 50 ug / ml (96.8 μM) remde de levensvatbaarheid van A375-cellen aanzienlijk, en de remmingssnelheden namen toe met toenemende TF-concentraties van 50 tot 400 μg/ml (96,8 tot 744,4 μM) (elk P < 0,01 vs. normaal niveau), wat wijst op een concentratie-afhankelijke manier. De remming nam ook toe met TF-behandeling van 24 tot 72 uur, met IC50 van 218,9 tot 84,9 μg/ml (423,8 tot 164,4 μM), respectievelijk. Vervolgens pasten we 120, 240 en 360 μg/ml (232,3, 464,7 en 697,0 pM) toe als de doses van TF-L, TF-M en TF-H, respectievelijk. Zoals aangetoond in Figuur 1B, remde TF-M duidelijk de levensvatbaarheid van A375- en A875-cellen, maar oefende weinig effect uit op HFF-1-cellen. Zoals blijkt uit figuur 1C, was de morfologie van A375-cellen duidelijk veranderd en nam het aantal levende cellen af met TF-behandeling bij toenemende concentraties.

Figuur 1 Levensvatbaarheid van A375-cellen met TF-behandeling bij 24, 48 en 72 uur (A), levensvatbaarheid van HFF-1-, A375- en A875-cellen met TF-behandeling bij 24 uur (B), en morfologie van A375-cellen met behandeling met theaflavin (TF) bij 24 uur (C). Gegevens waren gemiddelde ± SD (n = 5). Door middel van Fisher’s minst significante verschil (LSD) meervoudige vergelijkingen, gegevens (gemiddelde ± SD) met dezelfde kleine letter (b vs. bc; bc vs. cd; c vs. c; cd vs. d; d vs. d) geven geen significant verschil tussen elkaar, terwijl gegevens met verschillende letters (a vs. b vs. c vs. b vs. e vs. f vs. g) geven significant verschil met elkaar. Schaalbalk = 200 μm.
Pro-apoptotisch effect van TF
DAPI-kleuring en flowcytometrie werden uitgevoerd om het pro-apoptotisch effect van TF op A375-cellen te evalueren. Het resultaat van de DAPI-kleuring toonde apoptotische morfologie, met inbegrip van gekrompen vorm, karyopyknose, en nucleaire fragmentatie, in A375-cellen met TF-behandeling van 120 tot 360 ug/ml (232,3 tot 697,0 uM) (figuur 2A). De apoptotische cel aantallen werden significant verhoogd met TF behandeling bij 240 en 360 ug / ml (464,7 en 697,0 uM) (elk P < 0,01 vs NC) (figuur 2C). Het resultaat van flowcytometrie toonde TB-geïnduceerde vroege apoptose en late apoptose van A375 cellen (figuur 2B). De aantallen vroege en late apoptotische cellen werden verhoogd met TF behandeling van 120 tot 360 μg/ml (232,3 tot 697,0 uM) (figuur 2B), en hun verhoudingen waren significant hoger met TF behandeling bij 360 μg/ml (697,0 uM) (P < 0,01 en P < 0,05 vs. normaal niveau) (Figuren 2D, E). De resultaten gaven aan dat TF apoptose van A375-cellen induceerde op een concentratie-afhankelijke manier.
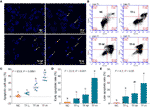
Figuur 2 DAPI-kleuring waarneming (A) en flowcytometrie analyse (B) op A375-cellen met theaflavin (TF) behandeling. Statistische analyse van apoptotische celsnelheid (C), statistische analyse van vroege apoptotische snelheid (D) en statistische analyse van late apoptotische snelheid (E). Door middel van Fisher’s minst significante verschil (LSD) meerdere vergelijkingen, gegevens (gemiddelde ± SD) met dezelfde kleine letter (a vs. ab; ab vs. b; b vs. b; c vs. c) geven geen significant verschil tussen elkaar, terwijl gegevens met verschillende letters (a vs. b vs. c) geven significant verschil met elkaar. Schaalbalk = 100 μm.
In Vivo Effect van TF op Xenograft Zebrafishes
De curven van sterfte en bijwerkingen van zebravissen met TF behandeling werden getoond in Fig. 3A. Vissterfte werd veroorzaakt door TF bij 31,25 μg/ml (60,5 μM), en geen vis overleefde met TF bij 125 μg/ml (242,0 μM), wat aangeeft dat de maximale niet-dodelijke dosis van TF lager is dan 31,25 μg/ml (60,5 μM). De ongewenste voorvallen, waaronder abnormaal omrollen van het lichaam en oedeem, werden waargenomen bij de behandeling met TF vanaf 3,47 μg/ml (6,7 μM) tot de hogere doses, wat duidt op een NOAEL van TF van minder dan 3,47 μg/ml (6,7 μM). Na herhaalde tests werd het NOAEL uiteindelijk geschat op 2,0 μg/ml (3,9 μM). Daarbij werden 0,22, 0,67 en 2,0 μg/ml (0,4, 1,3 en 3,9 μM) gebruikt als de lage, middelste en hoge doses van TF voor het daaropvolgende experiment.
Zoals getoond in figuur 3B, werd een xenograft model van A375 cellen opgezet in larvale zebravissen en de fluorescentie intensiteiten van de celmassa in de vissen werden getest. Na 24 uur behandeling, remde TF van 0,22 tot 2,0 ug / ml (0,4, 1,3, en 3,9 uM) duidelijk de A375 tumorgroei, met remmende percentages van 1,0 tot 46,4%. De remmende effecten van TF bij 0,67 en 2,0 μg/ml (1,3 en 3,9 μM) waren significant, indien vergeleken met de modelgroep (P < 0,01), en het effect van TF bij 2,0 μg/ml (3,9 μM) was zelfs hoger dan dat van cisplatine bij zijn NOAEL (50 μM).
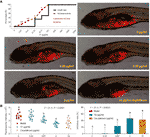
Figuur 3 Sterfte en bijwerkingen van larvale zebravissen veroorzaakt door theaflavine (TF) en observatie van larvale zebravissen xenotransplanteerd met A375-cellen met behandeling van TF of cisplatine (A), alsmede de fluorescentie-intensiteit en de remmingssnelheden van TF (B). Fluorescerend gebied in rood vertegenwoordigt de A375 celmassa. Door middel van LSD meervoudige vergelijkingen, geven gegevens (gemiddelde ± SD) met dezelfde kleine letter (a vs. a; c vs. c) geen significant verschil aan tussen elkaar, terwijl gegevens met verschillende letters (a vs. b vs. c) significant verschil met elkaar aangeven.
Moleculaire werking van TF op mRNA Expressies in A375 Cellen
De relatieve mRNA expressies van TF-getargete genen werden getest door qPCR assay. Zoals aangetoond in Fig. 4, werden de expressies van BAX, BIM, C-MYC, P21, P53, en PUMA aanzienlijk verhoogd door TF (elk P < 0,01 vs. NC-niveau), behalve die van BAX met TF-behandeling bij de lage concentratie. Hoewel de expressie van BCL-2 door TF werd opgehoogd, waren de verhoudingen BAX/BCL-2 significant hoger bij TF-behandeling bij de middelste tot hoge concentraties dan die van NC-niveau (P < 0,01), wat wijst op de belangrijke rol van BAX in de werking van TF.
Moleculaire werking van TB op Eiwit Expressies in A375 Cellen
WB werd toegepast om de expressie en fosforylering te bepalen van eiwitten die het doelwit waren van TF. Zoals blijkt uit figuur 5, werden de expressies van ATM, p-ATM, CHK1, p-CHK1, p-CHK2, p-P53, c-PARP, ASK1, JNK, p-JNK, C-JUN (48 kd), p-C-JUN (Ser 63), c-CASP8, en c-CASP3 aanzienlijk verhoogd door TF bij 120 μg/ml (232,3 μM) (elk P < 0,01 vs. NC-niveau). Bovendien waren de acties van TF op ATR, p-ATR, CHK2, P53, C-JUN (43 kd), en p-C-JUN (Ser 73) niet significant (elk P > 0,05 vs NC-niveau).
Discussie
Hoewel de antikankeractiviteiten van TF goed zijn gedocumenteerd (Sur en Panda, 2017; Takemoto en Takemoto, 2018; Sajadimajd et al, 2020), is de kennis over de effectiviteit ervan op melanoom nog steeds weinig. Om deze leemte te vullen, voerde de huidige studie in vitro en in vivo experimenten uit om de effecten en het mechanisme van TF tegen melanoomcellen te bestuderen. Voor de eerste keer toonden we de cytotoxische pro-apoptotische en tumorremmende effecten van TF op melanoom A375 cellen aan. Er werd gesuggereerd dat het mechanisme geassocieerd is met P53 en JNK pathways. De innovatie van deze studie is de ontdekking van TF′s anti-melanoom werkzaamheid, terwijl eerdere rapporten zich alleen richtten op TF′s effecten op andere tumoren (Lin, 2002; Sur en Panda, 2017). Bovendien is dit ook het eerste rapport over de moleculaire werking van TF op JNK pathway, terwijl het P53 pathway-geassocieerde mechanisme van TF′s pro-apoptotische effect op carcinoma cellen eerder is gerapporteerd (Lahiry et al., 2008).
Recentelijk hebben xenograft tumormodellen met behulp van larvale zebravissen steeds meer aandacht getrokken voor anti-kanker studies, vanwege de voordelen van larvale zebravissen in vergelijking met andere diermodellen: (1) het ontbreken van immuunafstoting tegen menselijke cellen zorgt voor een hoger succespercentage voor xenotransplantatie; (2) lichaamstransparantie zorgt voor in vivo zichtbare observatie van tumorgroei en toxiciteit van geneesmiddelen; en (3) grootschalige generatie en snelle organogenese zorgt voor kortere experimentele periodes (Langheinrich, 2003; Pardo-Martin et al., 2010; Konantz et al., 2012). In deze studie oefende TF een dosisafhankelijk remmend effect uit op de A375 tumormassa in larvale zebravissen (Figuur 3B), met een remmingspercentage van 46,4% bij zijn NOAEL (3,9 μM). De remmingsgraad was hoger dan die van cisplatine, wat aangeeft dat TF effectiever was dan cisplatine binnen hun respectieve veilige dosisbereik. Bovendien was de remmingssnelheid hoger dan die van een ander theepigment (theabrownin) (Jin et al., 2018), wat suggereert dat TF het meest effectieve bestanddeel van thee is. Het effectieve in vivo dosisbereik (1,3 tot 3,9 μM) van TF is echter veel lager dan het effectieve in vitro dosisbereik (96,8 tot 774,4 μM). De reden voor dit verschil kan zijn dat, na orale toediening, de gemetaboliseerde TF-derivaten een hoger effect hebben dan TF. Dit wijst erop dat orale toediening efficiënter kan zijn dan andere routes voor TF.
Volgens de dosisconversieregel kunnen de effectieve doses (1,3 en 3,9 μM) van TF bij larvale zebravissen worden geschat op 0,03 tot 0,09 mg/kg bij de mens (Zhang et al., 2003). Dit suggereert dat orale toediening van TF in zo’n laag dosisbereik effectief kan zijn bij de behandeling van patiënten met melanoom, wat wijst op een goede kosteneffectiviteit van deze verbinding. Voor zover wij weten, zijn er slechts enkele rapporten over de klinische toepassing van TF. In een dubbelblind, gerandomiseerd, placebogecontroleerd onderzoek met parallelle groepen werd een met TF verrijkt extract van groene thee toegepast om patiënten met milde tot matige hypercholesterolemie gedurende 12 weken te behandelen (Maron et al., 2003). In die studie bedroeg de dagelijkse inname van TF 75 mg in groene thee-extract, waardoor het totale cholesterol, LDL-C en triglyceride significant daalde bij volwassenen met hypercholesterolemie zonder dat er significante bijwerkingen werden waargenomen (Maron et al., 2003). In deze studie was het effectieve dosisbereik van TF veel lager dan de gerapporteerde dosis, wat wijst op een groter potentieel van TF voor de behandeling van melanoom in de kliniek. Hoewel het effectieve dosisbereik van TF klein was, was zijn dodelijke dosisdrempel voor zebravislarven echter ook laag (<60,5 μM) en was lager dan andere theepigmenten (figuur 3A) (Jin et al., 2018), waardoor er een zorg blijft bestaan over de potentiële toxiciteit van TF voor de mens. Interessant genoeg vonden we dat TF weinig effect uitoefende op de normale cellijn (HFF-1 huidfibroblast) (figuur 1B), wat een klinische haalbaarheid suggereert voor zijn externe gebruik dat de potentiële toxiciteit van zijn interne gebruik kan vermijden.
Onze mechanistische experiment toonde aan dat TF ATM, CHK1/2, P53, CASP8/3 in P53 pathway activeerde en ook ASK1, JNK, en C-JUN in JNK pathway activeerde, associërend met A375-celapoptose. De apoptose werd bepaald door DAPI kleuring en flowcytometrische analyse op cellulair niveau (Figuur 2) en gemedieerd door de overexpressie van pro-apoptotische genen (P53, BAX, BIM, en PUMA) en de activering van apoptose-gerelateerde eiwitten (caspases en PARP) op moleculair niveau (Figuren 4 en 5). P53 (TP53) codeert voor een DNA-bindend kernfosfoproteïne met tumorsuppressoractiviteit, dat als transcriptiefactor fungeert in het centrum van een netwerk voor de controle van apoptose als reactie op cellulaire stress (Martin et al., 2002). Het activeert apoptose door de transcriptie te stimuleren van genen uit de Bcl-2 familie, zoals BAX, BIM en PUMA (Levine en Oren, 2009). BAX en BIM coderen voor pro-apoptotische leden die apoptose en celdood uitlokken door de caspase cascade te activeren als reactie op apoptotische stimuli (Rossé et al., 1998; Youle en Strasser, 2008). PUMA, als een P53 up-regulated modulator van apoptose, codeert een BH3-domein-bevattend eiwit dat lokaliseert naar de mitochondria, interageert met Bax en Bak, en de caspase cascade activeert door klieving van CASP3 (Nakano en Vousden, 2001; Letai, 2009). In deze studie werden CASP8 en CASP3 gekliefd in reactie op P53 activering. CASP8 is een initiërende caspase in de apoptotische cascade, die CASP3 activeert voor apoptotische DNA-fragmentatie, wat resulteert in de daaropvolgende splitsing van PARP (c-PARP) om het apoptotische proces uit te voeren (Jänicke et al., 1998; Stennicke et al., 1998; Boulares et al., 1999). PARP is verantwoordelijk voor DNA-reparatie en levensvatbaarheid van de cellen in reactie op exogene stress (Satoh en Lindahl, 1992). Het kan worden gekliefd door CASP3 en vergemakkelijkt daardoor de cellulaire ontmanteling in apoptose (Oliver et al., 1998). De hoeveelheid gekliefd PARP (c-PARP) kan dus worden gebruikt als marker van celapoptose.
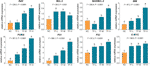
Figuur 4 Relatieve mRNA-expressie van deaflavin (TF)-gemerkte genen in A375-cellen na 24 uur behandeling. Door middel van Fisher’s kleinste significante verschil (LSD) meervoudige vergelijkingen, gegevens (gemiddelde ± SD) met dezelfde kleine letter (a vs. a; b vs. b; c vs. c) geven geen significant verschil tussen elkaar, terwijl gegevens met verschillende letters (a vs. b vs. c vs. d) wijzen op een significant verschil met elkaar.
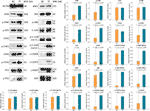
Figuur 5 Expressie en fosforylering van theaflavine (TF)-getargete proteïnen in A375-cellen na 24 u behandeling. Gegevens (gemiddelde ± SD) met verschillende kleine letters zijn significant verschillend met elkaar bij Fisher’s minst significante verschil (LSD) meervoudige vergelijkingen.
In onze eerdere studies hebben we gemeld dat DNA-schade-inductie geassocieerd was met P53 pathway-gemedieerde pro-apoptotische mechanisme van theabrownine (Wu et al., 2016; Jin et al., 2018). Echter, hoewel zowel TF als theabrownin de P53-route activeerden en tumorcelapoptose induceerden, vonden we in deze studie geen DNA-schade-inductie met TF-behandeling. Als alternatief vonden we de activering van ASK1-JNK-C-JUN cascade, die ook functioneert als apoptotische route. In deze signaalmodule is ASK1 (apoptosis signal-regulating kinase 1) een mitogeen-geactiveerd proteïne kinase dat een sleutelrol speelt in cytokine- en stress-geïnduceerde apoptose door het in gang zetten van een mitochondria-afhankelijke pathway (Matsuzawa en Ichijo, 2001; Zhang et al., 2003). Het activeert stroomafwaarts JNK-signalering in reactie op verschillende soorten stress, wat leidt tot celapoptose door C-JUN-activering en daaropvolgende overexpressie van pro-apoptotische genen (Tobiume et al., 2001). Van chemotherapeutica, zoals cisplatine, docetaxel en paclitaxel, is bekend dat zij apoptose van melanoomcellen induceren via de JNK-route, onafhankelijk van de P53-route (Mandic et al., 2001; Mhaidat et al., 2008; Selimovic et al., 2008). Dit wijst erop dat TF een voordeel zou kunnen hebben ten opzichte van deze geneesmiddelen door zijn dubbel-pathway-gemedieerde werkingsmechanisme, wat voorlopig werd aangetoond door de hogere tumorremmende effecten van TF dan die van cisplatine in deze studie. Er zijn echter enkele beperkingen aan deze studie (1) de acties van P53 en JNK pathways in het voorgestelde dual-pathway-gemedieerde mechanisme van TF zijn niet geverifieerd; (2) de interactie tussen P53 en JNK pathways is niet onderzocht, en welke pathway de belangrijkste rol speelt is onbekend; en (3) het in vitro dosisbereik en het in vivo dosisbereik zijn nogal verschillend, waarvan de reden is verklaard maar experimenteel bewijs behoeft. Om deze problemen aan te pakken zijn in de toekomst verdere studies nodig. Zo moeten bijvoorbeeld siRNA’s of remmers van P53 en JNK worden gebruikt om de werking van deze routes te verifiëren en de onderlinge interactie te onderzoeken, en de serummetabolieten van TF moeten chemisch worden geanalyseerd en farmacologisch bestudeerd om onze hypothese te testen dat de gemetaboliseerde TF-derivaten een groter effect hebben dan TF. Bovendien, aangezien er geen klinische rapporten zijn van TF voor de behandeling van kanker, moeten de therapeutische werkzaamheid en voordelen van TF voor kankerpatiënten verder worden bestudeerd.
Conclusie
Omdat het anti-kanker potentieel van TF goed is gedocumenteerd, blijft het onzeker of TF effectief is bij de behandeling van melanoom. In deze studie, met behulp van melanoom cellijn en xenograft zebravis model, vonden we cytotoxische pro-apoptotische en tumorremmende effecten van TF op melanoom cellen en onthulden het mechanisme in associatie met de activeringen van P53 en JNK pathways. Dit is de eerste studie die de effecten en het mechanisme van TF tegen melanoomcellen beschrijft. Aangezien het mechanisme van TF niet alleen afhankelijk was van de P53-route, kan verwacht worden dat TF effectief kan zijn bij de behandeling van P53-gemuteerde cellijnen. Verdere studies zijn nodig om deze conclusie te verifiëren. Al met al levert deze studie bewijs voor de werkzaamheid van TF tegen melanoom, wat bijdraagt aan de ontwikkeling van TF-afgeleide middelen voor melanoomtherapie.
Data Availability Statement
De ruwe gegevens die de conclusies van dit artikel ondersteunen, zijn op redelijk verzoek beschikbaar bij de corresponderende auteur.
Ethics Statement
De dierlijke studie werd beoordeeld en goedgekeurd door de Ethische Commissie van Zhejiang Chinese Medical University.
Author Contributions
LeZ voerde het belangrijkste werk van dit artikel uit. BY voerde de cellulaire en moleculaire experimenten uit. LiZ en SM hebben bijgedragen aan het schrijven van dit manuscript. WD leverde ideeën en financiële steun voor dit werk. YX voerde het zebravis experiment uit. LS ontwierp dit werk en stelde het manuscript op. TE verbeterde het ontwerp en de opzet van dit manuscript. Alle auteurs hebben bijgedragen aan het artikel en hebben de ingediende versie goedgekeurd.
Funding
Dit werk werd ondersteund door de National Natural Science Foundation of China (Grant No. 81774331, 81873049, en 81973873), de Zhejiang Provincial Natural Science Foundation of China (Grant No. LY18H270004), de Zhejiang Provincial Science and Technology Project of Traditional Chinese Medicine of China (Grant No. 2016ZZ011), de Zhejiang Provincial Key Construction University Superiority Characteristic Discipline (Traditionele Chinese Farmacologie), en de Opening Foundation of China (Grant No. ZYX2018006).
Conflict of Interest
YX was in dienst van het bedrijf Hunter Biotechnology, Inc.
De overige auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Afkortingen
DAPI, 4′-6-diamidino-2-fenylindool; DMEM, Dulbecco′s gemodificeerd Eagle′s medium; DMSO, dimethylsulfoxide; dpf, dagen na de bevruchting; FBS, foetaal runderserum; FI, fluorescentie-intensiteit; LSD, Fisher’s minst significante verschil; NOAEL, geen waargenomen nadelig effectniveau; MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5-difenyltetrazoliumbromide; PARP, poly ADP-ribose polymerase; SDS-PAGE, denaturerende natriumdodecylsulfaatpolyacrylamidegelelektroforese; TCM, theaflavine; TF, traditionele Chinese geneeskunde.
Adhikary, A., Mohanty, S., Lahiry, L., Hossain, D. M., Chakraborty, S., Das, T. (2009). Theaflavines vertragen de migratie van borstkankercellen door remming van NF-kappaB via p53-ROS cross-talk. FEBS Lett. 584 (1), 7-14. doi: 10.1016/j.febslet.2009.10.081
CrossRef Full Text | Google Scholar
Boulares, A.H., Yakovlev, A.G., Ivanova, V., Stoica, B.A., Wang, G., Iyer, S., et al. (1999). Rol van poly(ADP-ribose) polymerase (PARP) splitsing in apoptose. Caspase 3-resistente PARP-mutant verhoogt de snelheid van apoptose in getransfecteerde cellen. J. Biol. Chem. 274 (33), 22932-22940. doi: 10.1074/jbc.274.33.22932
PubMed Abstract | CrossRef Full Text | Google Scholar
Jänicke, R. U., Sprengart, M. L., Wati, M. R., Porter, A. G. (1998). Caspase-3 is nodig voor DNA fragmentatie en morfologische veranderingen geassocieerd met apoptose. J. Biol. Chem. 273 (16), 9357-9360. doi: 10.1074/jbc.273.16.9357
PubMed Abstract | CrossRef Full Text | Google Scholar
Jin, W., Zhou, L., Yan, B., Yan, L., Liu, F., Tong, P., et al. (2018). Theabrownine triggert DNA-schade om humaan osteosarcoom U2OS-cellen te onderdrukken door de p53-signaleringsroute te activeren. J. Cell. Mol. Med. 22 (9), 4423-4436. doi: 10.1111/jcmm.13742
PubMed Abstract | CrossRef Full Text | Google Scholar
Konantz, M., Balci, T. B., Hartwig, U. F., Dellaire, G., André, M. C., Berman, J. N., et al. (2012). Zebravis xenograften als een instrument voor in vivo studies naar humane kanker. Ann. New Y. Acad. Sci. 1266, 124-137. doi: 10.1111/j.1749-6632.2012.06575.x
CrossRef Full Text | Google Scholar
Kuo, K. L., Weng, M. S., Chiang, C. T., Tsai, Y. J., Lin-Shiau, S. Y., Lin, J. K. (2005). Comparative studies on the hypolipidemic and growth suppressive effects of oolong, black, pu-erh, and green tea leaves in rats. J. Agric. Food Chem. 53 (2), 480-489. doi: 10.1021/jf049375k
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Bhattacharyya, S., Chattopadhyay, S., Banerjee, S., et al. (2008). Contribution of p53-mediated Bax transactivation in theaflavin-induced mammary epithelial carcinoma cell apoptosis. Apoptosis 13 (6), 771-781. doi: 10.1007/s10495-008-0213-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lahiry, L., Saha, B., Chakraborty, J., Adhikary, A., Mohanty, S., Hossain, D. M. S., et al. (2010). Theaflavines richten zich tegen Fas/caspase-8 en Akt/pBad pathways om apoptose te induceren in p53-gemuteerde humane borstkankercellen. Carcinogenesis 31 (2), 259-268. doi: 10.1093/carcin/bgp240
PubMed Abstract | CrossRef Full Text | Google Scholar
Langheinrich, U. (2003). Zebravis: een nieuw model op de farmaceutische catwalk. BioEssays Nieuws Rev. Mol. Cell. Dev. Biol. 25 (9), 904-912. doi: 10.1002/bies.10326
CrossRef Full Text | Google Scholar
Leonardi, G. C., Falzone, L., Salemi, R., Zanghi, A., Spandidos, D. A., McCubrey, J. A., et al. (2018). Cutaan melanoom: From pathogenesis to therapy (Review). Int. J. Oncol. 52 (4), 1071-1080. doi: 10.3892/ijo.2018.4287
PubMed Abstract | CrossRef Full Text | Google Scholar
Letai, A. (2009). Puma slaat Bax. J. Cell Biol. 185 (2), 189-191. doi: 10.1083/jcb.200903134
PubMed Abstract | CrossRef Full Text | Google Scholar
Levine, A. J., Oren, M. (2009). The first 30 years of p53: growing ever more complex. Nat. Rev. Cancer 9 (10), 749-758. doi: 10.1038/nrc2723
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, B., Vik, S. B., Tu, Y. (2012). Theaflavines remmen de ATP synthase en de ademhalingsketen zonder de superoxide productie te verhogen. J. Nutr. Biochem. 23 (8), 953-960. doi: 10.1016/j.jnutbio.2011.05.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, J.-K. (2002). Cancer chemoprevention by tea polyphenols through modulating signal transduction pathways. Arch. Pharmacal. Res. 25 (5), 561-571. doi: 10.1007/BF02976924
CrossRef Full Text | Google Scholar
Liu, N., Wang, K. S., Qi, M., Zhou, Y. J., Zeng, G. Y., Tao, J., et al. (2018). Vitexin compound 1, een nieuw extract uit een Chinees kruid, onderdrukt de groei van melanoomcellen via DNA-schade door verhoging van ROS-niveaus. J. Exp. Clin. Cancer Res. CR 37 (1), 269. doi: 10.1186/s13046-018-0897-x
CrossRef Full Text | Google Scholar
Mandic, A., Viktorsson, K., Molin, M., Akusjärvi, G., Eguchi, H., Hayashi, S. I., et al. (2001). Cisplatine induceert de proapoptotische conformatie van Bak op een deltaMEKK1-afhankelijke manier. Mol. Cell. Biol. 21 (11), 3684-3691. doi: 10.1128/MCB.21.11.3684-3691.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mao, X., Xiao, X., Chen, D., Yu, B., He, J. (2019). Thee en zijn componenten voorkomen kanker: Een overzicht van het redox-gerelateerde mechanisme. Int. J. Mol. Sci. 20 (21), 5249. doi: 10.3390/ijms20215249
CrossRef Full Text | Google Scholar
Maron, D. J., Lu, G. P., Cai, N. S., Wu, Z. G., Li, Y. H., Chen, H., et al. (2003). Cholesterolverlagend effect van een met theaflavine verrijkt extract van groene thee: een gerandomiseerd gecontroleerd onderzoek. Arch. Intern Med. 163 (12), 1448-1453. doi: 10.1001/archinte.163.12.1448
PubMed Abstract | CrossRef Full Text | Google Scholar
Martin, A. C., Facchiano, A. M., Cuff, A. L., Hernandez-Boussard, T., Olivier, M., Hainaut, P., et al. (2002). Integratie van mutatiegegevens en structurele analyse van het TP53 tumor-onderdrukker eiwit. Hum. Mutat. 19 (2), 149-164. doi: 10.1002/humu.10032
PubMed Abstract | CrossRef Full Text | Google Scholar
Matsuzawa, A., Ichijo, H. (2001). Moleculaire mechanismen van de beslissing tussen leven en dood: regulering van apoptose door apoptose-signaalregulerend kinase 1. J. Biochem. 130 (1), 1-8. doi: 10.1093/oxfordjournals.jbchem.a002947
PubMed Abstract | CrossRef Full Text | Google Scholar
Mhaidat, N. M., Thorne, R., Zhang, X. D., Hersey, P. (2008). Involvement of endoplasmic reticulum stress in Docetaxel-induced JNK-dependent apoptosis of human melanoma. Apoptosis Int. J. Program. Cell Death 13 (12), 1505-1512. doi: 10.1007/s10495-008-0276-8
CrossRef Full Text | Google Scholar
Mirzaei, H., Naseri, G., Rezaee, R., Mohammadi, M., Banikazemi, Z., Mirzaei, H. R., et al. (2016). Curcumine: Een nieuwe kandidaat voor melanoom therapie? Int. J. Cancer 139 (8), 1683-1695. doi: 10.1002/ijc.30224
PubMed Abstract | CrossRef Full Text | Google Scholar
Nakano, K., Vousden, K. H. (2001). PUMA, a novel proapoptotic gene, is induced by p53. Mol. Cell 7 (3), 683-694. doi: 10.1016/S1097-2765(01)00214-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira Pinho, J., Matias, M., Gaspar, M. M. (2019). Opkomende nanotechnologische strategieën voor systemische chemotherapie tegen melanoom. Nanomater. (Basel) 9 (10), 1455. doi: 10.3390/nano9101455
CrossRef Full Text | Google Scholar
Oliver, F. J., de la Rubia, G., Rolli, V., Ruiz-Ruiz, M. C., de Murcia, G., Murcia, J. M. (1998). Het belang van poly(ADP-ribose) polymerase en zijn splitsing in apoptose. Lering uit een onkraakbare mutant. J. Biol. Chem. 273 (50), 33533-33539. doi: 10.1074/jbc.273.50.33533
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardo-Martin, C., Chang, T.-Y., Koo, B. K., Gilleland, C. L., Wasserman, S. C., Yanik, M. F. (2010). High-throughput in vivo vertebrate screening. Nat. Methods 7 (8), 634-636. doi: 10.1038/nmeth.1481
PubMed Abstract | CrossRef Full Text | Google Scholar
Roberts, E. A. H., Cartwright, R. A., Oldschool, M. (1957). De fenolische stoffen van gefabriceerde thee. I. Fractionation and paper chromatography of water-soluble substances. J. Sci. Food Agric. 8, 72-80. doi: 10.1002/jsfa.2740080203
CrossRef Full Text | Google Scholar
Rodríguez-Cerdeira, C., Carnero Gregorio, M., López-Barcenas, A., Sánchez-Blanco, E., Sánchez-Blanco, B., Fabbrocini, G., et al. (2017). Vooruitgang in immunotherapie voor melanoom: Een uitgebreide review. Mediators Inflammation 2017, 3264217. doi: 10.1155/2017/3264217
CrossRef Full Text | Google Scholar
Rossé, T., Olivier, R., Monney, L., Rager, M., Conus, S., Fellay, I., et al. (1998). Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature 391 (6666), 496-499. doi: 10.1038/35160
PubMed Abstract | CrossRef Full Text | Google Scholar
Sajadimajd, S., Bahramsoltani, R., Iranpanah, A., Kumar Patra, J., Das, G., Gouda, S., et al. (2020). Vooruitgang op natuurlijke polyfenolen als antikankermiddelen voor huidkanker. Pharmacol. Res. 151, 104584. doi: 10.1016/j.phrs.2019.104584
PubMed Abstract | CrossRef Full Text | Google Scholar
Satoh, M. S., Lindahl, T. (1992). Rol van poly(ADP-ribose) vorming in DNA reparatie. Nature 356 (6367), 356-358. doi: 10.1038/356356a0
PubMed Abstract | CrossRef Full Text | Google Scholar
Selimovic, D., Hassan, M., Haikel, Y., Hengge, U. R. (2008). Taxol-geïnduceerde mitochondriale stress in melanoomcellen wordt gemedieerd door activering van c-Jun N-terminal kinase (JNK) en p38 pathways via uncoupling protein 2. Cell. Signal. 20 (2), 311-322. doi: 10.1016/j.cellsig.2007.10.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Shao, J., Meng, Q., Li, Y. (2016). Theaflavines onderdrukken tumorgroei en metastasering via blokkade van de STAT3 pathway in hepatocellulair carcinoom. Oncotarg. Ther. 9, 4265-4275. doi: 10.2147/OTT.S102858
CrossRef Full Text | Google Scholar
Stennicke, H. R., Jürgensmeier, J. M., Shin, H., Deveraux, Q., Wolf, B. B., Yang, X., et al. (1998). Pro-caspase-3 is een belangrijk fysiologisch doelwit van caspase-8. J. Biol. Chem. 273 (42), 27084-27090. doi: 10.1074/jbc.273.42.27084
PubMed Abstract | CrossRef Full Text | Google Scholar
Sur, S., Panda, C. K. (2017). Moleculaire aspecten van kanker chemopreventieve en therapeutische werkzaamheid van thee en thee polyfenolen. Nutrition 43-44, 8-15. doi: 10.1016/j.nut.2017.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Takemoto, M., Takemoto, H. (2018). Synthese van theaflavines en hun functies. Mol. (Basel Zwitserland) 23 (4), 918. doi: 10.3390/molecules23040918
CrossRef Full Text | Google Scholar
Tang, Q.-Y., Zhang, C.-X. (2013). Data Processing System (DPS) software met experimenteel ontwerp, statistische analyse en data mining ontwikkeld voor gebruik in entomologisch onderzoek. Insect Sci. 20 (2), 254-260. doi: 10.1111/j.1744-7917.2012.01519.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tobiume, K., Matsuzawa, A., Takahashi, T., Nishitoh, H., Morita, K., Takeda, K., et al. (2001). ASK1 is nodig voor langdurige activatie van JNK/p38 MAP kinases en apoptose. EMBO Rep. 2 (3), 222-228. doi: 10.1093/embo-reports/kve046
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J. Y., Cheng, H. B. (2019). Analyses van de pathogenese theorie van kankertoxine en de ‘consoliderende lichaamsweerstand en het opruimen van de bron’ theorie. China J. Trad. Chin. Med. Pharm. 34 (10), 4687-4690.
Google Scholar
Wu, F., Zhou, L., Jin, W., Yang, W., Wang, Y., Yan, B., et al. (2016). Anti-proliferatief en apoptose-inducerend effect van theabrownin tegen niet-kleincellig longadenocarcinoom A549 cellen. Front. Pharmacol. 7, 465. doi: 10.3389/fphar.2016.00465
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, K., Fung, T. T., Nan, H. (2018). Een epidemiologische review van voeding en cutaan maligne melanoom. Cancer Epidemiol. Biomarkers Prev. 27 (10), 1115-1122. doi: 10.1158/1055-9965.EPI-18-0243
PubMed Abstract | CrossRef Full Text | Google Scholar
Youle, R. J., Strasser, A. (2008). De BCL-2 eiwitfamilie: tegengestelde activiteiten die celdood mediëren. Nat. Rev. Mol. Cell Biol. 9 (1), 47-59. doi: 10.1038/nrm2308
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, C., Willett, C., Fremgen, T. (2003). Zebravis: een diermodel voor toxicologische studies. Curr. Protoc. Toxicol. Chapter 1:Unit1.7. doi: 10.1002/0471140856.tx0107s17
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, L., Wu, F., Jin, W., Yan, B., Chen, X., He, Y., et al. (2017). Theabrownin remt celcyclusprogressie en tumorgroei van longcarcinoom via c-myc-gerelateerd mechanisme. Front. Pharmacol. 8, 75. doi: 10.3389/fphar.2017.00075
PubMed Abstract | CrossRef Full Text | Google Scholar