- Introduction
- Materialen en Methoden
- Studypopulatie
- Studievariabelen
- Resultaten
- Distributie van AB0/Rh-bloedgroep bij patiënten met PCa
- Geen significante verschillen in klinisch-pathologische kenmerken onder PCa-patiënten volgens AB0/Rh bloedgroepen
- Geen Significante Prognostische Waarde van Bloedgroep voor BCR-Vrije Overleving na RP
- Discussie
- Informed Consent
- Ethics Statement
- Author Contributions
- Conflict of Interest Statement
Introduction
Prostate cancer (PCa) is the most common malignancy in Western countries and the second leading cause of cancer-related deaths in males (1). De meest bekende risicofactoren voor het ontwikkelen van PCa zijn toenemende leeftijd, etnische afkomst, en familiegeschiedenis (2). De familiale predispositie suggereert een erfelijke genetische component van de ziekte (3), maar vertegenwoordigt slechts een minderheid (5-10%) van de PCa-gevallen. Bijgevolg zijn de predisponerende omgevings- en genetische factoren voor de meeste patiënten nog onbekend (4, 5). Bloedgroep AB0 is een erfelijke eigenschap die in verband is gebracht met de incidentie en de prognose van verschillende maligniteiten (6-8). Verschillende plausibele mechanismen, waaronder ontsteking, immuunbewaking voor kwaadaardige cellen, intercellulaire adhesie en membraansignalering zijn voorgesteld om de waargenomen associatie tussen AB0 bloedgroepen en kankerrisico te verklaren.
AB0 bloedgroepantigenen (ABH) zijn glycoproteïnen die tot expressie komen op het oppervlak van rode bloedcellen. De fenotypische A en B antigenen zijn terminale koolhydraten gesynthetiseerd door de toevoeging van enkelvoudige suikers gekatalyseerd door een reeks specifieke glycosyltransferasen. Fenotype 0 wordt gekenmerkt door de afwezigheid van A- en B-glycosyltransferasen, zodat alleen een eiwitruggengraat, het H-antigeen, aanwezig is. Rode bloedcelantigenen hebben verschillende functies, waaronder integriteit van de membraanstructuur, transport van moleculen door membranen, en adhesie (9). Naast hun expressie op rode bloedcellen komen ABH-antigenen ook tot expressie in een verscheidenheid van epitheelcellen, waaronder urotheel, gastro-intestinale mucosa, en longen. Verschillende studies toonden veranderingen aan van het ABH expressiepatroon in de kankercellen naargelang de graad van de tumor en de ziekteprogressie, wat wijst op een mogelijk verband tussen AB0 bloedgroep en het risico van sommige epitheliale maligniteiten (8, 10). Recente studies toonden aan dat personen met bloedgroep A, AB, of B een verhoogde incidentie van pancreaskanker hadden in vergelijking met die met bloedgroep 0, terwijl het hoogste risico bij bloedgroep B werd gevonden (8). Evenzo werd bloedgroep A in verband gebracht met een hoger risico op maag-, borst- en eierstokkanker (11). Anderzijds werd bloedgroep 0 gecorreleerd met de hoogste recidief- en progressiepercentages na transurethrale blaasresectie en dus geassocieerd met een slechtere prognose bij patiënten met niet-spierinvasief urotheliaal carcinoom van de blaas (6).
Gebaseerd op het huidige bewijs van de voorspellende rol van de bloedgroep bij verschillende maligniteiten, stelden wij de hypothese dat het type bloedgroep kan worden gebruikt als een aanvullende parameter, die de beoordeling van risico’s vergemakkelijkt en helpt bij het inschatten van de prognose na chirurgie bij patiënten met PCa. In de huidige literatuur is er slechts beperkte klinische evidentie beschikbaar met betrekking tot bloedgroep en PCa in het algemeen, hetgeen controversiële resultaten heeft aangetoond (12-14) Bovendien bestaat er momenteel slechts één studie met speciale aandacht voor de invloed van bloedgroepen op het resultaat bij patiënten na radicale prostatectomie (RP) (13). Bij 555 patiënten met PCa die een RP ondergingen, toonden de auteurs aan dat bloedgroep AB0 een onafhankelijke voorspeller is van biochemisch recidief (BCR) in de multivariabele analyse, maar niet in de univariabele analyse.
Daarom was het doel van de huidige studie om verdere informatie toe te voegen aan het lopende debat door de correlatie te analyseren van AB0/Rh bloedgroep en de verdeling ervan binnen patiënten met PCa, tumorpathologie, recidief en mortaliteit bij patiënten met gelokaliseerde PCa die RP ondergingen met behulp van een grote dataset van 3.574 patiënten uit één centrum.
Materialen en Methoden
Studypopulatie
De studie werd goedgekeurd door de institutionele beoordelingsraad. In totaal werden 3.582 patiënten met klinisch gelokaliseerd PCa, die tussen 2009 en 2010 een RP ondergingen in onze instelling, gescreend voor inclusie in de studie. Degenen met onvolledige datasets en ontbrekende follow-up werden uitgesloten (n = 8), waardoor 3.574 patiënten beschikbaar bleven voor analyse.
Radicale prostatectomie werd uitgevoerd met behulp van een open retropubische benadering (n = 3.220) of robotic-assisted laparoscopische benadering (n = 354), zoals eerder beschreven (15). Lymfeklierdissectie werd uitgevoerd bij D’Amico intermediair-risico en hoog-risico patiënten volgens de richtlijnen van de European Association of Urology (EAU) voor PCa (16). Chirurgische specimens werden verwerkt volgens standaard histopathologische procedures en geëvalueerd door ervaren uropathologen in een hoog-volume centrum (>2.000 prostatectomie specimens per jaar). Tumoren werden geënsceneerd volgens het TNM-stadiëringssysteem van het American Joint Committee on Cancer van 2007 en histopathologische classificatie werd toegewezen volgens het Gleason-systeem (17).
Alle deelnemers ondergingen voorafgaand aan RP serologische tests. Laboratoriumbevestiging van AB0 en Rh bloedgroep werden verkregen van de afdeling Transfusiegeneeskunde, Universitair Ziekenhuis Hamburg-Eppendorf. De AB0-referentieverdeling van de Duitse bevolking werd als controle gebruikt (18).
Studievariabelen
Studievariabelen waren AB0/Rh-bloedgroep, leeftijd, preoperatief prostaat-specifiek antigeen (PSA), prostaatvolume (transrectale echografie), Gleason-score (specimen), pT-stadium, pN-status, chirurgische marge, BCR, en mortaliteit na RP. De follow-up van de patiënten bestond uit PSA-testen om de 3-6 maanden gedurende de eerste 2 jaar na RP, BCR werd gedefinieerd als PSA-niveau ≥0,2 ng/ml.
De relatie tussen AB0-bloedgroep en clinicopathologische variabelen werden beoordeeld met behulp van chi-kwadraattests en t-tests. In Cox regressie multivariabele analyse (log-rank tests), werd de impact van bloedgroep, preoperatief PSA, Gleason score, pT-stadium, pN-status, en chirurgische marge op BCR-vrije overleving beoordeeld om de prognostische waarden voor overleving te evalueren. De waarschijnlijkheid van BCR-vrije overleving werd vergeleken in 0, A, B, en AB groepen met behulp van Kaplan-Meier analyse en de log-rank test.
Alle tests waren twee-tailed en p-waarden <0,05 werden als statistisch significant beschouwd. Statistische analyses werden uitgevoerd met JMP software v9.0.2 (SAS Institute, Inc, Cary, NC, USA) en R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Resultaten
Er kwamen in totaal 3.574 patiënten met klinisch gelokaliseerde PCa in aanmerking voor definitieve analyses, de mediane leeftijd bij de operatie was 65 jaar (range: 38-80) en de mediane follow-up was 36,9 maanden (tabel 1).

Tabel 1. Associatie van de AB0-bloedgroep en Rhesusfactor met clinicopathologische kenmerken van 3.574 patiënten behandeld met radicale prostatectomie.
Distributie van AB0/Rh-bloedgroep bij patiënten met PCa
De distributie van AB0-bloedgroep bij patiënten met PCa voorafgaand aan RP was als volgt: 0 bij 1.350 (38%), A bij 1.605 (45%), B bij 445 (12%), en AB bij 174 (5%) patiënten, 83% van de patiënten was Rhesus positief (tabel 1). De referentieverdeling voor de Duitse bevolking is als volgt (18): 0 bij 41%; A bij 43%; B bij 11%; AB bij 5%; Rhesus positief: 85%. De algemene verdeling van zowel AB0 als Rh bloedgroepen in het studiecohort was gelijkwaardig aan de verdeling waargenomen in de Duitse mannelijke bevolking.
Geen significante verschillen in klinisch-pathologische kenmerken onder PCa-patiënten volgens AB0/Rh bloedgroepen
De meerderheid van de patiënten had klinisch gelokaliseerde PCa met een intermediair risicoprofiel. De meest gerapporteerde Gleason score was 3 + 4 (66,9%) en 63,3% van de patiënten had preoperatieve PSA niveaus binnen de range van 4-10 ng/ml. pT2 tumoren werden gedetecteerd in 68,7% en negatieve marges werden bereikt in 81,3% van de patiënten. Het mediane prostaatvolume was 40 ml en lymfeklierbetrokkenheid werd gediagnosticeerd bij 224 (6,3%) patiënten (Tabel 1). Er waren geen significante verschillen in klinisch-pathologische karakteristieken tussen patiënten met verschillende AB0 bloedgroepen. Licht verhoogde percentages van gevorderd tumorstadium (≥pT3b) werden gevonden bij patiënten met bloedgroep AB in vergelijking met bloedgroepen 0, A en B (16,1, 12,6, 9,9, en 13,7%, respectievelijk, p = 0,033). De patiëntenpopulatie met AB vertoonde ook een matig verhoogde ratio van negatieve Rh-factor (21,8%) in vergelijking met de andere bloedgroepen (16,9%, p = 0,01) (Tabel 1).
Geen Significante Prognostische Waarde van Bloedgroep voor BCR-Vrije Overleving na RP
Volgens multivariabele cox regressie analyse, correleerden preoperatief PSA, Gleason score, pT-stadium, pN-status, en chirurgische marge significant en onafhankelijk met BCR-Vrije Overleving (alle p < 0,05) (Tabel 2). Wij konden echter geen invloed waarnemen van de AB0 bloedgroep op het BCR percentage (figuur 1). Wij onderzochten verder de prognostische waarde van bloedgroep 0 vergeleken met niet-0 bloedgroepen alsmede binnen de alternatieve bloedgroepen A/B/AB met niet-significante resultaten (Tabel 2). Zelfs indien subanalyses met alleen patiënten met positieve of negatieve marge status werden uitgevoerd, bleef de invloed van AB0/Rh op BCR niet significant (Figuren 2A,B). Bovendien had ook de Rhesusfactorstatus van de patiënten geen invloed op de BCR-vrije overleving (p = 0,74).
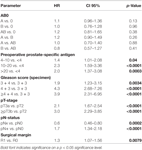
Tabel 2. Multivariabele cox regressiemodellen van AB0 en standaard prognostische factoren voor biochemische recidiefvrije overleving.
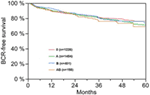
Figuur 1. Biochemisch recidief (BCR)-vrije overleving na radicale prostatectomie gestratificeerd naar AB0-bloedgroepen (p = 0,572).
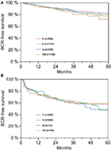
Figuur 2. (A,B) Biochemisch recidief (BCR)-vrije overleving na radicale prostatectomie gestratificeerd naar AB0-bloedgroepen bij patiënten met negatieve en positieve chirurgische marge-status.
Discussie
Mogelijke associaties tussen AB0-bloedgroep en het risico van sommige epitheliale maligniteiten, waaronder pancreas-, colorectale- en maagkanker, zijn vaak gerapporteerd (19, 20). Bovendien zijn de AB0/Rh bloedgroepen voor de meeste patiënten beschikbaar vóór de chirurgische ingreep, zodat ze worden voorgesteld als een ideale aanvullende marker zonder bijkomende laboratoriumstappen.
Enkele decennia geleden wezen immunohistochemische studies erop dat van patiënten afkomstige PCa-cellen verschillende patronen van ABH-expressie vertonen dan normale/benigne prostaatcellen (21). Aangezien zowel AB0 bloedgroep als zijn antigeenexpressie op weefsel geassocieerd zijn met incidentie, ziekteprogressie en resultaat bij verschillende maligniteiten (8, 22, 23), suggereerde een dergelijke veranderde expressie van ABH-antigeen in prostaatweefsel een mogelijke invloed van de bloedgroep op de kwaadaardige transformatie van prostaatcellen.
Een recente studie gepubliceerd door Markt en collega’s (14) analyseerde de relatie tussen AB0 bloedgroep en het risico van het hebben van agressieve PCa. De auteurs analyseerden een dataset van 2.774 patiënten met agressieve PCa en 4.443 patiënten zonder PCa als controles. Aan de hand van deze gegevens kon geen significante correlatie worden aangetoond tussen AB0 bloedgroep of “dosis” van A of B allelen en het risico op agressieve PCa. Hoewel de auteurs ook melding maakten van kankerspecifieke en algemene mortaliteit gestratificeerd naar bloedgroep, bevatte de studie geen informatie over de behandeling van PCa. Bovendien werden alleen patiënten met agressieve tumoren geïncludeerd, wat het potentiële effect van verschillende bloedgroepen zou kunnen maskeren.
Deze resultaten zijn in overeenstemming met een studie van Kvist en collega’s, die geen correlatie aantoonde tussen bloedgroep AB0 en de overleving van patiënten met PCa die werden behandeld met watchful waiting. Deze studie was vooral beperkt door het kleine aantal gevallen (n = 279) (12). Interessant is dat de enige studie die zich richtte op patiënten na RP en die 555 Japanse patiënten omvatte, onlangs meldde dat bloedgroep 0 significant geassocieerd was met een verminderd risico van BCR na RP in multivariabele maar niet univariabele analyse (13). In de subanalyse van patiënten met een negatieve chirurgische marge was het 5-jaars BCR-vrije percentage in bloedgroep 0 significant hoger dan dat in groep A (91,2 vs. 71,0%; p = 0,026). In dit studiecohort had 46,3% van de patiënten een positieve marge-status ondanks een klinisch stadium van T1c in 74,2% van de patiënten. Het pathologische stadium (pT) werd niet vermeld.
Onze retrospectieve cohort van 3.574 patiënten met klinisch gelokaliseerde PCa is de grootste cohort die tot nu toe werd geanalyseerd om een mogelijke invloed van zowel AB0 als Rh bloedgroepen op tumorkarakteristieken en uitkomst na RP te bepalen. In de huidige studie had de meerderheid van de patiënten pT2 tumoren (68,7%) en 18,6% had positieve marge status. Aan de hand van deze gegevens konden wij geen significante invloed aantonen van AB0/Rh bloedgroepen op klinisch-pathologische kenmerken (preoperatief PSA, Gleason score, prostaatvolume, pT stadium, pN status, en chirurgische marge) en BCR-vrije overleving na curatieve RP. Bovendien bleef de invloed van AB0/Rh op BCR onbeduidend bij het uitvoeren van een subanalyse met alleen patiënten met positieve of negatieve marge-status. Daarom konden wij de resultaten van de Japanse studie (13) niet reproduceren. In tegenstelling tot andere maligniteiten zoals pancreas- of blaaskanker, had de AB0/Rh bloedgroep geen prognostische waarde bij PCa.
Er zijn verschillende belangrijke beperkingen aan onze studie. Eerst en vooral zijn er de beperkingen die inherent zijn aan retrospectieve analyses en het ontbreken van een controlegroep. Bovendien bevat ons studiecohort voornamelijk gelokaliseerde PCa met een laag tot intermediair risicoprofiel (Gleason score 3 + 4 in 66,9%, preoperatief PSA van 4-10 ng/ml in 63,3%, pT2 in 68,7% en negatieve marges in 81,3% patiënten) waardoor een preselectie van patiënten met een gunstige prognose mogelijk is. Bovendien is de algemene verdeling van AB – in tegenstelling tot de andere bloedgroepen – over het algemeen laag overvloedig (4,9%). Sommige observaties, zoals de matig verhoogde ratio van negatieve Rh-factor (21,8%) bij patiënten met AB in vergelijking met de andere bloedgroepen (16,9%, p = 0,01), kunnen mogelijk worden versterkt door de zeldzaamheid van Rh-negatieve AB-types, die een statisch significante detectie van een correlatie binnen deze subgroep verhindert. Tenslotte ontbrak informatie over het genotype van de respectieve bloedgroep.
Naast de bovenvermelde kenmerken kunnen milieu-, geografische en raciale overwegingen nooit worden verwaarloosd bij de bespreking van correlaties van AB0 bloedgroep met kanker. De raciale en etnische verschillen in bloedgroepen en in PCa zijn welbekend (24, 25). In Europa, waar PCa de meest voorkomende maligniteit is en de tweede doodsoorzaak door kanker bij mannen (1), zijn de meest frequente bloedgroepen A en 0, oplopend tot allel B van west naar oost. Aziatische landen met de laagste incidentie en lage graad van PCa worden daarentegen gekenmerkt door een hoog voorkomen van types B en een relatief lage frequentie van 0, alsook een kleinere populatie met negatieve Rh-factor (26). In dit opzicht verschillen onze resultaten van de huidige studie bij Japanse patiënten met een relatief hoge positieve marge status en BCR na curatieve RP (13).
Er zijn verschillende mechanismen voorgesteld om te verklaren hoe bloedgroep de incidentie en progressie van kanker beïnvloedt; ze blijven echter nog steeds onduidelijk. In het geval van blaaskanker werd een chromosoomafwijking gesuggereerd, omdat het AB0-gen zich op chromosoom 9q34 bevindt, een gebied dat vaak veranderd is bij blaaskanker (27). Aangezien het AB0-gen feitelijk codeert voor glycosyltransferases, die de overdracht van suikers naar het H-antigeen (0) katalyseren, is het optreden van blaaskanker mogelijk gecorreleerd met de bloedgroep 0. Daarentegen is gerapporteerd dat personen met niet-0 bloedgroepen (A, AB, en B) een verhoogd risico hebben op het ontwikkelen van maagkanker en wijzen op een kankerspecifieke rol van de bloedgroep.
Wat PCa betreft, zijn er verschillende inspanningen gaande om de rol van bloedgroep in overleving na therapie op te helderen. Er werd reeds gerapporteerd dat patiënten met bloedgroep niet-0 een verhoogd risico op veneuze trombo-embolie na RP zouden hebben, wat een invloed op het resultaat zou kunnen hebben (28). Zelfs een recent gepubliceerde studie toonde aan dat serum antilichamen tegen bloedgroep A de overleving voorspellen op PROSTVAC-VF (een op poxvirus gebaseerd therapeutisch kankervaccin in fase III klinische proeven voor de behandeling van gevorderd PCa) en zou moeten worden beschouwd als een nieuwe potentieel voorspellende biomarker voor PROSTVAC-VF (29). Hoewel wij in onze studie geen duidelijke associatie tussen bloedgroep AB0/Rh en tumorpathologie en -uitkomst hebben waargenomen, suggereert dit bewijs toch een voorspellende rol van de bloedgroep in de PCa-epidemiologie en de klinische uitkomst, vooral met het oog op de therapierespons.
De huidige studie met 3.574 patiënten is de grootste tot nu toe die de impact van AB0 of Rh bloedgroepen op pathologie en uitkomst na RP analyseert en voegt belangrijke kennis toe aan de literatuur.
In conclusie, onze gegevens suggereren geen relevante associatie van AB0/Rhesus bloedgroep met ongunstige clinicopathologische tumorkarakteristieken of oncologische uitkomst na chirurgie in tegenstelling tot verschillende andere maligniteiten. Niettemin is verder onderzoek aangewezen om een mogelijke associatie tussen genotype van bloedgroep of zijn antigeenexpressie op PCa-weefsel en prognose binnen verschillende therapiegroepen te beoordelen, waaronder hooggradige of gevorderde PCa, die onvoldoende werden weerspiegeld in onze studiegroep.
Informed Consent
Informed consent werd verkregen van alle individuele deelnemers die in de studie werden opgenomen.
Ethics Statement
Alle procedures uitgevoerd in studies met menselijke deelnemers waren in overeenstemming met de ethische normen van de institutionele en/of nationale onderzoekscommissie en met de Verklaring van Helsinki van 1964 en latere wijzigingen of vergelijkbare ethische normen.
Author Contributions
SO, DT, en TS: substantiële bijdragen aan de conceptie of het ontwerp van het werk, het opstellen van het werk, de uiteindelijke goedkeuring van de versie die zal worden gepubliceerd. PM: substantiële bijdragen aan de conceptie of het ontwerp van het werk, het opstellen van het werk, de uiteindelijke goedkeuring van de versie die zal worden gepubliceerd. FC: verwerving, analyse of interpretatie van gegevens voor het werk, kritisch herzien op belangrijke intellectuele inhoud, definitieve goedkeuring van de te publiceren versie. PT: verwerving, analyse of interpretatie van gegevens voor het werk, kritische herziening voor belangrijke intellectuele inhoud, definitieve goedkeuring van de te publiceren versie. SP: verwerving, analyse of interpretatie van gegevens voor het werk, kritisch herzien op belangrijke intellectuele inhoud, definitieve goedkeuring van de te publiceren versie. JLH, JH, en MG: acquisitie, analyse, of interpretatie van gegevens voor het werk, kritisch herzien voor belangrijke intellectuele inhoud, definitieve goedkeuring van de te publiceren versie. Alle auteurs stemden ermee in verantwoordelijk te zijn voor alle aspecten van het werk door ervoor te zorgen dat vragen met betrekking tot de nauwkeurigheid of integriteit van een deel van het werk op passende wijze worden onderzocht en opgelost.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
De behandelend redacteur verklaarde een gedeelde affiliatie, maar geen andere samenwerking, met verschillende van de auteurs (FC, SP, JH, en DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Kankerstatistieken, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Risicofactoren voor prostaatkanker. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Genetische etiologie van erfelijke prostaatkanker. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Reported family history of cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses van cohorten van tweelingen uit Zweden, Denemarken, en Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impact of ABO blood type on outcomes in patients with primary nonmuscle invasive bladder cancer. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variatie op ABO histo-bloedgroep en FUT loci en diffuus en intestinaal maagkankerrisico in een Europese populatie. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. The gene encoding the I blood group antigen: review of an I for an eye. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Expressie van bloedgroepantigenen A, B en H in carcinoomweefsel correleert met een slechte prognose voor colorectale kankerpatiënten. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO bloedgroep en incidentie van epitheliale eierstokkanker. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Prognostische variabelen bij patiënten met prostaatkanker: invloed van bloedgroep ABO (H), het Rhesus-systeem, leeftijd, differentiatie, tumorstadium en metastasen. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associaties tussen ABO-bloedgroepen en biochemisch recidief na radicale prostatectomie. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. ABO bloedgroep allelen en prostaatkanker risico: resultaten van de borst en prostaatkanker cohort consortium (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovasculair structuur-aangrenzend vriescoupe-onderzoek (NeuroSAFE) verhoogt de zenuwsparende frequentie en vermindert positieve chirurgische marges bij open en robot-geassisteerde laparoscopische radicale prostatectomie: ervaring na 11.069 opeenvolgende patiënten. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Guidelines on Prostate Cancer 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Bloedgroep bepaalt incidentie voor pancreaskanker in Duitsland. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. ABO bloedgroepen en kanker. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. Het ABO- en Lewis-bloedgroepsysteem. Immunochemistry, genetics and relation to human disease. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detection of blood group antigens in frozen sections of prostatic epithelium. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Expressie van ABH/Lewis-gerelateerde antigenen als prognostische factoren bij patiënten met borstkanker. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. The blood group ABO gene transcript is down-regulated in human bladder tumors and growth-stimulated urothelial cell lines. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. Een overzicht. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Modelgebaseerde patronen in prostaatkankersterfte wereldwijd. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. ABO en Rh(D) fenotype frequenties van verschillende raciale/etnische groepen in de Verenigde Staten. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Genotypic and phenotypic characterization of the histoblood group ABO(H) in primary bladder tumors. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Prostaatkanker: niet-O bloedgroep is VTE risicofactor na radicale prostatectomie. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Serum antilichamen tegen bloedgroep A voorspellen overleving op PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar