het belangrijkste functionele bestanddeel van de rode bloedcel, dat dient als het zuurstofdragende eiwit; het is een type hemoproteïne waarin elke molecule een tetramer is, bestaande uit vier monomeren die door zwakke bindingen bij elkaar worden gehouden. Het bestaat uit twee paar polypeptideketens, de globines, die elk een heemmolecuul hebben dat bestaat uit ijzer plus een protoporfyrinemolecuul. Symbool Hb.
Het ijzeratoom heeft een vrije valentie en kan één zuurstofmolecuul binden. Elk hemoglobinemolecuul kan dus één zuurstofmolecuul binden. De binding van zuurstof door één monomeer verhoogt de affiniteit voor zuurstof van de andere monomeren in het tetrameer. Hierdoor is hemoglobine een efficiënter transporteiwit dan een monomeer eiwit zoals myoglobine.
Zuurstofhoudend hemoglobine (oxyhemoglobine) is helderrood van kleur; hemoglobine dat niet aan zuurstof is gebonden (deoxyhemoglobine) is donkerder. Dit verklaart de helderrode kleur van arterieel bloed, waarin het hemoglobine voor ongeveer 97% verzadigd is met zuurstof. Veneus bloed is donkerder omdat het slechts voor 20 tot 70% verzadigd is, afhankelijk van de hoeveelheid zuurstof die door de weefsels wordt gebruikt. De affiniteit van hemoglobine voor koolmonoxide is 210 keer zo sterk als zijn affiniteit voor zuurstof. Het gevormde complex (carboxyhemoglobine) kan geen zuurstof transporteren. Koolmonoxidevergiftiging leidt dus tot hypoxie en verstikking.
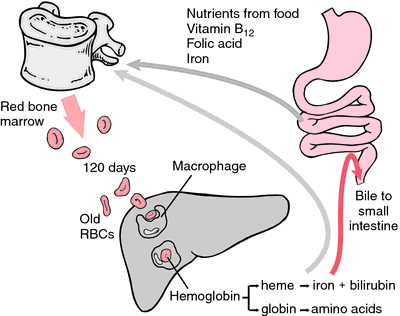
Een andere vorm van hemoglobine die geen zuurstof kan transporteren is methemoglobine, waarin het ijzeratoom is geoxideerd tot de oxidatietoestand +3. Tijdens de levensduur van 120 dagen van een rode bloedcel wordt hemoglobine langzaam geoxideerd tot methemoglobine. Minstens vier verschillende enzymsystemen kunnen methemoglobine weer omzetten in hemoglobine. Wanneer deze defect of overbelast zijn, kan methemoglobinemie het gevolg zijn, waarbij hoge methemoglobinespiegels dyspnoe en cyanose veroorzaken.
Een secundaire functie van hemoglobine is als onderdeel van het buffersysteem van het bloed. De histidineresiduen in de globine-ketens fungeren als zwakke basen om de verandering in pH van het bloed te minimaliseren, die optreedt als zuurstof wordt geabsorbeerd en kooldioxide vrijkomt in de longen en als zuurstof wordt toegediend en kooldioxide wordt opgenomen uit de weefsels.
Als erytrocyten verslijten of beschadigd raken, worden ze opgegeten door macrofagen van het reticulo-endotheliale systeem. De porfyrinering van heem wordt omgezet in het galpigment bilirubine, dat door de lever wordt uitgescheiden. Het ijzer wordt naar het beenmerg getransporteerd om te worden opgenomen in het hemoglobine van nieuw gevormde erytrocyten.
De hemoglobineconcentratie van het bloed varieert met het hematocriet. De normale waarden voor de hemoglobineconcentratie in het bloed zijn 13,5 tot 18,0 g/100 ml bij mannen en 12,0 tot 16,0 g/100 ml bij vrouwen. De normale gemiddelde corpusculaire hemoglobineconcentratie, dat is de concentratie in de rode bloedcellen, is 32 tot 36 g/100 ml.
Er zijn veel abnormale hemoglobines ontdekt die het gevolg zijn van mutaties. Sommige hebben een veranderde zuurstofaffiniteit, sommige zijn instabiel, en in sommige is het ijzeratoom geoxideerd, wat leidt tot congenitale methemoglobinemie. Sommige mutaties leiden tot een verminderde synthese van hemoglobine. Al deze aandoeningen staan bekend als hemoglobinopathieën.
De meest voorkomende hemoglobinopathie is sikkelcelziekte, veroorzaakt door een mutatie waarbij het zesde aminozuur in de β-keten, normaal glutaminezuur, wordt vervangen door valine. De variant hemoglobine α2βS2 staat bekend als Hb S. Mutaties die leiden tot verminderde synthese van een van de ketens worden thalassemieën genoemd. Zij kunnen het gevolg zijn van deletie van het gen voor een keten of van een mutatie in het regulatiegen dat de synthese van de keten regelt.