SONAL DESAI, ARCHITA PATEL AND S. Y. GABHE*
C. U. Shah College of Pharmacy, S. N. D. T. Women’s University, Sir Vithaldas Vidya Vihar, Juhu Tara Road, Santacruz (W), Mumbai – 400 049, India
Corresponderende auteur: S. Y. GABHE E-mail:
| Date of Accepted | 16-Jan-2011 |
| Date of Revised | 26-Okt-2010 |
| Datum van ontvangen | 9-apr-2009 |
DOI: 10.4103/0250-474X.89762
Abstract
Een eenvoudige isocratische reversed phase hogedrukvloeistofchromatografie werd gebruikt om drie onzuiverheden te scheiden die aanwezig waren in het monster van 8-chloorthotheofylline. LC-MS werd gebruikt voor de karakterisering van de onzuiverheden. Op basis van massaspectrale gegevens werden de structuren van deze onzuiverheden gekarakteriseerd als 3,7-dihydro-1,3-dimethyl-1H-purine-2,6-dion (onzuiverheid I), 3,7-dihydro-1,3,7-trimethyl-1H-purine-2,6-dion (onzuiverheid II) en isomeer van 8-chloor-1,3-dimethyl-2,6(3H,1H)-purinedion (onzuiverheid III).
Keywords
8-Chlorotheofylline, onzuiverheid, LC-MS, reversed phase HPLC, theofylline
Inleiding
De geneesmiddelenindustrie in bulk vormt de basis van alle farmaceutische industrieën, omdat het de bron is van actieve farmaceutische ingrediënten (API’s) van gespecificeerde kwaliteit. De grootste uitdaging voor de industrie van bulkgeneesmiddelen is om op economische wijze het eindproduct van de vereiste kwaliteit en zuiverheid te produceren. De zuiverheid van API’s hangt af van verschillende factoren, zoals de grondstoffen, de fabricagemethoden en het type kristallisatie- of zuiveringsproces. Het is echter bijna onmogelijk om absoluut zuivere materialen te verkrijgen, omdat er tijdens de fabricage, de zuivering of de opslag onzuiverheden in terechtkomen. Een onzuiverheid is elk bestanddeel van een geneesmiddelsubstantie (met uitzondering van water) dat geen chemische eenheid is die als geneesmiddelsubstantie wordt gedefinieerd. Voor door chemische synthese geproduceerde geneesmiddelensubstanties deelt de ICH onzuiverheden in drie categorieën in: organische onzuiverheden, anorganische onzuiverheden en residuale oplosmiddelen. De onzuiverheden die in de stof aanwezig zijn, kunnen toxisch zijn, de fysische of chemische eigenschappen van de stof veranderen en de stof aldus medicinaal onbruikbaar maken. Onzuiverheden kunnen de houdbaarheid van het product verminderen en moeilijkheden veroorzaken bij de formulering. Daarom is niet alleen de controle op onzuiverheden, maar ook de kwalificatie van onzuiverheden een kritieke kwestie voor de industrie van bulkgeneesmiddelen.
Antihistaminica zoals dimenhydrinaat en promethazine theoclaat zijn veel gebruikte geneesmiddelen bij de behandeling van reisziekte. 8-Chlorotheofylline, chemisch 8-chloor-1,3-dimethyl-2,6(1H, 3H)-purinedion, is een tussenproduct dat wordt gebruikt bij de bereiding van zoutvorm van deze geneesmiddelen. Het is van essentieel belang dat de zuiverheid en de veiligheid van dimenhydrinaat en promethazine-theoclaat worden gewaarborgd. Om dit te bereiken moet 8-chloorthotheofylline worden verkregen met de hoogste zuiverheid en met een bekend onzuiverheidsprofiel.
Uit literatuuronderzoek blijkt dat Wadke et al. de interacties bestudeerden van 9-methylisoalloxazine en 3,9-dimethylisoalloxazine met 8-chloorthotheofylline. 8-chloorthotheofylline werd gebruikt als interne standaard voor de bepaling van uraat met de HPLC-methode. Het werd ook potentiometrisch bepaald. De gelijktijdige bepaling van chloorfenoxaminehydrochloride, 8-chloortheofylline en cafeïne in een multicomponentdoseringsvorm werd uitgevoerd met een dunnelaagchromatografie-densitometrische methode. Gil et al. onderzochten het elektroanalytische gedrag van 8-chloorthotheofylline door middel van cyclische voltammetrie en door middel van differentiële puls-polarografie en bepaalden het gehalte ervan in farmaceutische preparaten door middel van differentiële puls-polarografie. Er werd een stabiliteitsindicerende RP-HPLC-methode ontwikkeld en gevalideerd voor 8-chloorthotheofylline samen met difenhydramine en cafeïne. Er werden ook ratio-spectra zero-crossing first-derivative spectrofotometrische en chemometrische methoden ontwikkeld voor de gelijktijdige bepaling van cafeïne, 8-chloorthotheofylline en chloorfenoxaminehydrochloride in ternaire mengsels. Tot nu toe is er geen chromatografische en spectroscopische methode gerapporteerd voor de scheiding en karakterisering van onzuiverheden die aanwezig zijn in 8-chloorthotheofylline. Daarom werd dit werk ondernomen met het doel om de onzuiverheden aanwezig in 8-chloorotheofylline te isoleren en te karakteriseren met behulp van moderne analytische technieken.
8-chloorotheofylline was een geschenkmonster van Kores (India) Ltd., Thane. Alle andere chemicaliën en reagentia werden betrokken bij S.D. Fine Chemicals Ltd. (Mumbai, India). De oplosmiddelen die werden gebruikt voor TLC- en voorbereidende TLC-onderzoeken waren van analytische kwaliteit en de oplosmiddelen die werden gebruikt voor HPLC-onderzoeken waren van HPLC-kwaliteit. Voor de bereiding van de buffer werd natriumacetaattrihydraat van AR-kwaliteit gebruikt.
In eerste instantie werden TLC-onderzoeken uitgevoerd om het aantal onzuiverheden in het monster te bepalen. Als stationaire fase werden voorgecoate TLC-platen van silicagel 60GF254 (Merck) gebruikt. Het monster werd opgelost in een minimale hoeveelheid ethylacetaat en deze oplossing werd gebruikt om de TLC-platen te besproeien. Verschillende mobiele fasen werden uitgeprobeerd. Ethylacetaat:tolueen:ijsazijn (10:0,3:0,5 v/v/v) gaf een betere scheiding te zien dan andere mobiele fasen. Met behulp van TLC werden vier componenten van het monster van 8-chloorthotheofylline gescheiden met de Rf-waarden van respectievelijk 0,029, 0,132, 0,198 en 0,852. 8-Chloorotheofylline had een Rf van 0,852.
Nad de mobiele fase voor TLC was ontwikkeld, werd getracht het mengsel te scheiden met behulp van preparatieve TLC. Het monster werd opgelost in een minimale hoeveelheid ethylacetaat en in de vorm van een band gevlekt. De drie onzuiverheden werden van 8-chloorthotheofylline gescheiden door middel van preparatieve TLC onder dezelfde chromatografische omstandigheden als bij de TLC-onderzoeken. De verschillende banden werden afzonderlijk verzameld en geëxtraheerd met ethylacetaat. Aangezien de hoeveelheden van elk van de geïsoleerde onzuiverheden I, II en III zeer gering waren, werd besloten deze onzuiverheden collectief te isoleren. De onzuiverheden I, II en III werden gezamenlijk aangeduid als fractie I. Fractie I werd met behulp van preparatieve TLC geïsoleerd uit 8-chloorthotheofylline. Aangezien elke onzuiverheid niet afzonderlijk werd geïsoleerd, konden verschillende identificatietechnieken zoals IR en NMR niet worden uitgevoerd. Besloten werd verder onderzoek te verrichten met LC-MS, waarmee gelijktijdige scheiding en karakterisering mogelijk zijn. Voorafgaand aan de LC-MS analyse werd een HPLC profiel voor fractie I ontwikkeld. Voor HPLC-onderzoek werd een Tosoh hogedrukvloeistofchromatograaf gebruikt, uitgerust met een zuigerpomp CCPM, een pompregelaar PX8010 en een UV-detector. Een lus met een capaciteit van 20 µl werd aan de injectieklepunit bevestigd. Fractie I werd opgelost in acetonitril en onderworpen aan reversed phase HPLC-analyse met mobiele fase die bestond uit acetonitril: natriumacetaattrihydraat (pH 3,57; 0,01 M) (5:95 v/v). Als kolom werd Phenomenex ODS (250×4,6 mm I.D.; deeltjesgrootte 5 µm) gekozen. De stroomsnelheid was 1,5 ml/min en de detectie werd gecontroleerd bij een golflengte van 280 nm. De mobiele fase werd vóór gebruik onder vacuüm gefiltreerd over een G5-filter van gesinterd glas en gesonificeerd om luchtbellen te verwijderen. HPLC-analyse van fractie I bracht ook drie pieken aan het licht met de gemiddelde retentietijden van respectievelijk 8,324 min, 14,275 min en 20,933 min (fig. 1). De piek met een gemiddelde retentietijd van 2,086 min was de oplosmiddelpiek.
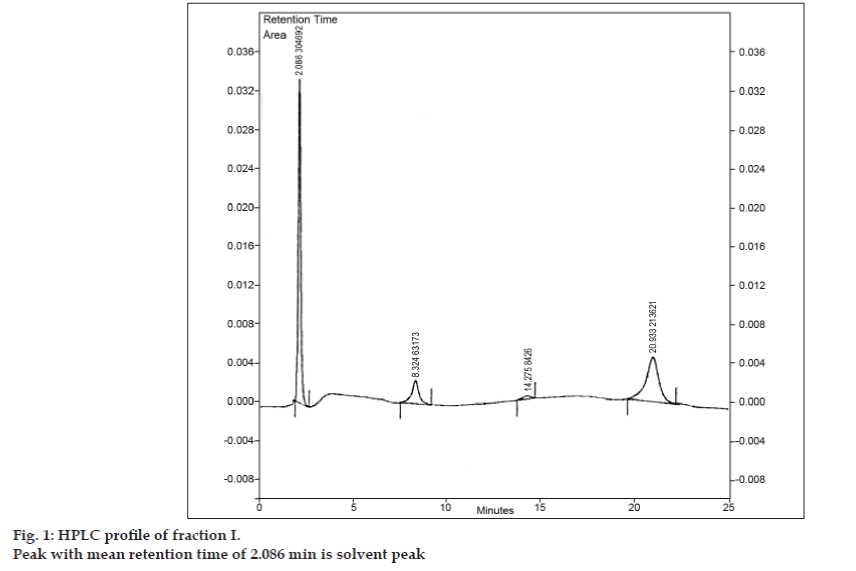
Figure 1: HPLC-profiel van fractie I.
Fractie I werd vervolgens onderworpen aan LC-MS-analyse voor karakterisering van onzuiverheden. LC-MS-onderzoeken werden uitgevoerd op een systeem waarin het LC-gedeelte bestond uit de 1100-serie HPLC (Agilent Technologies, VS) met een vacuümontgasser (G1322A), een quaternaire pomp (G1311A), een autosampler (G1313A) en een UV/zichtbaarheidsdetector (G1314A) en het MS-gedeelte uit de drievoudige quadrupool massaspectrometer Quattro II (Micromass UK Ltd., VK), UK).
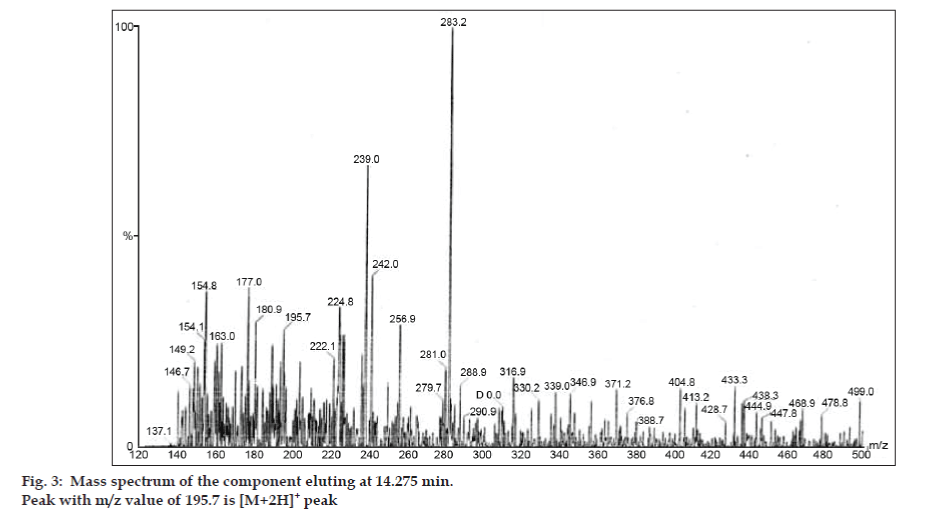
In LC-MS-studies werden vloeistofchromatografische scheidingen tot stand gebracht door Phenomenex C18-kolom (250×4,6 mm, 5 µm) bij kamertemperatuur met de mobiele fase van acetonitril: natriumacetaatbuffer (5:95, v/v) bij een stroomsnelheid van 1,5 ml/min. De massaspectrometer werkte in positieve elektronnevelionisatie (ESI)-modus met massa-/ladingsverhouding (m/z) in het bereik van 120-500 m/z. Als vernevelgas werd stikstof gebruikt. De gegevens werden verkregen en verwerkt met behulp van Masslynx-software. Massaspectrale gegevens van de onzuiverheden werden verkregen (fig. 2, 3 en 4). Het fragmentatietraject van drie pieken wordt gekenmerkt door verlies van de methylgroep en/of de carbonylgroep. Pieken met m/z-waarden van 180,9, 195,7 en 214,9 komen overeen met respectievelijk +, + en + pieken. Volgens de verkregen MS-gegevens waren de onzuiverheden die elueerden bij 8,324 min, 14,275 min en 20,933 min theofylline (mol.w. 180), cafeïne (mol.w. 194) en een isomeer van 8-chloorheofylline (mol.w. 214,5), respectievelijk (tabel 1). Aldus werden drie onzuiverheden gescheiden en hun structuren werden opgehelderd op basis van massaspectrale gegevens (Schema 1).
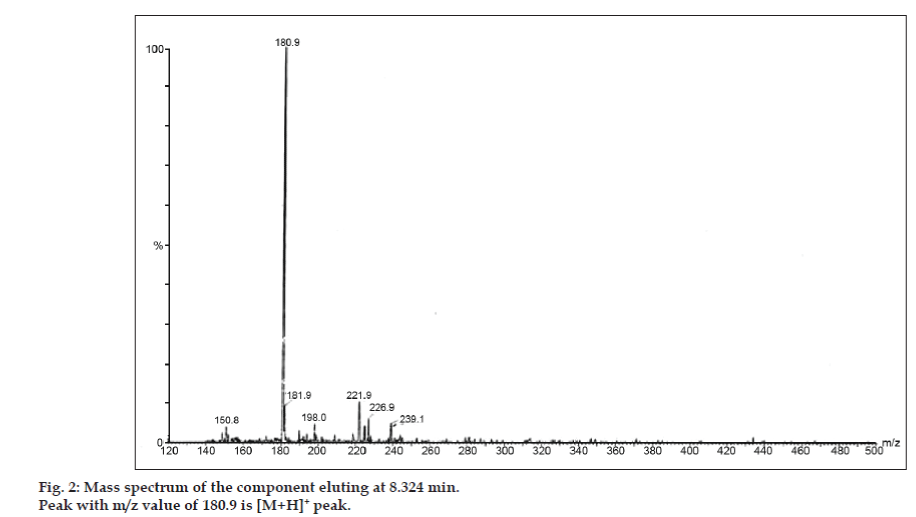
Figuur 2: Massaspectrum van de component die elueert bij 8,324 min.
Figuur 2: Massaspectrum van de component die elueert bij 8,324 min.
Figuur 3: Massaspectrum van de component die elueert bij 8,324 min. 3: Massaspectrum van de component die elueert bij 14,275 min.
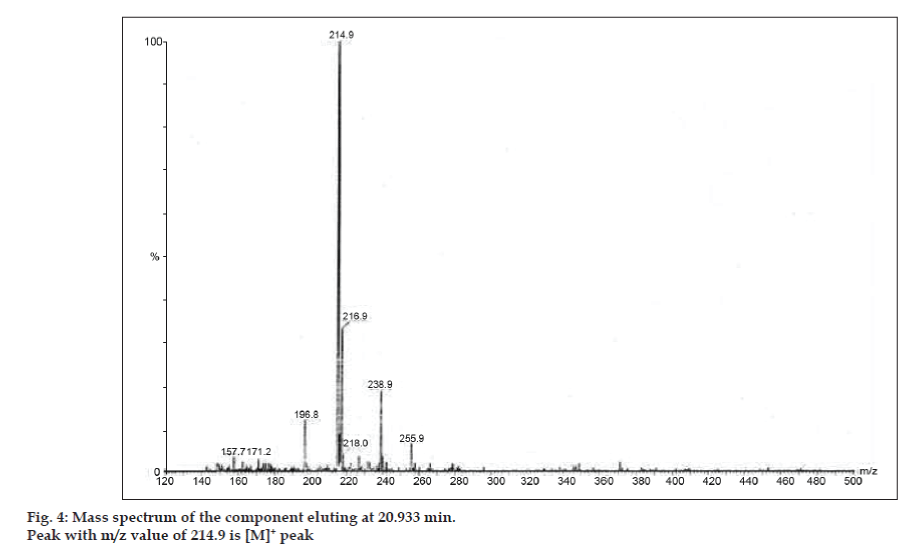
Fig. 4: Massaspectrum van de component die elueert bij 20,933 min.
| Peak no. |
Retentietijd (min) |
Fragmentionen (m/z) | Identificatie |
|---|---|---|---|
| 8.324 | 181.9 +, 180.9 +, 150.8 + | Theofylline | |
| 14.275 | 195.7 +, 180.9 +,149.2 +, 137.1+ | Caffeine | |
| 20.933 | 216.9 +, 214.9 +, 171.2 +, 157.7 + | Isomeer van 8- Chlorotheophylline |
TABLE 1: HPLC-MS IDENTIFICATIE VAN FRACTIE I
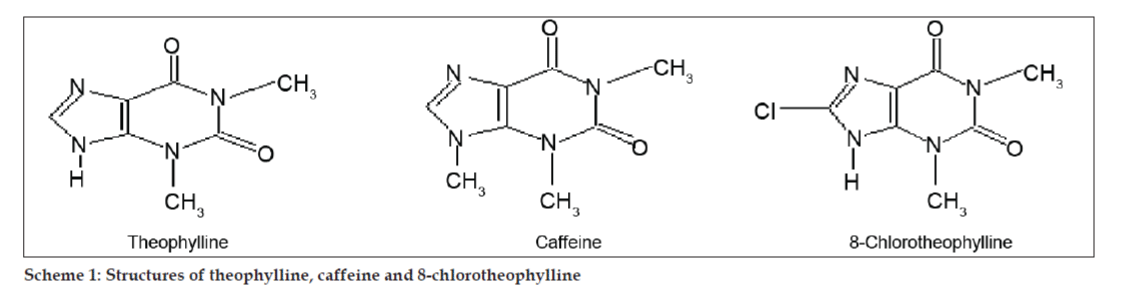
Schema 1: Structuren van theofylline, cafeïne en 8-chlorotheofylline
Acknowledgements
Auteurs zijn Kores (India) Ltd. dankbaar, Thane voor het verstrekken van gift monster van 8-chloorthotheofylline.
- Kasture AV, Wadodkar SG, Mahadik KR, More HV. Farmaceutische Analyse. Vol. 1. Pune: NiraliPrakashan; 1997. p. 12-4.
- United State Pharmacopoeia, Vol. 26. Rockville, MD: United States Pharmacopoeia Convention, Inc.; 1999. p. 2049-59.
- Ahuja S, Alsante KM. Handbook of isolation and characterization of impurities in pharmaceuticals. Californië: Academic Press; 2003. p. 6.
- Foye WO, Lemke TL, Williams DA. Principles of Medicinal Chemistry. 4e ed. New Delhi: B. I. Waverly Pvt Ltd; 1995. p. 419.
- Reynolds JE. Martindale-The Extra Pharmacopoeia. 29th ed. London: Pharmaceutical Press; 1989. p. 451,459.
- Wadke DA, Guttman DE. Complexvorming invloed op reactiesnelheid III. Interaction of some isoalloxazines with 8-chlorotheophylline as determined by spectral, solubility, and kinetic methods. J Pharm Sci 1965;54:1293.
- Bennett MJ, Patchett BP, Worthy E. A simple HPLC method for the determination of urate in serum and urine using 8-chlorotheophylline as internal standard. Med Lab Sci 1984;41:108-11.
- Nikolic K, Medenica M. Potentiometric determination of 8-chlorotheophylline. Microchimica Acta 1986;88:5.
- Bebawy LI, El-Kousy NM. Simultaneous determination of some multicomponent dosage forms by quantitative thin layer chromatography densitometric method. J Pharm Biomed Anal 1999;20:663-70.
- Gil EP, Blazquez LC, Garcia-MoncoCarra RM, Misiego AS. Polarographic Behavior of 8-Chlorotheophylline and its Determination in Dosage Forms. Electroanalysis 1993;5:343.
- Barbas C, Garcia A, Saavedra L, Castro M. Optimization and validation of a method for the determination of caffeine, 8-chlorotheophylline and diphenhydramine by isocratic high-performance liquid chromatography Stress test for stability evaluation. J ChromatogrA 2000;870:97-103.
- Kelani KM. Simultaneous determination of caffeine, 8- chlorotheophylline, and chlorphenoxamine hydrochloride in ternary mixtures by ratio-spectra zero-crossing first-derivative spectrophotometric and chemometric methods. J AOAC Int 2005;88:1126-34.