| Ed Davis, Ph.D. |
Inleiding
Lentivirus en Adeno-geassocieerd virus (AAV) zijn van onschatbare waarde gebleken voor de introductie van genetisch materiaal in zoogdiercellen, hetzij in cultuur, hetzij in gehele dieren. Beide systemen zijn zeer geschikt voor vele toepassingen van fundamenteel onderzoek, zoals proteïne-overexpressie, antilichamenproductie en gen-knockout, en beide zijn veelbelovend voor gentherapie. Elk viraal systeem heeft echter zijn eigen unieke voor- en nadelen, afhankelijk van de toepassing. GeneCopoeia biedt uitgebreide productlijnen voor zowel lentivirus als AAV, waardoor u beschikt over krachtige en flexibele opties voor het toedienen van DNA in cellen. In deze technische notitie beschrijven we de technologieën achter GeneCopoeia’s Lentifect™ lentivirus en AAVPrime™ AAV productlijnen, en bespreken we de voordelen van elke technologie voor verschillende toepassingen om u te helpen kiezen welk systeem het beste bij uw behoeften past.
Waarom virussen gebruiken voor DNA-afgifte?
Een van de meest gebruikelijke manieren om DNA in cellen af te leveren is door middel van plasmide-gebaseerde transfectie, waarbij cellen worden behandeld met chemische verbindingen zoals calciumfosfaat, of met lipide-gebaseerde reagentia. Plasmidetransfectie is echter niet altijd wenselijk of praktisch. Zo zijn sommige cellen zeer moeilijk of niet te transfecteren, terwijl de meeste gekweekte cellen infectie (ook wel transductie genoemd) door een lentivirus of AAV ondersteunen. Ten tweede kan plasmidetransfectie niet worden gebruikt voor in vivo DNA-levering, maar virale transductie wel. Zowel lentivirus als AAV kunnen worden gebruikt voor een groot aantal toepassingen, zoals eiwitexpressie van open leesramen (ORF’s), uitschakeling van genen door RNA-interferentie (RNAi) gemedieerd door short hairpin RNA (shRNA), luciferase en andere reporter-gen assays, en uitschakeling van genen gemedieerd door het clustered, regularly-interspaced, short palindromic repeats-Cas9 (CRISPR-Cas9) systeem. Veel van deze toepassingen voor virale vectoren zijn met succes uitgevoerd in gekweekte geïmmortaliseerde zoogdiercellijnen, primaire celcultuur, diermodellen en in gentherapie bij menselijke patiënten.
De term “Lentivirus” verwijst naar de klasse van retrovirussen die het humaan immunodeficiëntievirus (HIV) omvat, en in feite zijn de meeste lentivirale systemen die momenteel in gebruik zijn, afgeleid van HIV (besproken in Mátrai, et al, 2010; Sakuma, et al., 2012). Lentivirussen met transgenen integreren bij infectie in het genoom en maken zo een stabiele expressie mogelijk in zowel delende als niet-delende cellen.
Lentivirale systemen zijn in de loop van verschillende generaties sterk gemodificeerd ten opzichte van HIV om ze veilig hanteerbaar en bruikbaar voor toepassingen te maken. GeneCopoeia gebruikt het lentivirale systeem van de derde generatie (Dull, et al. 1998), dat vier afzonderlijke plasmiden nodig heeft om besmettelijke virusdeeltjes (virionen) te produceren. Een GeneCopoeia lentiviraal plasmide bevat alleen het tot expressie te brengen gen van belang (GOI), een antibiotica-selectiegen en de verpakkingssignaalsequenties. Soms zal de kloon ook een fluorescerend reportergen bevatten. Het GOI-bevattende plasmide, met het selecteerbare marker- en reportergen, kan inserts bevatten tot ongeveer 5-6 kb. (Figuur 1), hoewel de virale titers drastisch dalen wanneer de insert groter is dan ongeveer 4 kb.
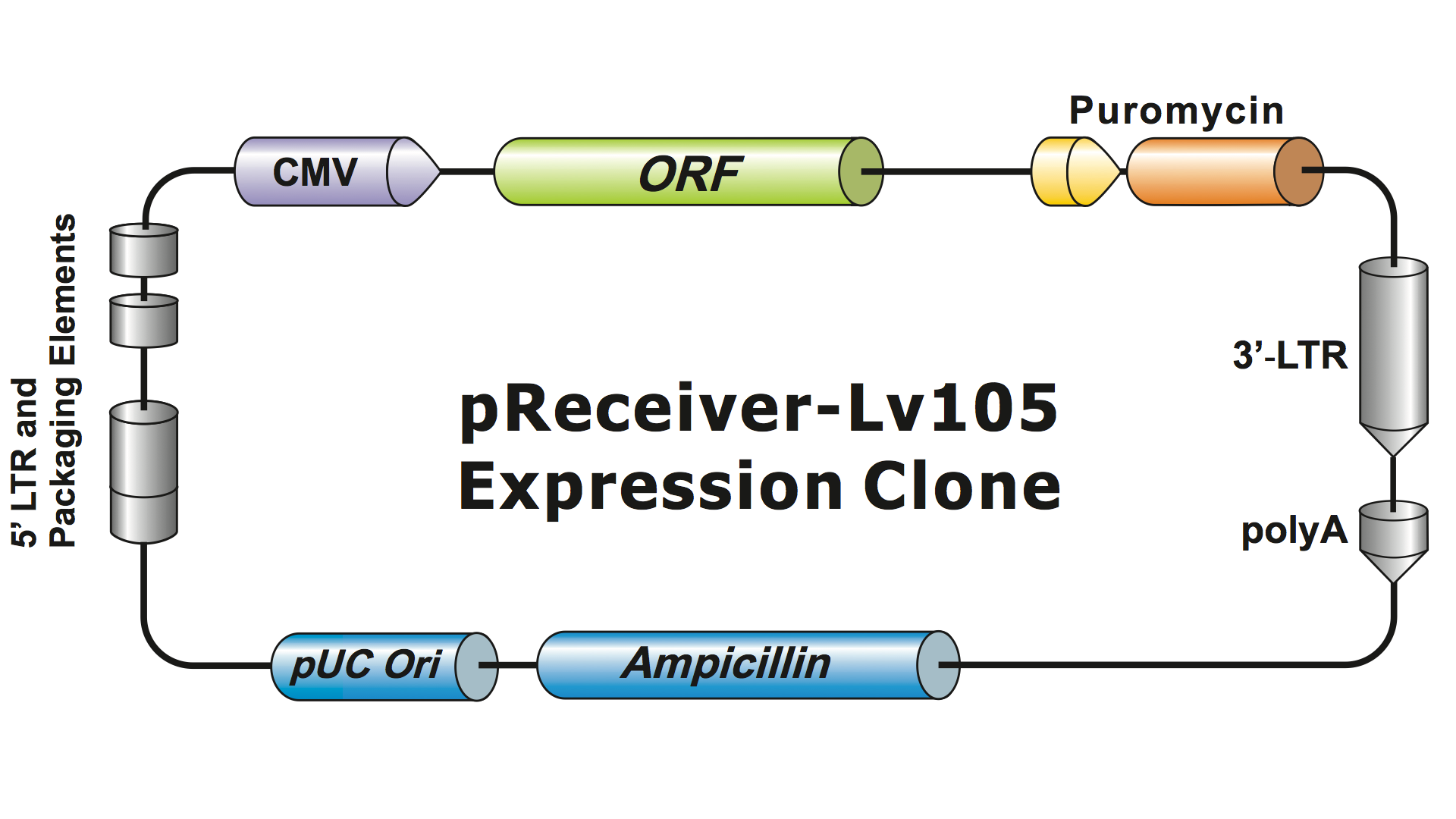 |
Figuur 1. Voorbeeld van een GeneCopoeia lentivirale expressiekloon |
De extra plasmiden brengen de retrovirale elementen tot expressie die nodig zijn voor packaging en integratie (gag, pol, env, Rev). Wanneer alle vier plasmiden in verpakkingscellen tot expressie worden gebracht, wordt het GOI RNA in de deeltjes geïncorporeerd. Omdat de retrovirale eiwitten alleen tot expressie komen tijdens het verpakken, kunnen geïnfecteerde cellen geen infectieus virus produceren. Bovendien bevatten GeneCopoeia’s Lentifect™ lentivirale deeltjes een deletie in de U3-regio van de LTR’s, waardoor ze zelfinactiverend (SIN) zijn. De SIN-deletie voorkomt lentivirale replicatie in het zeldzame geval dat alle vier plasmiden recombineren om één actief virusplasmide te creëren. Daarom zijn lentivirale deeltjes veilig te hanteren, met vrijwel geen kans op het genereren van pathogeen virus.
Naast de verbeterde veiligheidsmodificaties dragen GeneCopoeia’s Lentifect™ lentivirale deeltjes de vesiculaire stomatitis virus G (VSV-G) glycoproteïne in plaats van het wilde type HIV env gen, waardoor de weefseltropisme van het virus verandert van CD4+ T-cellen naar vrijwel elk zoogdier celtype. Als zodanig zijn lentivirussen een veelgebruikt systeem voor zoogdiercelcultuur, diermodellen en gentherapietoepassingen.
Omdat de lentivirale vectoren op deze manieren zijn gemodificeerd, hebben de Lentifect™ lentivirale systemen van GeneCopoeia een verbeterde veiligheid en hebben ze de volgende kenmerken die ze zeer bruikbaar maken voor DNA-afgifte:
- Zij infecteren bijna alle typen zoogdiercellen
- Zij kunnen worden gebruikt om relatief grote DNA-sequenties af te leveren – tot ongeveer 5-6 kb in lengte
- Zij kunnen worden gebruikt om stabiele cellijnen te genereren, of stabiele genexpressie in organen en weefsels in vivo te stimuleren, door integratie van het transgen op willekeurige plaatsen in het genoom
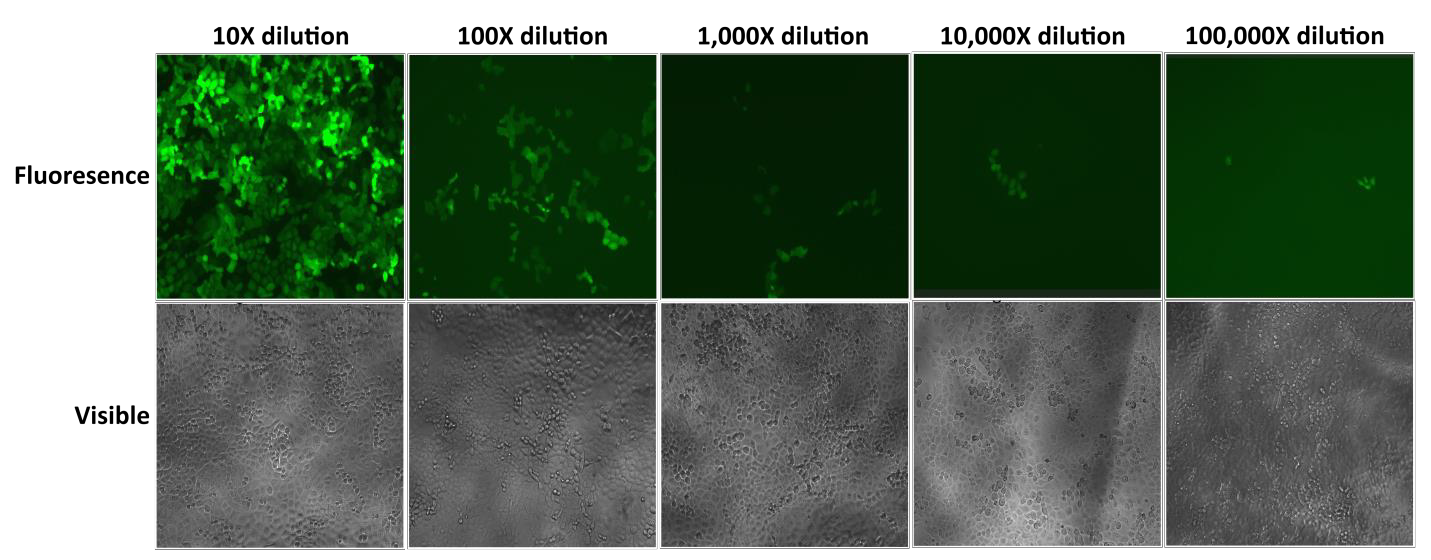
GeneCopoeia’s Lentifect™ lentivirale deeltjes leveren hoge titers, waardoor onderzoekers genen van belang efficiënt tot expressie kunnen brengen (figuur 2).
|
Figuur 2. Test van seriële verdunningen van Lentifect™ lentivirale deeltjes. eGFP-fluorescentie werd gefotografeerd met een fluorescentiemicroscoop 72 uur na transductie. |
|
GeneCopoeia biedt een van de meest uitgebreide lijnen van lentivirale producten in de industrie (tabel 1).
| Product/dienst | Beschrijving |
| Lentivirale klonen en kloneringsvectoren | Voorgefabriceerde en klantspecifieke klonen met ORF’s, promotors, shRNA’s, miRNA 3’UTR’s, precursors en remmers, sgRNA’s, en meer. Verkrijgbaar met meerdere promotors, tags en reporters. Vectoren voor doe-het-zelf klonering van sequenties van belang. |
| Lentifect™ lentivirale deeltjes | Voorgemaakte en op maat verpakte, gebruiksklare lentivirale deeltjes. Geproduceerd uit GeneCopoeia’s uitgebreide, genoom-brede klooncollecties of uit door de klant ingezonden klonen. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Compleet systeem van reagentia voor doe-het-zelf productie van lentivirale deeltjes. Bevat verpakkingsplasmiden, verpakkingscellijn, deeltjesconcentratieoplossing en titratiekit. |
Tabel 1. GeneCopoeia’s lijn van lentivirale producten en diensten.
AAV-gebaseerde systemen
In tegenstelling tot het RNA-genoom van lentivirussen, heeft AAV een enkelstrengs DNA-genoom (Samulski en Muzyczka, 2014). Ook is AAV niet afgeleid van een pathogeen; het is eerder een contaminant van adenovirus, zonder dat er pathogene aandoeningen aan worden toegeschreven. Natuurlijk voorkomend AAV integreert in het genoom zoals lentivirus, maar alleen op de AAVS1 locus op chromosoom 19. Deze plaats staat ook bekend als “Safe Harbor”, omdat hij algemeen wordt gebruikt voor transgene insertie zonder cellen te schaden (DeKelver, et al., 2010).
Zoals lentivirus is AAV gemodificeerd voor veiligheid en bruikbaarheid. AAV vereist co-infectie met een helpervirus. Het AAV-genoom is 4,7 kb lang en bevat 2 genen, Rep en Cap, die nodig zijn voor virale replicatie en integratie. In AAVPrime™ worden Rep en Cap verwijderd, zodat alleen de 145 bp 5′ en 3′ inverted terminal repeats (ITR’s) overblijven. Het verwijderen van Rep en Cap dient drie doelen: 1) het elimineert het vermogen van een helpervirus om met AAV geïnfecteerde cellen in staat te stellen nieuwe AAV-virionen te produceren; 2) het maakt de insertie van genen tot ongeveer 4 kb lang mogelijk (hoewel de virale titer afneemt met transgenen langer dan 3 kb); en 3) het elimineert vrijwel het vermogen van AAV om te integreren. De geringe omvang van AAV vormt een uitdaging voor sommige toepassingen. Voor CRISPR-genoombewerking, bijvoorbeeld, gebruiken onderzoekers Cas9 nuclease van S. aureus, omdat het ongeveer 30% korter is dan de meer algemeen gebruikte S. pyogenes Cas9 (Ran, et al., 2015).
Voor het verpakken zijn Rep en Cap naar een ander plasmide verplaatst, en de Adenovirus-helpergenen zijn op een derde plasmide geplaatst, waardoor het hele verpakkingssysteem veilig en helpervirusvrij is (figuur 3).
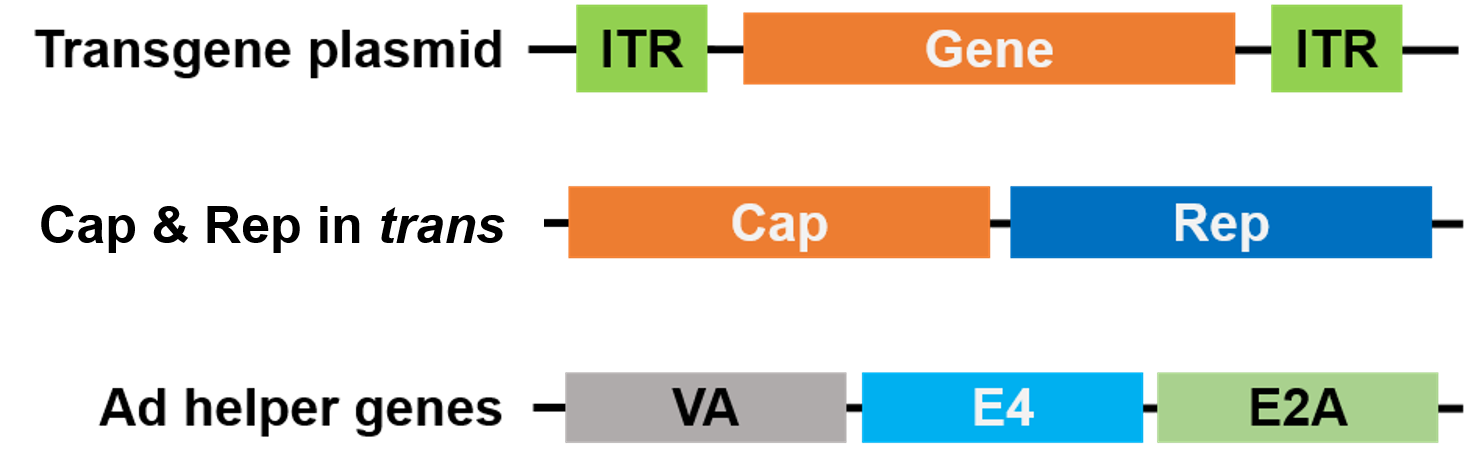 |
Figuur 3. Helper virus-vrije AAV. 3 plasmiden worden gebruikt voor het verpakken. Het gen van belang plasmide (boven) bevat de inverted terminal repeats (ITRs). Een 2e plasmide (midden) draagt de AAV Cap en Rep genen, en het 3e plasmide (onder) draagt de vereiste genen van Adenovirus (Ad) |
Verder bestaat AAV in verschillende serotypes, die de weefselspecificiteit van AAV-infectie beïnvloeden. Meerdere serotypen stellen onderzoekers in staat a) een breed scala van gastheercellen te infecteren, of b) de infectie tot een of enkele weefsels te beperken. GeneCopoeia’s AAVPrime™ AAV-deeltjes zijn verkrijgbaar in meerdere serotypen (tabel 2).
| Serotype | Primair doelweefsel | Beschrijving |
| AAV-1 | Spier | Beste voor hartspierweefsel, skeletspierweefsel, neuronaal en gliaal weefsel. |
| AAV-2 | Spier, lever, netvlies | Meest gebruikte serotype. Beste voor neuronen, spier, lever, en hersenen. |
| AAV-3 | Megakaryocyten | Beste voor megakaryocyten, spier, lever, long, en retina. |
| AAV-4 | Retina | Best voor neuronen, spier, hersenen, en netvlies. |
| AAV-5 | Long | Best voor long, neuronen, synoviaal gewricht, netvlies, en pancreas. |
| AAV-6 | Muscle, Lung | Best voor long, lever, en hart. |
| AAV-7 | Spier, Netvlies, Neuronen | Beste voor spier, neuronen, en lever. |
| AAV-8 | Liver | Beste voor spier, brein, lever, en netvlies. |
| AAV-9 | Variant | Beste voor spier, hart, lever, long, en hersenen. |
| AAV-10 | Pleura, CZS | Geklonken van Cynomolgus, bijna identiek aan AAVrh10 behalve 12 aminozuren in VP1. Best voor long, spier, hart, NCS en lever. |
| AAV-DJ | Various | Een mengsel van 8 natuurlijk voorkomende serotypen. Transduceert efficiënt een grote verscheidenheid van celtypes in vitro. |
| AAV-DJ/8 | Various | Een variant van AAV-DJ met een heparine bindend domein (HBD) mutatie, die infectie van lever en andere weefsels in vivo mogelijk maakt. |
Tabel 2. Lijst van veelgebruikte AAV-serotypes
AAVPrime™ AAV-deeltjes hebben de volgende kenmerken die hen zeer bruikbaar maken voor DNA-toediening:
- Hoge titers. Titer van gezuiverde deeltjes kan oplopen tot 10^14 GC/ml (genoomkopieën/ml)
- Veelzijdig. Meerdere serotypes maken gebruik in een brede of beperkte reeks van gastheercellen mogelijk
- Lage toxiciteit. Integreert niet in het gastheergenoom.
- Lage immunogeniciteit. Minimale immuunrespons van de gastheer.
- Veilig. Niet geassocieerd met enige menselijke ziekte
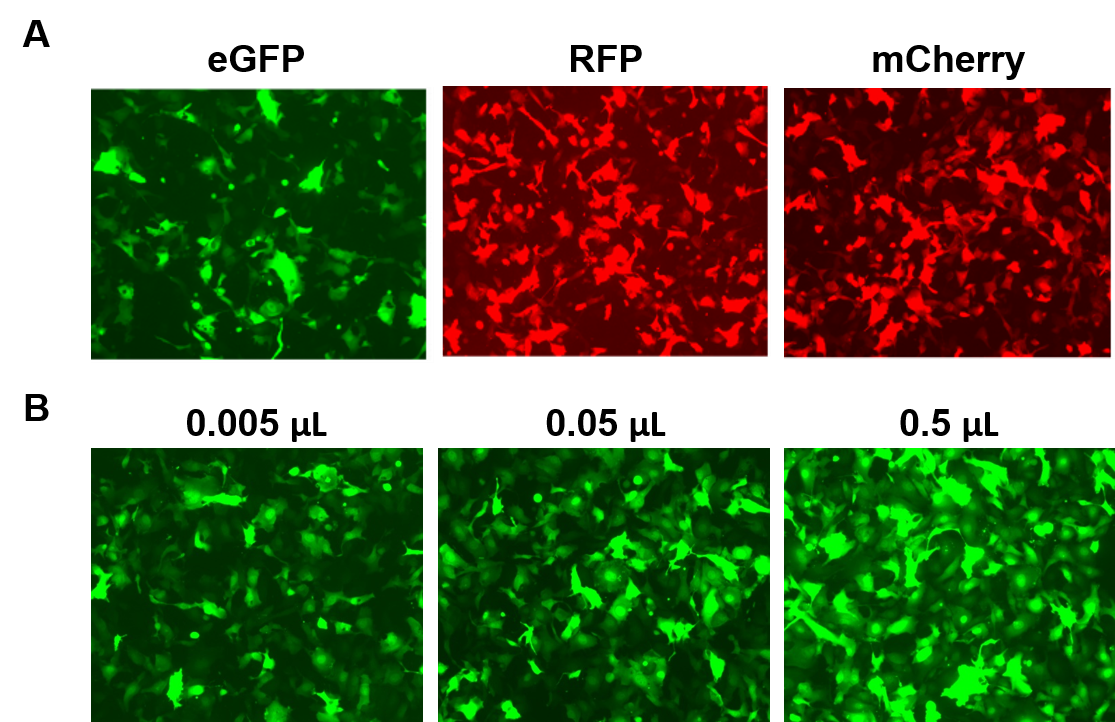
AAVPrime™-deeltjes zijn beschikbaar voor menselijke en muis ORF’s tot 3 kb, in meerdere serotypen en promotoropties, in standaardzuiverheid (alleen voor in-vitrogebruik) of gezuiverd (voor in-vivo-gebruik). Klanten kunnen plasmidenklonen bestellen, op maat gemaakte deeltjes voor interessante genen, of kiezen uit vooraf gemaakte opties die genen tot expressie brengen, zoals fluorescerende reporters (afbeelding 4).
|
Figuur 4. Prestaties van AAVPrime™-deeltjes van GeneCopoeia. A. HT1080-cellen in 24-wells-platen getransduceerd met 0,5 µL AAV van standaardzuiverheid dat versterkt GFP (eGFP), rood fluorescerend eiwit (RFP) en monomere Cherry (mCherry) uitdrukt. B. HT1080-cellen in 24-wells platen werden getransduceerd met variërende hoeveelheden gezuiverd AAV dat eGFP tot expressie brengt. De cellen werden gevisualiseerd met een fluorescentiemicroscoop (belichtingstijd: 400 ms). |
|
Wat moet ik kiezen: Lentivirus of AAV?
De keuze tussen lentivirus en AAV hangt af van vele factoren. Zo kan het feit dat lentivirussen in het genoom integreren zowel een voordeel als een nadeel zijn, afhankelijk van wat uw behoeften zijn. Raadpleeg de onderstaande tabel om u te helpen beslissen:
| Grote inserts | Stabiele integratie | Geen integratie | Cel-/weefselspecificiteit | in vivo veiligheid | |
| Lentivirus | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Om meer te weten te komen over GeneCopoeia’s virale systemen en om te bestellen, bezoek onze website (https://www.genecopoeia.com/product/lentiviral-system/)
Conclusies
Bij GeneCopoeia, streven wij ernaar u te voorzien van de hoogste kwaliteit, cutting edge-technologie in producten voor Functionele Genomica en Celbiologie. Wij bieden een breed scala aan producten, van genoom-brede sets van plasmide DNA-klonen voor ORF’s, gen promotors, miRNA’s, shRNA, en CRISPR, tot krachtige kits en reagentia, tot producten voor fluorescerende celstructuur sondes, nucleïnezuur kwantificatie, en gelabelde antilichamen. Voor meer informatie kunt u onze website bezoeken, www.genecopoeia.com, of contact met ons opnemen via [email protected].
DeKelver, et al. (2010). Functional genomics, proteomics, and regulatory DNA analysis in isogenic settings using zinc finger nuclease-driven transgenesis into a safe harbor locus in the human genome. Genome Res 20, 1133.
Dull, et al. (1998). Een derde generatie Lentivirus Vector met een conditioneel packaging systeem. J. Virol. 72, 8463.
Ran, et al. (2015). In vivo genoom editing met behulp van Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentivirale vectoren: van fundamenteel tot translationeel. Biochem. J. 443, 603.
Samulski en Muzyczka (2014). AAV-gemedieerde gentherapie voor onderzoek en therapeutische doeleinden. Annu. Rev. Virol. 1, 427.