Introduction
Rheumatoïde artritis (RA) is een auto-immuunziekte, polygeen van aard, gekenmerkt door polyartritis met systemische manifestaties en een verhoogde en ernstige morbiditeit.1,2 RA treft 0,5%-1% van de bevolking en veroorzaakt een vermindering van de levenskwaliteit, aanzienlijke fysieke invaliditeit en een aanzienlijke economische kost.3-6 De klinische expressie van de ziekte is gevarieerd, gaande van milde zelflimiterende vormen tot een zeer agressieve, snelle evolutie die culmineert in de vernietiging van het aangetaste gewricht en de daaruit voortvloeiende invaliditeit.7
De pathogenese van RA is complex en betrekt verschillende celpopulaties betrokken bij de aangeboren en adaptieve immuunrespons. Residente cellen in het synovium, zoals fibroblastische synoviocyten B of macrofagen van de intima, en ontstekingscellen uit het bloed als T lymfocyten, B lymfocyten en monocyten9 zijn betrokken bij de pathogenese. Zij dragen allen bij tot de agressieve transformatie van het synoviocyten-B fenotype en de ontwikkeling van een intens ontstekingsinfiltraat met als eindresultaat vernietiging van kraakbeen en subchondrale botten10,11 (Fig. 1).
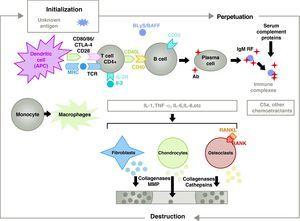
Pathofysiologie van reumatoïde artritis. Algemene pathofysiologische organisatie van reumatoïde artritis. AC, antilichaam; BAFF, B cel activerende factor; BLyS, B lymfocyten stimulator; CD, cluster van differentiatie; CPA, antigeen-presenterende cel; CPH, MHC; CTLA4, lymfocyten-geassocieerd antigeen 4 T cytotoxische C5a fractie complement 5a, FR, reumafactor; Ig, immunoglobuline; IL, interleukine; MMP, matrixmetalloproteïnasen; RANK, receptor-activator van de kernfactor B kappa; RANKL, receptor-activator-ligand voor de kernfactor B kappa; RCT, T-celreceptor; TNF, tumornecrosefactor.
De huidige behandeling van RA is gebaseerd op de toediening van ziekteveranderende antirheumatische geneesmiddelen (DMARD’s) die alleen of in combinatie worden gebruikt.12 Deze geneesmiddelen vertragen de gewrichtsvernietiging, d.w.z. zij zijn in staat het natuurlijke beloop van de ziekte te wijzigen.4,13 Het percentage patiënten met een bevredigende klinische respons is echter laag en vaak is bij een hoog percentage van de patiënten de toevoeging van een biologisch geneesmiddel nodig.9,13-15
De laatste jaren zijn nieuwe moleculen en therapeutische doelen geïdentificeerd waarvan de blokkade de chronische ontstekingsreactie zou kunnen verminderen of elimineren. Een van deze nieuwe moleculen is abatacept. Abatacept is een volledig gehumaniseerd eiwitconstruct, bestaande uit het extracellulaire domein van menselijk cytotoxisch T-lymfocyten-geassocieerd antigeen 4 (CTL4) en een genetisch gemanipuleerd fragment van de Fc-regio van menselijke immunoglobuline G1 (IgG1), dat de costimulatie T-cellen remt die inwerken op de ware kern van de immuunrespons en dus bij het begin van de ziekte.
T-celactivering
Effectieve immuunactivering van T-cellen vereist de medewerking van twee groepen membraanreceptoren op antigeenpresenterende cellen (APC)14 (Fig. 1 en 2). De eerste is het medium dat door APC’s wordt gebruikt om het eerder verwerkte specifieke antigeen aan de T-cel te leveren. Ondanks de enorme inspanning die aan dit onderzoek is gewijd, zijn we er nog steeds niet in geslaagd de artritogene antigenen te identificeren die RA uitlokken.8 De presentatie door APC’s van een antigeen waartegen een specifieke immuunrespons wordt opgewekt, wordt georganiseerd door een trimoleculair complex dat bestaat uit: moleculen van het major histocompatibility complex (MHC) aanwezig in het APC, het antigeen waartegen de immuunrespons zich ontwikkelt en een membraanreceptor op de T-cel (TCR) specifiek voor dat antigeen15 (signaal- of signaleringsroute van de immuunrespons 1).
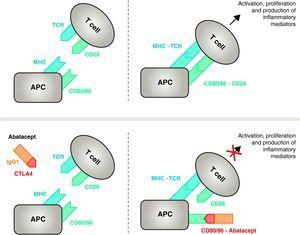
Werkingsmechanisme van abatacept. Het abatacept-fragment dat het extracellulaire domein van CTLA4 bevat, bindt aan CD80/CD86-receptoren, waardoor de interactie met de CD28-receptor wordt verhinderd of verdrongen. Aldus blokkeert het selectief de specifieke binding van CD80/CD86 aan de CD28-receptor, hetgeen pathofysiologisch een blokkering van het tweede signaal voor immuunactivering is en derhalve activering van T-cellen CPA, antigeen-presenterende cel; MHC, major histocompatibility complex; TCR, T-celreceptor.
Om volledige activering te verhinderen, hebben T-cellen een tweede set van intercellulaire communicatie-receptoren tussen APC’s en T-cellen nodig die plaatsvindt via costimulatoire pathways en de zogenaamde 2-signaal immuunrespons vormt.14 Hoewel er verschillende costimulatoire pathways bestaan, is er één essentieel, namelijk de binding van de receptoren CD80 (B7-1)/CD86 (B7-2) op het membraan van de APC met de CD28 receptor op T-cellen.10,16 Gelijktijdige activatie van beide triggert intense intracellulaire signalering in T-cellen, die essentieel is voor volledige activatie, proliferatie, overleving en cytokineproductie.8. 24-48 uur na de activering van T-lymfocyten initieert dezelfde intracellulaire signalering een reguleringsmechanisme dat erop gericht is de respons zelf te deactiveren. Dit induceert de expressie van CTLA411 op het celmembraan van de lymfocyt met de taak te concurreren met CD28 vanwege zijn grotere bindingsaffiniteit met CD80/CD86.17,18
De activering van beide T-celsubsets, CD4+ en CD8+ hangt af van de CD28 costimulatoire receptor. CD4+ T-cellen zijn helper-T-cellen. Zij herkennen de peptiden die worden aangeboden door MHC klasse II moleculen die aanwezig zijn op het APC. Deze antigenen zijn afkomstig van de exogene route die pathogenen zoals bacteriën verwerkt. Veel auto-immuunziekten worden geassocieerd met een pathologische respons van CD4+ T-cellen. CD8+ T-cellen van hun kant zijn cytotoxische lymfocyten (CTL). CD8+ T-cellen herkennen antigenen, voornamelijk virale en tumorale, die worden gepresenteerd door klasse I moleculen MHC. Bij activering bemiddelen CD8+ cellen bij de vernietiging van doelcellen door de productie van perforine, granzymes en interferon (IFN)-g. Beide subtypes T-cellen worden geactiveerd door costimulatie met CD2815, hoewel de activering van CD8+ T-cellen minder afhankelijk is van deze costimulatieroute. Terwijl alle CD4+ cellen CD28 op hun membraan tot expressie brengen, gebeurt dit slechts bij ongeveer 50% van de CD8+.19 Bovendien is aangetoond dat CD4+ cellen een grotere respons vertonen op binding met CD2820. Bovendien is de CD28 promoter geen absolute vereiste voor activatie van CTL.21 Dit alles zou in de klinische praktijk een dubbel therapeutisch voordeel opleveren. Enerzijds werkt abatacept preferentieel op de doelcel in de pathogenese van de ziekte. Bovendien zou de verminderde werking op de activiteit van CD8+ lymfocyten zorgen voor een beter veiligheidsprofiel in termen van virale en tumorale complicaties.
Activering van CD4+ T-cellen is het startpunt van een pro-inflammatoire cascade met productie van grote hoeveelheden cytokinen en celproliferatie die, indien zij wordt bestendigd en gehandhaafd, zoals bij RA, leidt tot een zeer actieve chronische ontsteking, die in staat is de weefsels waarin zij wordt uitgelokt te vernietigen, meestal de gewrichten in het geval van RA8 (Fig. 1). Het synovium begint te woekeren door infiltrerende cellen uit het bloed, waaronder T-lymfocyten zelf en hun subtypes, alsook B-lymfocyten. De monocyten differentiëren zich tot macrofagen en osteoclasten en activeren ook de articulaire chondrocyten. In deze omgeving zijn er grote hoeveelheden proinflammatoire cytokines zoals interleukine (IL)-1, IL-6 en tumornecrosefactor (TNF) en vele andere. B-cellen produceren ook auto-antilichamen zoals reumafactor of anticitrullinepeptide-antilichamen. Al deze stoffen leiden niet alleen tot de vernietiging van het synoviale membraan, maar ook van het onderliggende bot en kraakbeen.22
Biotechnologie in de behandeling van reumatoïde artritis
Omwille van het hierboven vermelde onderzoek is de biotechnologische productie van verschillende moleculen, gericht op het blokkeren van specifieke doelwitten, ontwikkeld en gecommercialiseerd. De eerste generatie werd gekenmerkt door het verschijnen van TNF-neutraliserende geneesmiddelen: etanercept, infliximab en adalimumab en anakinra, die de werking van IL-1 afremmen. Vervolgens zijn nieuwe moleculen op de markt gekomen, zoals abatacept, om de costimulatie van de immuunrespons te moduleren, certolizumab en golimumab om TNF te blokkeren, rituximab tegen de CD20-receptor van B-lymfocyten, en tocilizumab dat IL-6 blokkeert.7,23-26
Ondanks de enorme sprong voorwaarts in termen van therapeutische werkzaamheid als gevolg van de introductie van deze geneesmiddelen, reageert een aanzienlijk percentage patiënten, naar schatting tussen 25% en 40%, niet op de thans op de markt gebrachte geneesmiddelen of biologicals of ondervindt bijwerkingen.27-32 De noodzaak om deze situatie te verbeteren blijft een stimulans voor het nastreven en ontwikkelen van nieuwe moleculen die gericht zijn op het reguleren van verschillende therapeutische doelwitten die de therapeutische werkzaamheid zouden kunnen verbeteren, zoals het geval is met abatacept, dat selectief de activering van T-cellen moduleert.33
Abatacept is een eiwitconstruct dat door middel van recombinant-DNA-technologie in hamster-ovariumcellen wordt geproduceerd.34,35 Deze molecule werd ontworpen om te interfereren met de regulatie van costimulatoire routes in T-cellen, die een belangrijke rol spelen in de pathogenese van verschillende auto-immuunziekten, infecties, afstoting van getransplanteerde organen en tumorimmuniteit.36
Abatacept wordt gebruikt in combinatie met methotrexaat bij RA-patiënten bij wie een inadequate reactie of intolerantie op andere DMARD’s is opgetreden, waaronder methotrexaat (MTX) of een remmer van TNF-alfa. Bij polyarticulaire juveniele idiopathische artritis is het geïndiceerd bij patiënten van 6 jaar of ouder bij wie de respons op andere DMARD’s onvoldoende is geweest, waaronder ten minste één TNF-neutraliserend geneesmiddel.35
Werkingsmechanisme van abatacept
Abatacept is een selectieve modulator van het CD80/86-CD28 costimulatoir signaal, en zoals eerder besproken is dit essentieel voor activering van T-cellen Abatacept remt T-celactivering door selectieve blokkering van de specifieke binding van de CD80/CD86-receptor in APC aan CD28 op T-cel (Fig. 2).22,37 De farmacologische strategie is erop gericht de versnelde immuun/inflammatoire respons, kenmerkend voor de ziekte, te remmen en de normale homeostase in het immuunsysteem te herstellen. In feite is de concurrentie tussen endogeen CD28 en CTLA4 voor binding aan CD80/86 het fysiologische mechanisme dat wordt gebruikt om een normale immuunrespons te reguleren en, waar nodig, te beëindigen. Door de binding van CD80/86 aan CD28 te blokkeren, remt abatacept de overdracht van een tweede signaal van de immuunrespons, dat indirect een negatief signaal op T-celactivering produceert. Bovendien heeft abatacept waarschijnlijk een groter effect op het voorkomen van de vorming van een costimulatoir signaal in T-cellen, door de reeds actieve cellen te inactiveren, die niet gebonden zijn aan T-cel CTLA4
Ondersteunend geneesmiddel voor gebruik
1. Waarom is abatacept opgenomen in de groep van immunomodulerende geneesmiddelen? In de grond omdat het celdepletie teweegbrengt, vooral van T-cellen als gevolg van de farmacologische werking die wordt uitgeoefend door niet selectief een bepaald cytokine te blokkeren, waardoor de radicale onderdrukking van essentiële pathways voor een goede werking van de immuunrespons wordt vermeden.8
2. Hoe voorkomt het de binding van de Fc-regio van het molecuul aan zijn receptor? De Fc-regio van abatacept is genetisch gemodificeerd, zodat deze zich niet bindt aan CD16- en CD32-receptoren, en wel in zeer geringe mate aan de CD64-receptor. Dit ontwerp omzeilt cellulaire reacties die door de Fc-receptor worden gemedieerd, zoals antilichaam-afhankelijke cellulaire cytotoxiciteit (ADCC) en complement-afhankelijke cytotoxiciteit (CDC).18 Beide worden geassocieerd met cellysis, met potentiële nadelige effecten die kunnen worden waargenomen bij prolonged38 behandelingen. Daarom lijkt het gemodificeerde fragment van IgG1 actief te zijn, waardoor bijwerkingen als gevolg van de ADCC worden voorkomen.39
3. Anti-inflammatoir effect van abatacept. Abatacept vermindert aanzienlijk veel van de ontstekingsmediatoren bij patiënten met RA en herstelt ze tot normaal, een feit dat werd aangetoond in verschillende klinische proeven die werden gebruikt bij het onderzoek naar het geneesmiddel.
In een fase II-b, 1 jaar durende, placebo-gecontroleerde studie bij patiënten met RA en inadequate respons op MTX, werden monsters genomen en serumspiegels van geselecteerde markers gemeten in de dagen vóór de infusie om het effect van abatacept op mediatoren en pro-inflammatoire cytokinen te bestuderen. Een groep patiënten kreeg MTX en abatacept 10mg/kg, volgens een regelmatig schema. De controlegroep werd daarentegen behandeld met MTX en placebo. Een jaar na de behandeling waren de markers in de abatacept groep van 10mg/kg genormaliseerd, terwijl ze in de placebogroep verhoogd bleven (TNF: 7,4 vs 10,3pg/ml; FR: 159 vs 225U/l, sIL-2R: vs 1228,3. 1697,1pg/ml IL-6: 7,3 vs 19,9pg/ml).40
4. Immunogeniciteit. Volgens gegevens over het geneesmiddel ontwikkelden slechts 187 van 3877 (4,8%) patiënten met RA die tot 8 jaar met abatacept werden behandeld, antilichamen tegen het geneesmiddel tijdens de behandeling.41 Antilichamen tegen abatacept werden geëvalueerd bij patiënten na het stoppen van het geneesmiddel (>42 dagen na de laatste dosis), en bij 103 van 1888 (5,5%) waren ze seropositief. Daarentegen werden in een andere studie bij 2000 patiënten abatacept antilichamen gemeten en werd geconcludeerd dat abatacept een lage immunogeniciteit heeft.42,43
5. Abatacept en tuberculose. TNF neemt deel aan de ontstekingsreactie en de immunopathologie van tuberculose (TB). In vitro studies tonen aan dat TNF de fagocytische activiteit en mycobacteriedodende macrofagen verhoogt, terwijl het in vivo betrokken was bij de initiële vorming en de daaropvolgende instandhouding van granulomen, iets dat de groei van mycobacteriën controleert en de verspreiding ervan beperkt. In een chronisch model van reactivatie van latente TB bij muizen bestudeerden wij de evolutie van de infectie bij muizen die werden behandeld met abatacept in vergelijking met een andere groep die werd behandeld met een muriene monoklonale anti-TNF.42 Vier maanden nadat C57BL/6 muizen waren geïnfecteerd met Mycobacterium tuberculosis en, nadat was bevestigd dat zij een latente TB-infectie hadden, werden de muizen gedurende 16 weken behandeld met een van de twee experimentele interventies. Na deze periode stierven alle muizen die met anti-TNF werden behandeld aan gedissemineerde TB met een gemiddelde overleving van 44 dagen. Daarentegen stierf geen van de muizen behandeld met abatacept.
Terwijl de concentratie van serum IFN-g niet veranderde in de abatacept groep, was deze verhoogd bij de muizen met anti-TNF. Deze verhoging werd toegeschreven aan de verhoogde infiltratie van CD4+ en CD8+ veroorzaakt door de wijdverspreide verspreiding van de bacteriekolonies.
Dus, terwijl muizen behandeld met anti-TNF therapie 100% sterfte vertoonden, veranderde abatacept niet het vermogen van muizen om een ontstekingsreactie te organiseren die in staat is om de verspreiding van tuberculose onder controle te houden. Er zijn echter nog niet voldoende klinische gegevens om deze bevindingen bij de mens te bevestigen.
6. Antiresorptief effect van abatacept op de botopbouw. De activiteit van osteoclasten is verhoogd bij RA, zowel in het gewricht, dat boterosies veroorzaakt, als systemisch, waarbij niveaus worden bereikt die worden geassocieerd met gegeneraliseerde osteoporose.44,45
In feite is een toename van het ligand receptor activator van de nucleaire factor NF-kB (RANKL) aangetoond in het synoviale membraan.45,46 Abatacept remt dosis-afhankelijk de muriene osteoclastvorming en de osteoclastogene activiteit die in vitro is beoordeeld. Dit werd onderzocht bij murine osteoclasten gekweekt op dentineplaatjes, waarbij het aantal resorptieputjes werd gemeten na 6 dagen toevoeging van verschillende doses abatacept.47
Het geneesmiddel verminderde significant het gebied van botresorptie. Deze gegevens suggereren dat abatacept een molecule is die zich rechtstreeks bindt aan de voorlopercellen van de osteoclasten, waardoor hun differentiatie wordt geremd. Dit mechanisme zou het anti-erosieve effect van het geneesmiddel bij patiënten met RA kunnen verklaren. Patiënten behandeld met abatacept vertoonden een dalende trend in RANK en zijn ligand RANKL niveaus in het synovium, alle geassocieerd met verhoogd osteoprotegerine.48 Hoewel het exacte mechanisme dat aan deze waarneming ten grondslag ligt onduidelijk is, correleren deze bevindingen goed met radiologische verbetering waargenomen bij patiënten behandeld met abatacept.
7. Effecten van abatacept in andere immuuncellen. Hoewel de APC de doelcel is die abatacept bindt en macrofagen ook CD80/86 receptoren op hun oppervlak tot expressie brengen, zijn er weinig studies die de werking van het geneesmiddel op de activiteit van deze cellen onderzoeken. Een recente in vitro studie heeft inderdaad aangetoond dat macrofagen een duidelijke CD80/86 receptorexpressie vertoonden en dat behandeling met abatacept de cytokine49 productie aanzienlijk verminderde. Deze resultaten suggereren dat het werkingsmechanisme van het geneesmiddel zou kunnen worden uitgebreid tot de regulatie van de macrofaag, sleutelcellen in de pathogenese van de ziekte.
Abatacept onderdrukt ook de folliculaire migratie van antigeenspecifieke T-cellen en, bijgevolg, de samenwerking tussen T-cellen en folliculaire B-cellen in de lymfeklier. Deze bevinding is in situ waargenomen in lymfeklieren van BALB/c50 muizen. Na transfusie van dergelijke muizen met antigeenspecifieke voorgestimuleerde T-cellen, toonde een daaropvolgende immunisatie van muizen T-celproliferatie en migratie naar het B-lymfocytengebied. In muizen behandeld met abatacept, werd de T cel proliferatie en migratie geblokkeerd, waardoor de aanwezigheid in de meeste gevallen in de lymfeklier paracortex werd beperkt. Langdurige behandeling met abatacept vermindert dus de proliferatie, mobiliteit en distributie van intraganglionaire auto-antigeen geheugenlymfocyten, wat zou kunnen leiden tot de afname van auto-antilichamen.
Conclusies over het werkingsmechanisme van Abatacept
Abatacept is een volledig gehumaniseerd eiwitconstruct, bestaande uit het extracellulaire domein van humaan cytotoxisch T-lymfocyten-geassocieerd antigeen 4 (CTL4) en een genetisch gemodificeerd fragment van de Fc-regio van IgG1, Het geneesmiddel remt de activering van T-cellen door selectief de specifieke binding van CD80/CD86 aan de CD28-receptor te blokkeren en daardoor de T-celproliferatie en de immuunrespons van B-lymfocyten te remmen Deze farmacologische werking resulteert in verlaagde niveaus van ontstekingsmediatoren bij patiënten met RA en in een veilige en effectieve klinische respons.
Belangenverstrengeling
Dr. Gabriel Herrero-Beaumont heeft onderzoekssubsidies ontvangen van Bristol-Myers-Squibb. Dr. Santos Castañeda heeft onderwijs- en onderzoekssubsidies ontvangen van Abbott, MSD en Pfizer.