A: Definiowanie stałej kwasowości
Na pewno wiesz, że niektóre kwasy są silniejsze niż inne. Względna kwasowość różnych związków lub grup funkcyjnych – innymi słowy, ich względna zdolność do oddawania protonu do wspólnej zasady w identycznych warunkach – jest określana ilościowo przez liczbę zwaną stałą kwasowości, oznaczaną skrótem Ka. Jako wspólną zasadę do porównania wybrano wodę.
Jako pierwszy przykład rozważymy kwas octowy. Jeżeli sporządzimy rozcieńczony roztwór kwasu octowego w wodzie, to między kwasem (donorem protonu) a wodą (akceptorem protonu) zachodzi reakcja kwasowo-zasadowa.
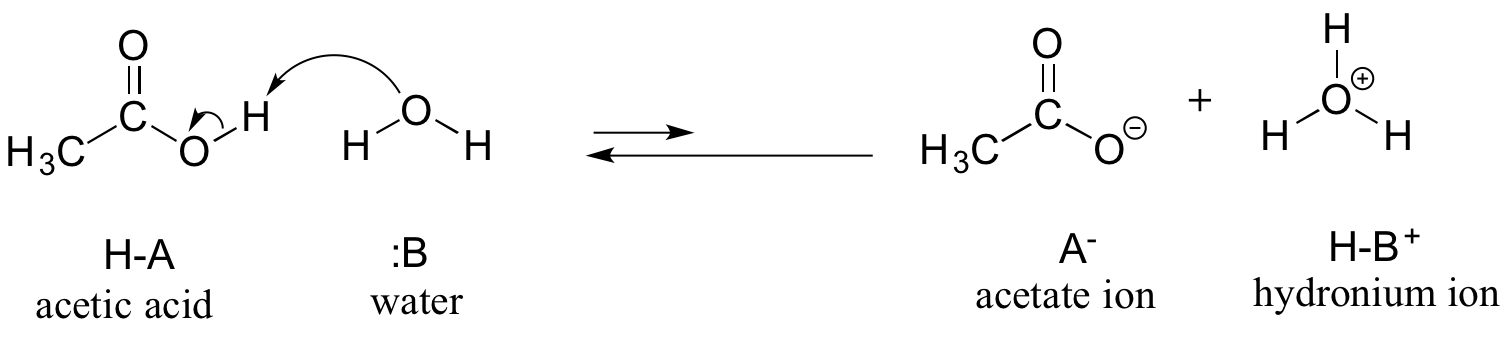
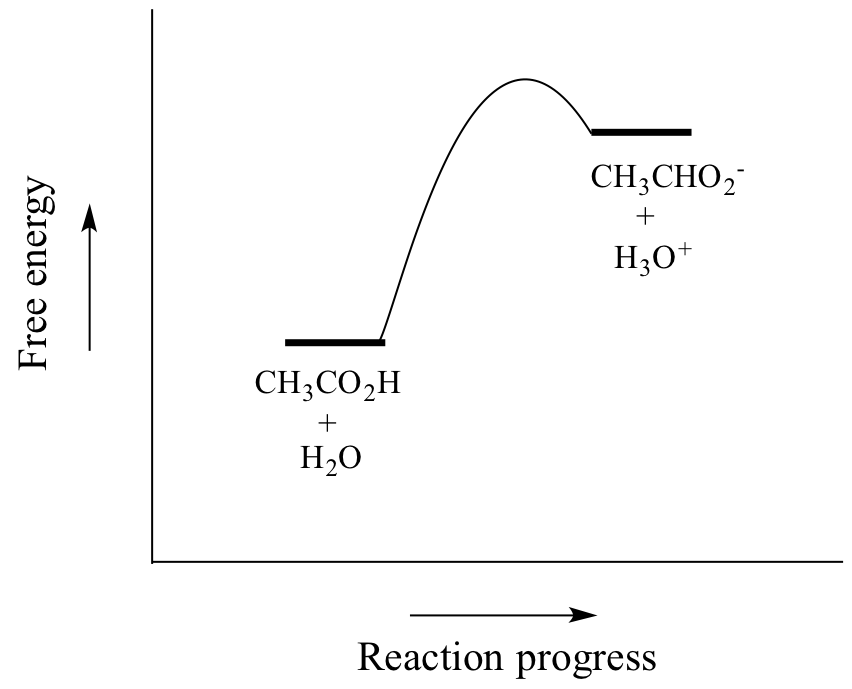
Kwas octowy jest słabym kwasem, więc równowaga faworyzuje reaktantów w stosunku do produktów – jest termodynamicznie „pod górkę”, na co wskazuje powyższy rysunek poprzez względną długość strzałek reakcji w przód i w tył oraz poniższy wykres współrzędnych reakcji, na którym produkty mają wyższą energię niż reaktanci.
Jak wiadomo, stała równowagi Keq jest zdefiniowana jako:
![]()
Każde wyrażenie stałej równowagi jest w rzeczywistości stosunkiem aktywności wszystkich gatunków biorących udział w reakcji. Aby uniknąć stosowania aktywności i uprościć pomiary doświadczalne, stała równowagi stężenia przybliża aktywności solutów i gazów w rozcieńczonych roztworach za pomocą ich odpowiednich molarności. Jednakże, aktywności ciał stałych, czystych cieczy i rozpuszczalników nie są przybliżone ich molami. Zamiast tego te aktywności są zdefiniowane jako mające wartość równą 1 (jeden).
Tak więc, jeśli uznamy, że aktywność wody w rozcieńczonym roztworze jest przybliżona wartością jedności (1), możemy podzielić przez 1, aby uzyskać wspólną formę wyrażenia dla Ka, stałej kwasowej dla kwasu octowego:
}{(1)} = dfrac{}. \]
W rzeczywistości, dla rozcieńczonego roztworu wodnego, aktywność wody jest przybliżona wartością 1, więc ogólna stała dysocjacji dla danego kwasu HA lub HB+ jest wyrażona jako:
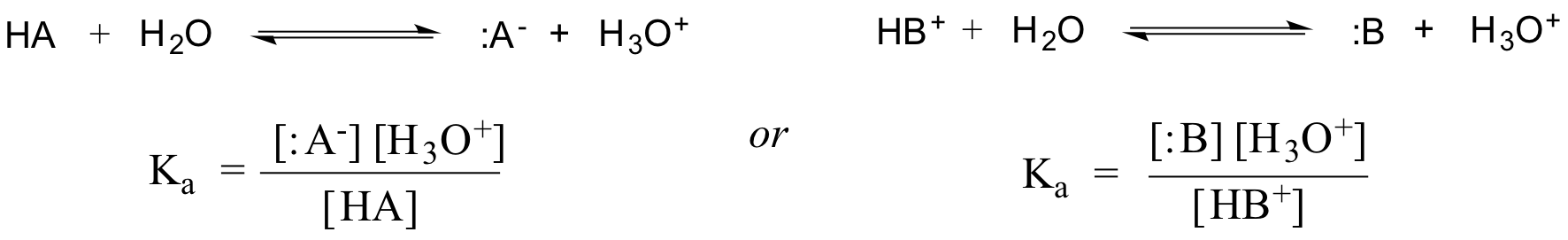
Wartość Ka dla kwasu octowego wynosi 1.75 x 10-5 – znacznie mniej niż 1, co wskazuje, że w stanie równowagi w roztworze jest znacznie więcej kwasu octowego niż jonów octanowych i hydroniowych.
Odwrotnie, kwas siarkowy, z Ka około 109, lub kwas solny, z Ka około 107, oba ulegają zasadniczo całkowitej dysocjacji w wodzie: są to bardzo silne kwasy.
Liczba taka jak 1.75 x 10- 5 nie jest bardzo łatwa do powiedzenia, zapamiętania lub wizualizacji, więc chemicy zazwyczaj używają wygodniejszego terminu do wyrażenia względnej kwasowości. Wartość pKa kwasu jest po prostu log (podstawa 10) z jego wartości Ka.
pKa = -log Ka Ka = 10-pKa
Do matematyki, możemy znaleźć, że pKa kwasu octowego jest 4,8. Wartość pKa kwasu siarkowego wynosi -10, a kwasu solnego -7. Zastosowanie wartości pKa pozwala nam wyrazić względną kwasowość powszechnych związków i grup funkcyjnych w skali liczbowej od około -10 (dla bardzo silnego kwasu) do 50 (dla związku, który w ogóle nie jest kwaśny). Im niższa wartość pKa, tym silniejszy kwas.
Jonizowalne (oddające lub przyjmujące proton) grupy funkcyjne istotne dla biologicznej chemii organicznej zazwyczaj mają wartości pKa w zakresie od około 5 do około 20. Najważniejsze z nich są podsumowane poniżej, z bardzo przybliżonymi wartościami pKa dla form kwasów sprzężonych. Bardziej kwaśne grupy o wartościach pKa bliskich zeru są również uwzględnione w celach referencyjnych.
Przybliżone wartości pKa, które warto znać
jon hydroniowy (H3O+) : 0
protonowany alkohol: 0
protonowany karbonyl: 0
kwasy karboksylowe: 5
protonowane iminy: 7
protonowane aminy: 10
fenole: 10
tiole: 10
woda: 14
alkohole: 15-18
kwasy alfa-węglowe*: 20
*kwasy alfa-węglowe zostaną omówione w dalszej części tego rozdziału
Zaleca się, abyś teraz zapamiętał te przybliżone wartości – potem, jeśli będziesz potrzebował bardziej precyzyjnej wartości, zawsze możesz sprawdzić ją w tabeli pKa.
Uwaga! pKa to nie to samo co pH!
Ważne jest, aby zdać sobie sprawę, że pKa to nie to samo co pH: to pierwsze jest nieodłączną właściwością związku lub grupy funkcyjnej, podczas gdy to drugie jest miarą stężenia jonów hydroniowych w danym roztworze wodnym:
pH = -log
Znajomość wartości pKa nie tylko pozwala nam porównywać siłę kwasów, ale również siłę zasad. Kluczową ideą do zapamiętania jest to: im silniejszy sprzężony kwas, tym słabsza sprzężona zasada. Możemy stwierdzić, że jon wodorotlenkowy jest silniejszą zasadą niż amoniak (NH3), ponieważ jon amonowy (NH4+, pKa = 9,2) jest silniejszym kwasem niż woda (pKa = 14,0).
Ćwiczenie 7.2.1
Która zasada jest silniejsza, CH3O- czy CH3S-? Jon octanowy czy amoniak? Jon wodorotlenkowy czy jon octanowy?
Roztwór
Postarajmy się wykorzystać nasze rozumienie pojęcia pKa w kontekście bardziej złożonych cząsteczek. Na przykład, jakie jest pKa poniższego związku?
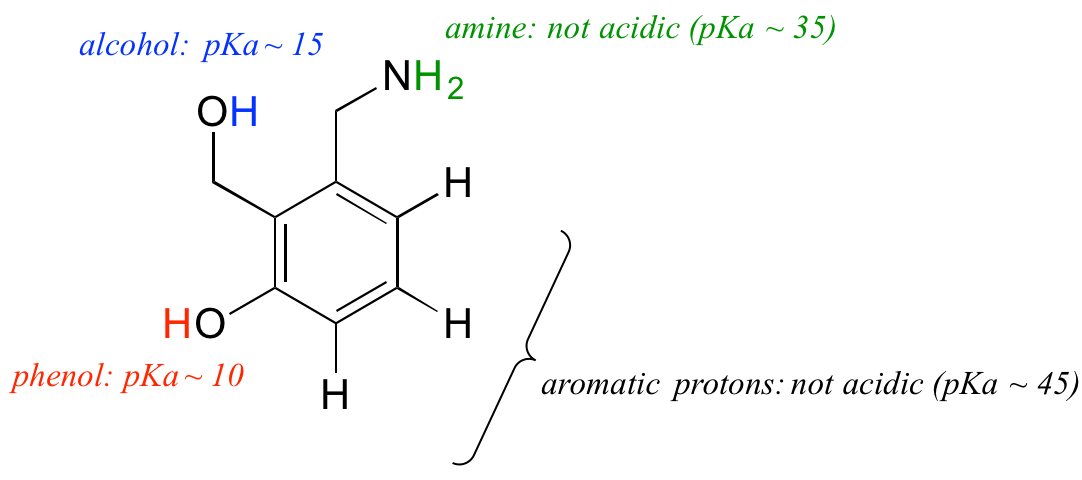
Musimy ocenić potencjalną kwasowość czterech różnych typów protonów w cząsteczce i znaleźć ten najbardziej kwasowy. Protony aromatyczne nie wszystkie są kwaśne – ich pKa wynosi około 45. Grupa aminowa również nie jest kwaśna, jej pKa wynosi około 35. (Należy pamiętać, że nienaładowane aminy są zasadowe: słabo kwaśne są dodatnio naładowane protonowane aminy, o wartościach pKa około 10). Proton alkoholu ma pKa około 15, a proton fenolu ma pKa około 10: tak więc najbardziej kwaśną grupą w powyższej cząsteczce jest fenol (upewnij się, że potrafisz rozpoznać różnicę między fenolem a alkoholem – pamiętaj, że w fenolu grupa OH jest związana bezpośrednio z pierścieniem aromatycznym). Jeśli ta cząsteczka miałaby reagować z jednym molowym równoważnikiem silnej zasady, takiej jak wodorotlenek sodu, to właśnie proton fenolu zostałby oddany, tworząc anion fenolanowy.
Ćwiczenie 7.2.2
Zidentyfikuj najbardziej kwaśną grupę funkcyjną na każdej z poniższych cząsteczek i podaj jej przybliżone pKa.

Roztwór
.