Definicja Brønsteda-Lowry’ego kwasowości i zasadowości
Zaczniemy naszą dyskusję na temat chemii kwasowo-zasadowej z kilkoma istotnymi definicjami. Pierwsza z nich została zaproponowana w 1923 roku przez duńskiego chemika Johannesa Brønsteda i angielskiego chemika Thomasa Lowry’ego i stała się znana jako definicja kwasowości i zasadowości Brønsteda-Lowry’ego. Zgodnie z definicją Brønsteda-Lowry’ego kwas to gatunek, który działa jako donor protonów, podczas gdy zasada jest akceptorem protonów. W poprzednim rozdziale omówiliśmy już jeden z najbardziej znanych przykładów reakcji kwasowo-zasadowej Brønsteda-Lowry’ego, pomiędzy kwasem chlorowodorowym a jonem wodorotlenkowym:
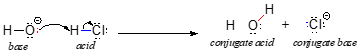
W tej reakcji proton jest przenoszony z HCl (kwas, czyli dawca protonu) na jon wodorotlenkowy (zasada, czyli akceptor protonu). Jak dowiedzieliśmy się w poprzednim rozdziale, zakrzywione strzałki przedstawiają ruch elektronów w tym procesie rozbijania i tworzenia wiązań.
Po tym jak kwas Brønsteda-Lowry’ego oddaje proton, to co pozostaje nazywane jest zasadą sprzężoną. Jon chlorkowy jest więc zasadą sprzężoną z kwasem solnym. I odwrotnie, kiedy zasada Brønsteda-Lowry’ego przyjmuje proton, przekształca się w swoją sprzężoną formę kwasową: woda jest więc sprzężonym kwasem jonu wodorotlenkowego.
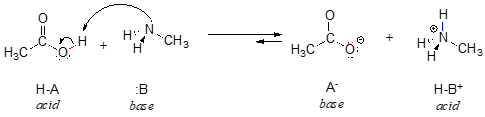
Oto reakcja kwasowo-zasadowa pomiędzy kwasem octowym a metyloaminą:
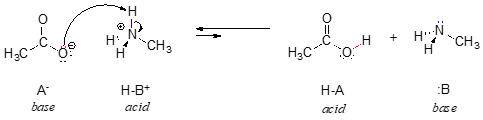
W odwrotnej reakcji jon octanowy jest zasadą, a jon metyloamoniowy (protonowana metyloamina) jest kwasem.
Co sprawia, że związek jest kwaśny (może oddać proton) lub zasadowy (może przyjąć proton)? Odpowiedź na to pytanie jest jednym z naszych głównych zadań w tym rozdziale i będzie wymagała od nas wykorzystania wielu z tego, czego nauczyliśmy się o strukturze organicznej w pierwszych dwóch rozdziałach, jak również idei termodynamiki, które przejrzeliśmy w rozdziale 6.
Na razie rozważmy tylko jedną wspólną właściwość zasad: aby działać jako zasada, cząsteczka musi mieć reaktywną parę elektronów. We wszystkich reakcjach kwasowo-zasadowych, które zobaczymy w tym rozdziale, składnik zasadowy posiada atom z samotną parą elektronów. Kiedy metyloamina działa jako zasada, na przykład, samotna para elektronów na atomie azotu jest używana do utworzenia nowego wiązania z protonem.
Jasne, jon metyloamoniowy nie może działać jako zasada – nie posiada reaktywnej pary elektronów, za pomocą której mógłby przyjąć proton.
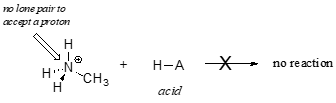
Później, w rozdziale 14, będziemy badać reakcje, w których para elektronów w wiązaniu alkenu lub pierścienia aromatycznego działa w sposób zasadowy – ale na razie skoncentrujemy się na zasadowości elektronów niewiążących się (samotnych par).
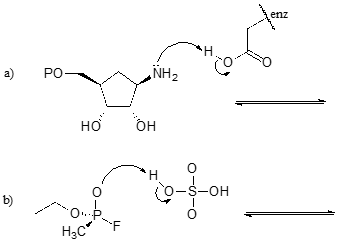
Ćwiczenie
Dokończ poniższe reakcje – innymi słowy, narysuj struktury dla brakujących sprzężonych kwasów i sprzężonych zasad, które wynikają z podanych krzywych strzałek.