Definiowanie stałej kwasowości
Na pewno wiesz, że niektóre kwasy są mocniejsze od innych. Względna kwasowość różnych związków lub grup funkcyjnych – innymi słowy, ich względna zdolność do oddawania protonu do wspólnej zasady w identycznych warunkach – jest określana liczbą zwaną stałą kwasowości, w skrócie K_a. Jako wspólną zasadę do porównania wybrano wodę.
Jako pierwszy przykład rozważymy kwas octowy. Jeśli sporządzimy rozcieńczony roztwór kwasu octowego w wodzie, to między kwasem (donorem protonu) a wodą (akceptorem protonu) zachodzi reakcja kwasowo-zasadowa.

Kwas octowy jest słabym kwasem, więc równowaga faworyzuje reagenty w stosunku do produktów – jest termodynamicznie „pod górkę”. Na powyższym rysunku wskazuje na to względna długość strzałek reakcji w przód i w tył.
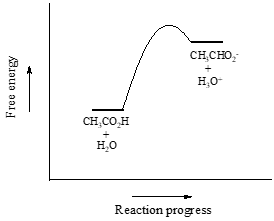
Stała równowagi \(K_{eq}}) jest zdefiniowana jako:
= \frac{}{}}}
Pamiętajmy, że jest to rozcieńczony roztwór wodny: dodaliśmy małą ilość kwasu octowego do dużej ilości wody. Dlatego w trakcie reakcji stężenie wody (około 55,6 mol/L) zmienia się w bardzo niewielkim stopniu i można je traktować jako stałą.
Jeżeli przeniesiemy człon stały dla stężenia wody na lewą stronę wyrażenia stałej równowagi, otrzymamy wyrażenie dla ∗(K_a), stałej kwasowej dla kwasu octowego:
= \frac{}{}]
W bardziej ogólnym ujęciu, stała dysocjacji dla danego kwasu HA lub HB+ wyraża się jako:
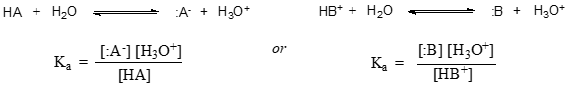
Wartość \(K_a\) dla kwasu octowego wynosi.75 razy 10^{-5}}) – znacznie mniej niż \(1\), co wskazuje, że w stanie równowagi w roztworze jest znacznie więcej kwasu octowego niż jonów octanowych i wodorowych.
Odwrotnie, kwas siarkowy, z \(K_a\) około \(10^9\), lub kwas chlorowodorowy, z \(K_a\) około \(10^7\), oba ulegają zasadniczo całkowitej dysocjacji w wodzie: są to bardzo silne kwasy.
Liczba taka jak 1,75 razy 10^{- 5}} nie jest łatwa do wypowiedzenia, zapamiętania lub zobrazowania, więc chemicy zwykle używają wygodniejszego terminu do wyrażenia względnej kwasowości. Wartość \(pK_a\) kwasu jest po prostu logarytmem (podstawa 10) jego wartości \(K_a\).
Wykonując obliczenia, okazuje się, że \(pK_a\) kwasu octowego wynosi \(4,8\). Wartość pK kwasu siarkowego wynosi -10, a kwasu solnego -7. Użycie wartości pK pozwala nam wyrazić względną kwasowość powszechnych związków i grup funkcyjnych w skali liczbowej od około -10 (dla bardzo silnego kwasu) do 50 (dla związku, który w ogóle nie jest kwaśny). Im niższa wartość pK_a, tym mocniejszy kwas.
Jonizowalne (oddające lub przyjmujące proton) grupy funkcyjne istotne dla biologicznej chemii organicznej mają na ogół wartości pK_a w zakresie od około 5 do około 20. Najważniejsze z nich są podsumowane poniżej, z bardzo przybliżonymi wartościami \(pK_a\) dla sprzężonych form kwasowych. Bardziej kwaśne grupy z wartościami \(pK_a\) bliskimi zeru są również uwzględnione dla odniesienia.
Typowe wartości \(pK_a\)
| grupa | przybliżone \(pK_a\) |
|---|---|
| jon hydroniowy | 0 |
| protonowany alkohol | 0 |
| protonowany karbonyl | 0 |
| kwasy karboksylowe | 5 |
| protonowane iminy | 7 |
| protonowane aminy | 10 |
| fenole | 10 |
| tiole | 10 |
| alkohole, woda | 15 |
| kwasy węglowe * | 20 |
* kwasy węglowe zostaną wyjaśnione w sekcji 7.6A
Zaleca się zapamiętać te przybliżone wartości – jeśli będziesz potrzebował bardziej precyzyjnej wartości, zawsze możesz sprawdzić ją w bardziej kompletnej tabeli pK_a. Dodatek do tej książki zawiera bardziej szczegółową tabelę typowych wartości ∗(pK_a), a o wiele bardziej kompletne tabele są dostępne w źródłach takich jak Handbook of Chemistry and Physics.
∗(pK_a) vs. \(pH)
Ważne jest, aby zdać sobie sprawę, że \(pK_a\) nie jest tym samym, co \(pH\): pierwszy jest nieodłączną właściwością związku lub grupy funkcjonalnej, podczas gdy drugi jest miarą stężenia jonów hydroniowych w danym roztworze wodnym:
Znajomość wartości \(pK_a\) nie tylko pozwala nam porównywać siłę kwasów, ale również pozwala nam porównywać siłę zasad. Kluczowa myśl do zapamiętania jest następująca: im mocniejszy sprzężony kwas, tym słabsza sprzężona zasada. Możemy stwierdzić, że jon wodorotlenkowy jest silniejszą zasadą niż amoniak (NH_3), ponieważ jon amonowy (NH4^+, pK_a = 9.2)) jest silniejszym kwasem niż woda (pK_a = 15,7)).
Ćwiczenie \(\PageIndex{1})
Która zasada jest silniejsza, \(CH_3O^-\) czy \(CH_3S^-\)? Jon octanowy czy amoniak? Jon wodorotlenkowy czy jon octanowy?
Wykorzystajmy nasze zrozumienie koncepcji \(pK_a\) w kontekście bardziej złożonych cząsteczek. Na przykład, jaka jest ∗(pK_a) poniższego związku?

Musimy ocenić potencjalną kwasowość czterech różnych typów protonów w cząsteczce i znaleźć ten najbardziej kwasowy. Protony aromatyczne nie wszystkie są kwaśne – ich Ω (pK_a) wynosi około 45. Grupa aminowa również nie jest kwaśna – jej Ω (pK_a) wynosi około 35. (Należy pamiętać, że nienaładowane aminy są zasadowe: słabo kwaśne są dodatnio naładowane aminy protonowane, o wartościach Ω (pK_a) około 10). Proton alkoholu ma ≥15, a proton fenolu ≥10: tak więc najbardziej kwaśną grupą w powyższej cząsteczce jest fenol. (Upewnij się, że potrafisz rozpoznać różnicę między fenolem a alkoholem – pamiętaj, że w fenolu grupa ≥OH jest związana bezpośrednio z pierścieniem aromatycznym). Jeśli ta cząsteczka zareagowałaby z jednym molowym równoważnikiem silnej zasady, takiej jak wodorotlenek sodu, to proton fenolu zostałby oddany, tworząc anion fenolanowy.
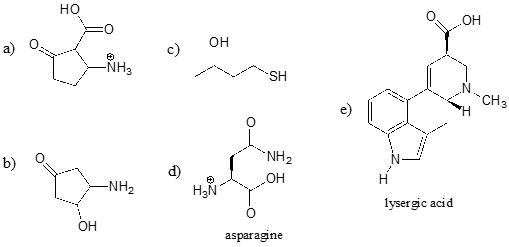
Ćwiczenie \(\)
Zidentyfikuj najbardziej kwaśną grupę funkcyjną na każdej z poniższych cząsteczek i podaj jej przybliżone \(pK_a\).