| Ed Davis, Ph.D. |
Wprowadzenie
Lentiwirusy i wirusy adeno-asocjowane (AAV) okazały się nieocenione do wprowadzania materiału genetycznego do komórek ssaków, zarówno w kulturach, jak i całych zwierząt. Oba systemy są bardzo przydatne w wielu podstawowych zastosowaniach badawczych, takich jak nadekspresja białek, produkcja przeciwciał i nokaut genów, i oba są obiecujące w terapii genowej. Jednakże, każdy system wirusowy ma swoje unikalne zalety i wady, w zależności od zastosowania. GeneCopoeia oferuje szeroką linię produktów zarówno dla lentiwirusów jak i AAV, zapewniając potężne i elastyczne opcje dostarczania DNA do komórek. W tej nocie technicznej opisujemy technologie stojące za liniami produktów Lentifect™ lentiwirusów i AAVPrime™ AAV firmy GeneCopoeia i omawiamy zalety każdej z tych technologii dla różnych zastosowań, aby pomóc Ci wybrać system najlepiej odpowiadający Twoim potrzebom.
Dlaczego warto używać wirusów do dostarczania DNA?
Jednym z najbardziej powszechnych sposobów dostarczania DNA do komórek jest transfekcja oparta na plazmidach, w której komórki są traktowane związkami chemicznymi, takimi jak fosforan wapnia, lub odczynnikami opartymi na lipidach. Jednakże, transfekcja plazmidowa nie zawsze jest pożądana lub praktyczna. Na przykład, niektóre komórki są bardzo trudne lub niemożliwe do poddania transfekcji, podczas gdy większość komórek hodowlanych jest zdolna do infekcji (zwanej również transdukcją) za pomocą lentiwirusa lub AAV. Po drugie, transfekcja plazmidowa nie może być stosowana do dostarczania DNA in vivo, ale transdukcja wirusowa może. Zarówno lentiwirusy, jak i AAV mogą być wykorzystywane do wielu zastosowań, takich jak ekspresja białek z otwartych ramek odczytu (ORF), wyłączanie genów za pomocą interferencji RNA (RNAi) mediowanej przez krótką spinkę do włosów RNA (shRNA), testy lucyferazowe i inne testy genów reporterowych oraz wyłączanie genów mediowane przez system CRISPR-Cas9 (clustered, regularly-interspaced, short palindromic repeats-Cas9). Wiele z tych zastosowań wektorów wirusowych przeprowadzono z powodzeniem w hodowlanych unieśmiertelnionych liniach komórkowych ssaków, pierwotnych hodowlach komórkowych, modelach zwierzęcych oraz w terapii genowej na ludziach.
Systemy lentiwirusowe
Termin „Lentiwirus” odnosi się do klasy retrowirusów, która obejmuje ludzkiego wirusa niedoboru odporności (HIV), i w rzeczywistości większość obecnie stosowanych systemów lentiwirusowych pochodzi od HIV (przegląd w Mátrai, et al., 2010; Sakuma, et al., 2012). Lentiwirusy niosące transgen integrują się z genomem w momencie infekcji, dzięki czemu umożliwiają stabilną ekspresję zarówno w dzielących się, jak i nie dzielących się komórkach.
Systemy lentiwirusowe zostały w dużym stopniu zmodyfikowane z HIV w ciągu kilku generacji, aby uczynić je bezpiecznymi w obsłudze i użytecznymi w zastosowaniach. GeneCopoeia używa systemu lentiwirusowego trzeciej generacji (Dull, et al. 1998), który wymaga czterech oddzielnych plazmidów do produkcji zakaźnych cząstek wirusowych (wirionów). Plazmid lentiwirusowy GeneCopoeia zawiera tylko gen zainteresowania (GOI), który ma być wyrażony, gen selekcji antybiotyków i sekwencje sygnałowe opakowania. Czasami klon zawiera również fluorescencyjny gen reporterowy. Plazmid zawierający GOI, z markerem selekcyjnym i genem reporterowym, może pomieścić inserty o wielkości do około 5-6 kb. (Rysunek 1), chociaż miana wirusów drastycznie spadają, gdy rozmiary wstawek przekraczają około 4 kb.
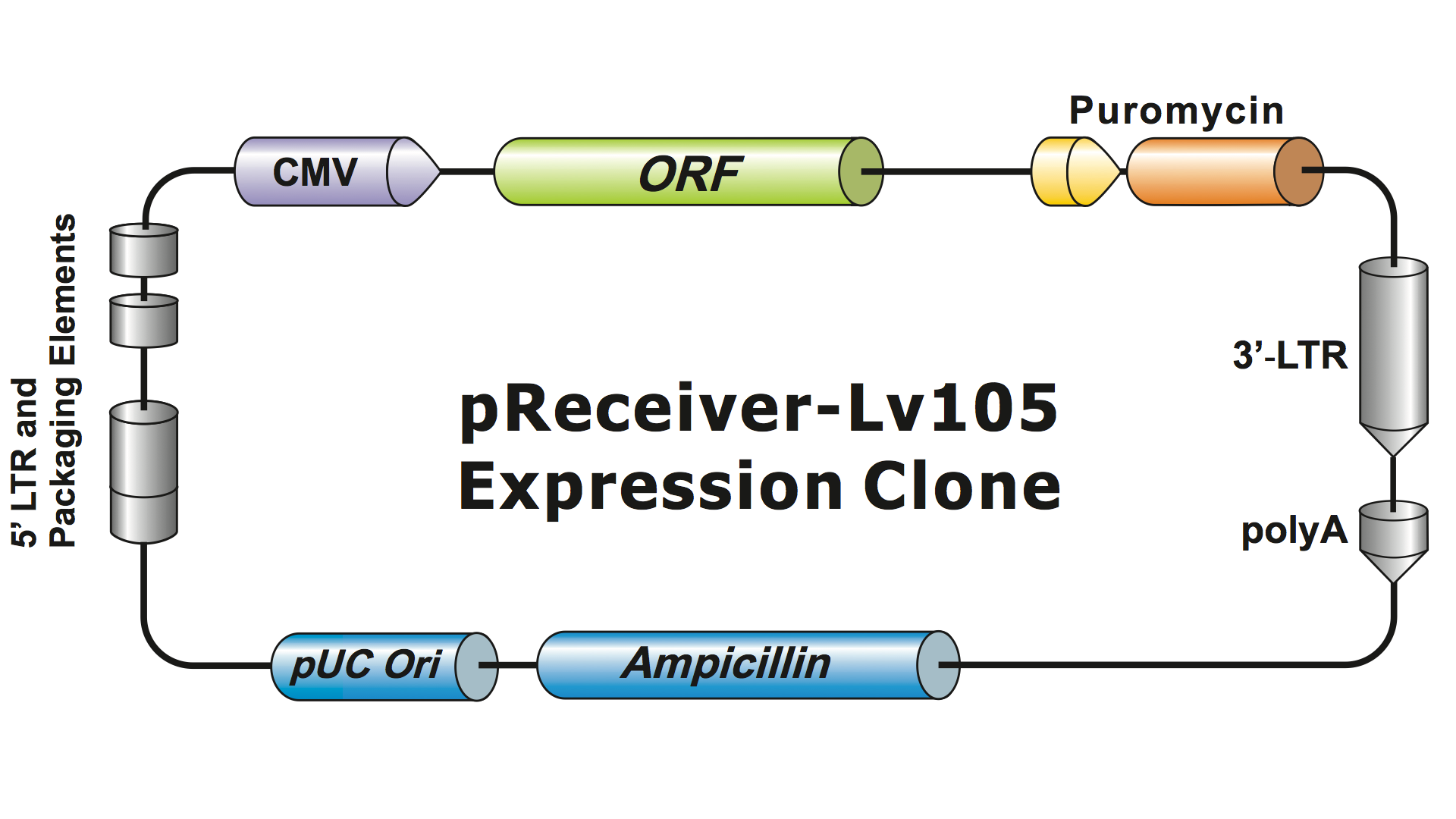 |
Rysunek 1. Przykład klonu ekspresji lentiwirusowej GeneCopoeia |
Dodatkowe plazmidy wyrażają elementy retrowirusowe potrzebne do pakowania i integracji (gag, pol, env, Rev). Gdy wszystkie cztery plazmidy ulegają ekspresji w komórkach pakujących, GOI RNA jest włączane do cząsteczek. Ponieważ białka retrowirusowe ulegają ekspresji tylko podczas pakowania, zainfekowane komórki nie mogą wytwarzać zakaźnego wirusa. Dodatkowo, cząsteczki lentiwirusowe Lentifect™ firmy GeneCopoeia zawierają delecję w regionie U3 LTR, co czyni je samo-inaktywującymi się (SIN). Delecja SIN zapobiega replikacji lentiwirusa w rzadkim przypadku, gdy wszystkie cztery plazmidy ulegną rekombinacji, tworząc jeden aktywny plazmid wirusa. Dlatego cząstki lentiwirusowe są bezpieczne w obsłudze, praktycznie bez szans na wytworzenie patogennego wirusa.
W uzupełnieniu do ulepszonych modyfikacji bezpieczeństwa, cząstki lentiwirusowe Lentifect™ firmy GeneCopoeia przenoszą glikoproteinę G (VSV-G) wirusa pęcherzykowego zapalenia jamy ustnej w miejsce genu env dzikiego typu HIV, co zmienia tropizm tkankowy wirusa z komórek T CD4+ na praktycznie każdy typ komórek ssaków. Jako takie, lentiwirusy są szeroko stosowanym systemem do hodowli komórek ssaków, modeli zwierzęcych i zastosowań w terapii genowej.
Ponieważ wektory lentiwirusowe zostały zmodyfikowane w ten sposób, systemy lentiwirusowe Lentifect™ firmy GeneCopoeia mają zwiększone bezpieczeństwo i posiadają następujące cechy, które czynią je wysoce użytecznymi do dostarczania DNA:
- Zakażają prawie wszystkie typy komórek ssaków
- Mogą być używane do dostarczania stosunkowo dużych sekwencji DNA – do około 5-6 kb długości
- Mogą być używane do generowania stabilnych linii komórkowych lub napędzania stabilnej ekspresji genów w organach i tkankach in vivo, dzięki integracji transgenu w przypadkowych miejscach genomu
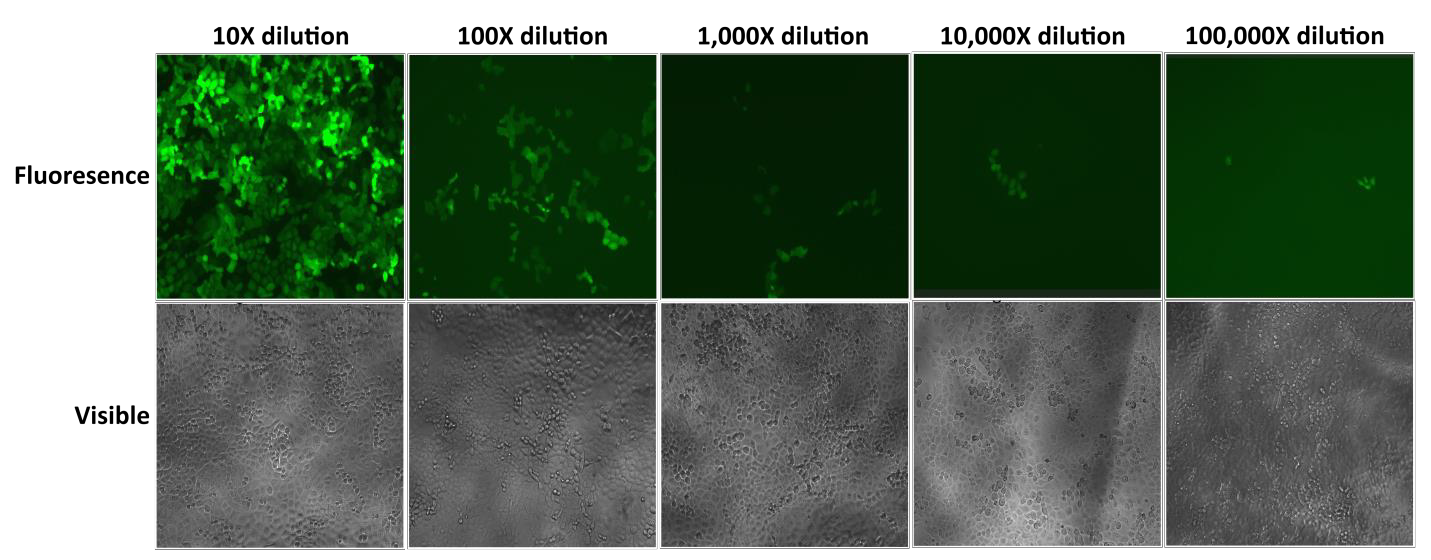
Cząsteczki lentiwirusowe Lentifect™ firmy GeneCopoeia zapewniają wysokie miana, umożliwiając badaczom wydajną ekspresję interesujących ich genów (Rysunek 2).
|
Rysunek 2. Badanie seryjnych rozcieńczeń cząstek lentiwirusowych Lentifect™. Fluorescencję eGFP sfotografowano za pomocą mikroskopu fluorescencyjnego 72 godziny po transdukcji. |
|
GeneCopoeia oferuje jedną z najbardziej rozbudowanych linii produktów lentiwirusowych w branży (Tabela 1).
| Produkt/usługa | Opis |
| Klon lentiwirusowy i wektory klonujące | Preparowane i niestandardowe klony niosące ORF, promotory, shRNA, 3′ UTR miRNA, prekursory i inhibitory, sgRNA i inne. Dostępne z wieloma promotorami, znacznikami i reporterami. Wektory do samodzielnego klonowania sekwencji zainteresowania. |
| Cząstki lentiwirusowe Lentifect™ | Preparowane i pakowane na zamówienie, gotowe do użycia cząstki lentiwirusowe. Produkowane z obszernych, obejmujących cały genom kolekcji klonów GeneCopoeia lub z klonów zgłoszonych przez klienta. |
| Lenti-Pac™ Lentiviral Packaging Reagents | Kompletny system odczynników do samodzielnej produkcji cząstek lentiwirusowych. Zawiera plazmidy pakujące, linię komórek pakujących, roztwór do zagęszczania cząstek oraz zestaw do miareczkowania. |
Tabela 1. Linia produktów i usług lentiwirusowych firmy GeneCopoeia.
Systemy oparte na AAV
W przeciwieństwie do genomu RNA lentiwirusów, AAV posiada jednoniciowy genom DNA (Samulski i Muzyczka, 2014). Ponadto, AAV nie pochodzi od patogenu; jest raczej zanieczyszczeniem adenowirusów, przy czym nie przypisuje się mu żadnych uwarunkowań patogennych. Naturalnie występujący AAV integruje się do genomu podobnie jak lentiwirus, ale tylko w locus AAVS1 na chromosomie 19. Miejsce to jest również znane jako „Safe Harbor”, ponieważ jest powszechnie wykorzystywane do wprowadzania transgenu bez uszkadzania komórek (DeKelver, et al., 2010).
Podobnie jak lentiwirus, AAV został zmodyfikowany pod kątem bezpieczeństwa i użyteczności. AAV wymaga koinfekcji z wirusem pomocniczym. Genom AAV ma długość 4,7 kb i zawiera 2 geny, Rep i Cap, które są wymagane do wirusowej replikacji i integracji. W AAVPrime™, Rep i Cap są usuwane, pozostawiając jedynie 145 bp 5′ i 3′ odwróconych powtórzeń terminalnych (ITR). Usunięcie Rep i Cap służy trzem celom: 1) Eliminuje zdolność wirusa pomocniczego do umożliwienia komórkom zakażonym AAV wytwarzania nowych wirionów AAV; 2) Pozwala na wprowadzenie genów o długości do około 4 kb (chociaż miano wirusa zmniejsza się przy transgenach dłuższych niż 3 kb); oraz 3) Praktycznie eliminuje zdolność AAV do integracji. Mały rozmiar AAV stanowi wyzwanie dla niektórych zastosowań. Na przykład, do edycji genomu CRISPR, badacze używają nukleazy Cas9 z S. aureus, ponieważ jest ona o około 30% krótsza niż częściej używana S. pyogenes Cas9 (Ran, et al., 2015).
Do pakowania, Rep i Cap zostały przeniesione do innego plazmidu, a geny helpera Adenowirusa zostały umieszczone na trzecim plazmidzie, dzięki czemu cały system pakowania jest bezpieczny i wolny od wirusa helpera (Rysunek 3).
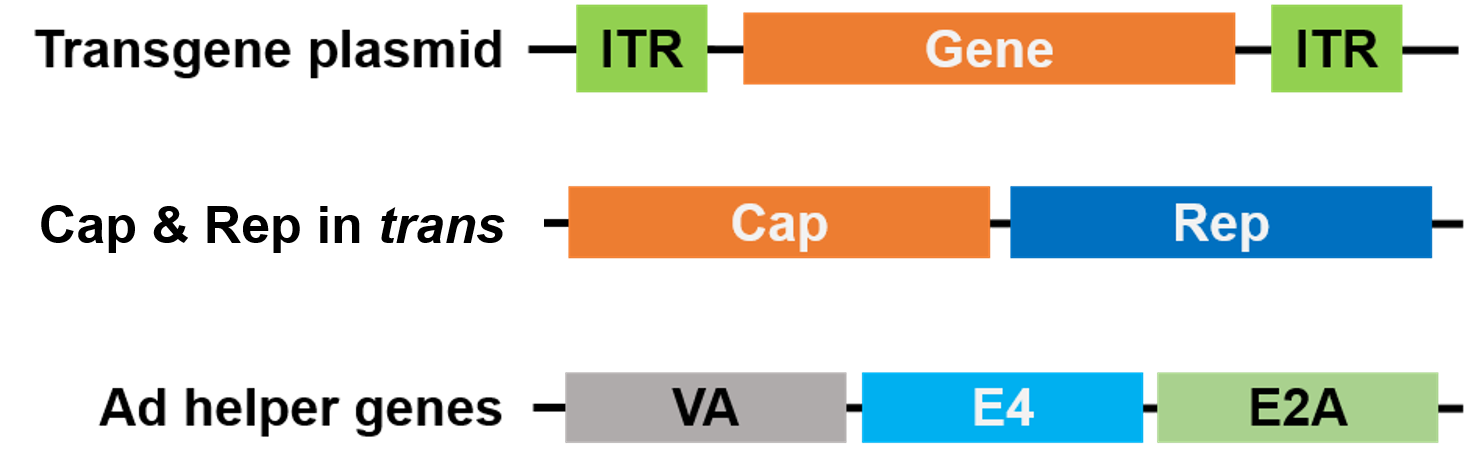 |
Rysunek 3. AAV bez wirusa pomocniczego. Do pakowania użyto 3 plazmidów. Plazmid z genem zainteresowania (górny) zawiera odwrócone powtórzenia końcowe (ITR). Drugi plazmid (środkowy) przenosi geny AAV Cap i Rep, a trzeci plazmid (dolny) przenosi wymagane geny z Adenowirusa (Ad) |
Ponadto, AAV występuje w różnych serotypach, które wpływają na specyficzność tkankową infekcji AAV. Wiele serotypów umożliwia badaczom: a) infekowanie szerokiego zakresu komórek gospodarza; lub b) ograniczenie infekcji do jednej lub kilku tkanek. Cząsteczki AAVPrime™ AAV firmy GeneCopoeia są dostępne w wielu serotypach (Tabela 2).
| Serotyp | Pierwotna tkanka docelowa | Opis |
| AAV-1 | Mięsień | Najlepszy dla mięśnia sercowego, mięśni szkieletowych, tkanki neuronalnej i glejowej. |
| AAV-2 | Mięśnie, wątroba, siatkówka | Najczęściej stosowany serotyp. Najlepszy dla neuronów, mięśni, wątroby i mózgu. |
| AAV-3 | Megakariocyty | Najlepszy dla megakariocytów, mięśni, wątroby, płuc i siatkówki. |
| AAV-4 | Retina | Najlepsza dla neuronów, mięśni, mózgu i siatkówki. |
| AAV-5 | Płuco | Najlepsze dla płuc, neuronów, stawu maziowego, siatkówki i trzustki. |
| AAV-6 | Mięsień, płuco | Najlepsze dla płuc, wątroby i serca. |
| AAV-7 | Mięsień, Siatkówka, Neurony | Najlepsze dla mięśni, neuronów i wątroby. |
| AAV-8 | Wątroba | Najlepsze dla mięśni, mózgu, wątroby i siatkówki. |
| AAV-9 | Różne | Najlepszy dla mięśni, serca, wątroby, płuc i mózgu. |
| AAV-10 | Pleura, CNS | Sklonowany z Cynomolgus, prawie identyczny z AAVrh10 z wyjątkiem 12 aminokwasów w VP1. Najlepszy dla płuc, mięśni, serca, NCS i wątroby. |
| AAV-DJ | Various | Mieszanka 8 naturalnie występujących serotypów. Skutecznie transdukuje wiele różnych typów komórek in vitro. |
| AAV-DJ/8 | Various | Odmiana AAV-DJ z mutacją domeny wiążącej heparynę (HBD), która umożliwia zakażenie wątroby, jak również innych tkanek in vivo. |
Tabela 2. Lista szeroko stosowanych serotypów AAV
Cząstki AAV AVPrime™ mają następujące cechy, które czynią je wysoce użytecznymi do dostarczania DNA:
- Wysokie miana. Miano oczyszczonych cząstek może wynosić do 10^14 GC/ml (kopii genomu/ml)
- Wszechstronność. Wiele serotypów umożliwia stosowanie w szerokim lub ograniczonym zakresie komórek gospodarza
- Niska toksyczność. Nie integruje się z genomem gospodarza.
- Niska immunogenność. Minimalna odpowiedź immunologiczna gospodarza.
- Bezpieczny. Nie są związane z żadną chorobą ludzką
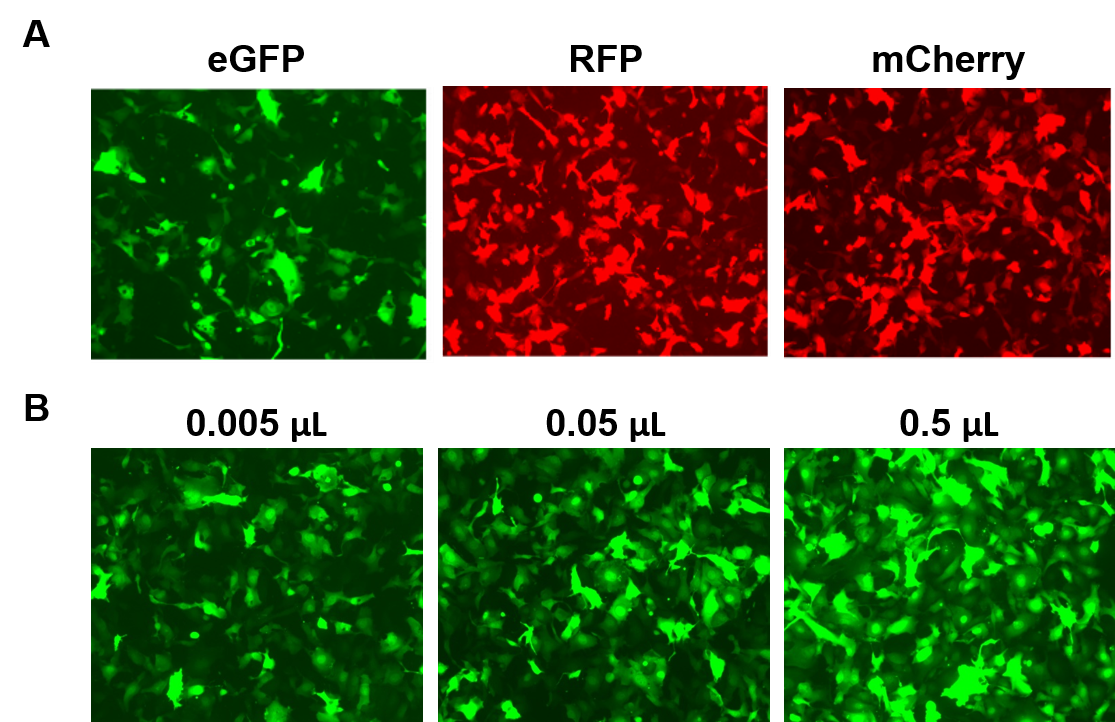
CząsteczkiAAVPrime™ są dostępne dla ludzkich i mysich ORF do 3 kb, w wielu serotypach i opcjach promotora, w czystości standardowej (tylko do użytku in vitro) lub oczyszczonej (do użytku in vivo). Klienci mogą zamawiać klony plazmidów, cząsteczki generowane na zamówienie dla interesujących ich genów lub wybierać spośród gotowych opcji wyrażających geny takie jak reporterzy fluorescencyjni (Rysunek 4).
|
Rysunek 4. Wydajność cząsteczek AAVPrime™ firmy GeneCopoeia. A. Komórki HT1080 w płytkach 24 dołkowych transdukowane 0,5 µL standardowej czystości AAV wyrażającego wzmocnione GFP (eGFP), czerwone białko fluorescencyjne (RFP) i monomeryczne Cherry (mCherry). B. Komórki HT1080 w płytkach 24-dołkowych transdukowano różnymi ilościami oczyszczonego AAV wyrażającego eGFP. Komórki wizualizowano za pomocą mikroskopu fluorescencyjnego (czas ekspozycji: 400 ms). |
|
What should I choose: Lentiwirus czy AAV?
Wybór pomiędzy lentiwirusem a AAV zależy od wielu czynników. Na przykład fakt, że lentiwirusy integrują się z genomem może być zarówno zaletą, jak i wadą, w zależności od potrzeb. Zapoznaj się z poniższą tabelą, aby pomóc sobie w podjęciu decyzji:
| Większe inserty | Stabilna integracja | Brak. integracji | Specyficzność komórkowa/tkankowa | bezpieczeństwo in vivo | |
| Lentiwirusy | ✔︎ | ✔︎ | |||
| AAV | ✔︎ | ✔︎ | ✔︎ |
Aby dowiedzieć się więcej o systemach wirusowych GeneCopoeia i złożyć zamówienie, odwiedź naszą stronę internetową (https://www.genecopoeia.com/product/lentiviral-system/)
Wnioski
W GeneCopoeia, staramy się zapewnić Państwu najwyższą jakość, najnowocześniejszą technologię w produktach dla Genomiki Funkcjonalnej i Biologii Komórki. Oferujemy szeroką gamę produktów, od obejmujących cały genom zestawów klonów plazmidowego DNA dla ORF-ów, promotorów genów, miRNA, shRNA i CRISPR, przez wydajne zestawy i odczynniki, po produkty do fluorescencyjnych sond struktury komórkowej, kwantyfikacji kwasów nukleinowych i znakowanych przeciwciał. Aby dowiedzieć się więcej, odwiedź naszą stronę internetową, www.genecopoeia.com, lub skontaktuj się z nami pod adresem [email protected].
DeKelver, et al. (2010). Functional genomics, proteomics, and regulatory DNA analysis in isogenic settings using zinc finger nuclease-driven transgenesis into a safe harbor locus in the human genome. Genome Res 20, 1133.
Dull, et al. (1998). A Third-Generation Lentivirus Vector with a Conditional Packaging System. J. Virol. 72, 8463.
Ran, et al. (2015). Edycja genomu in vivo przy użyciu Staphylococcus aureus Cas9. Nature 526, 186.
Sakuma, et al. (2012). Lentiviral vectors: basic to translational. Biochem. J. 443, 603.
Samulski i Muzyczka (2014). AAV-Mediated Gene Therapy for Research and Therapeutic Purposes. Annu. Rev. Virol. 1, 427.