Given the relative structural simplicity and repetitiveness of DNA, it would follow that proteins that bind specifically to it might have common DNA binding domain motifs but with specific amino acids side chains allowing for specific binding interactions.
- helix-turn-helix: występuje w prokariotycznych białkach wiążących DNA.
Rysunek: helix-turn-helix
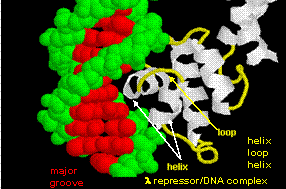
Rysunki przedstawiają dwa takie białka, represor cro z bakteriofaga 434 i represor lambda z bakteriofaga lambda. (Bakteriofagi są wirusami, które infekują bakterie.) Zauważcie jak specyficzność jest osiągana, częściowo, przez tworzenie specyficznych wiązań H pomiędzy białkiem i głównym rowkiem DNA operatora.
Rysunek: Lambda Repressor/DNA Complex
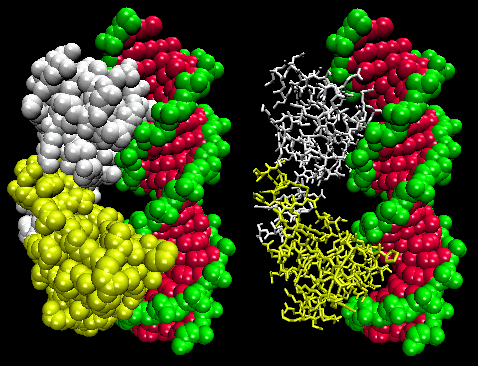
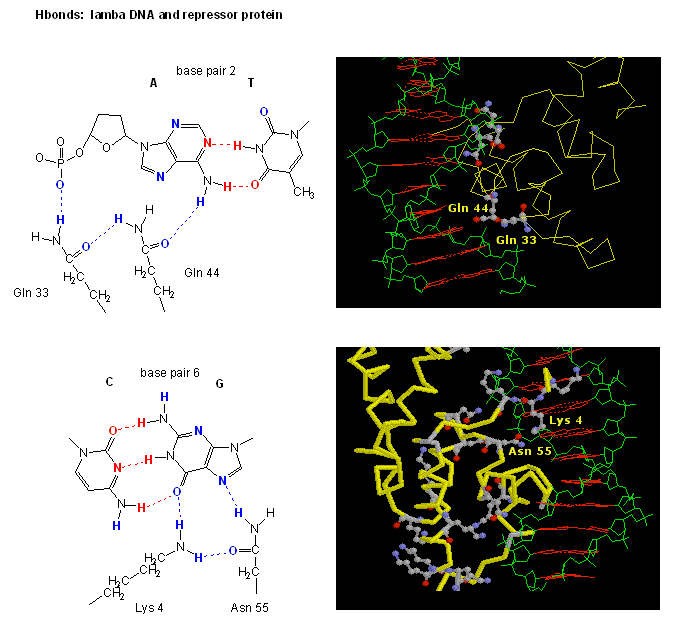
Figura: Oddziaływania wiązania H pomiędzy represoremλ a DNA
![]() Jmol: Zaktualizowany kompleks Lambda Repressor/DNA Jmol14 (Java) | JSMol (HTML5)
Jmol: Zaktualizowany kompleks Lambda Repressor/DNA Jmol14 (Java) | JSMol (HTML5)
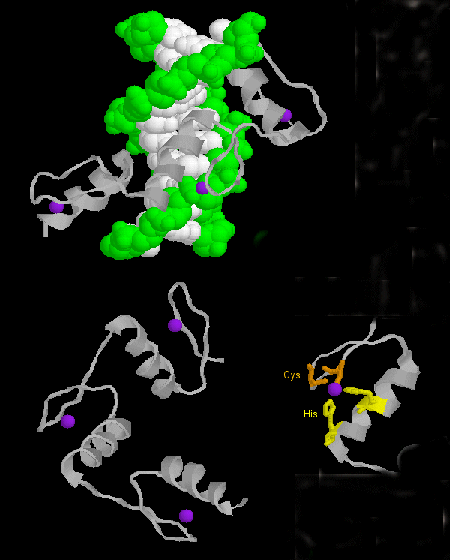
- palec cynkowy: (eukariota) Białka te mają wspólny motyw sekwencji X3-Cys-X2-4-Cys-X12-His-X3-4-His-X4-, w którym X jest dowolnym aminokwasem. Zn2+ jest skoordynowany tetraedrycznie z łańcuchami bocznymi Cys i His, które znajdują się odpowiednio na jednej z dwóch antyrównoległych nici beta i helisie alfa. Palec cynkowy, stabilizowany przez cynk, wiąże się z głównym rowkiem DNA. ]
Figura: palec cynkowy
![]() Jmol: Updated Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Jmol: Updated Zif268:DNA Complex Jmol14 (Java) | JSMol (HTML5)
Białka palca cynkowego, z których 900 jest zakodowanych w ludzkim genomie (w tym opisane powyżej eukariotyczne białko wiążące izolatory CTCF) mogą być zmobilizowane do rzeczywistej naprawy specyficznych mutacji w komórkach, co w przypadku przeprowadzenia w wystarczająco wysokim odsetku zmutowanych komórek mogłoby wyleczyć specyficzne choroby genetyczne, takie jak niektóre formy ciężkiego połączonego niedoboru odporności. W tej nowej technice (Urnov i in., 2005), wiele połączonych domen wiążących palec Zn (jedna z naturalnie występujących lub zmutowanych form wytworzonych w laboratorium), z których każda jest specyficzna dla pewnej sekwencji nukleotydów, jest połączona z niespecyficzną endonukleazą, pochodzącą z enzymu FokI. Nukleaza jest aktywna w formie dimerycznej, tak więc aktywny kompleks wymaga dwóch domen endonukleazy, z których każda związana jest z czterema różnymi domenami palca Zn, do złożenia się w miejscu docelowym. Specyficzność wiązania osiągana jest poprzez selekcję przez domeny z palcem Zn. Nukleaza powoduje powstanie nici w DNA, po czym następuje uruchomienie mechanizmów naprawczych komórki gospodarza. Proces ten obejmuje rozdzielenie nici, homologiczną rekombinację regionu nici z komplementarnym DNA wewnątrz komórki oraz naprawę nici. Jeśli nadmiar DNA typu dzikiego (niezmutowanego) zostanie dodany do komórek i użyty jako szablon, normalna mutacja naprawcza DNA naprawi mutację. Urnov et al wykazali, że do 20% hodowanych komórek zawierających mutację może zostać naprawionych w laboratorium. Jeśli te komórki uzyskają selektywną przewagę wzrostu, zmutowane komórki zostaną ostatecznie zastąpione komórkami typu dzikiego.
- Receptory hormonów steroidowych: (eukarionty) W przeciwieństwie do większości hormonów, które wiążą się z receptorami na powierzchni komórki, hormony steroidowe (pochodne cholesterolu) przechodzą przez błonę komórkową i wiążą się z receptorami cytoplazmatycznymi poprzez domenę wiążącą hormon. Zmienia to kształt receptora, który następnie wiąże się z określonym miejscem na DNA (hormone response element) poprzez domenę wiążącą DNA. W strukturze analogicznej do palca cynkowego, Zn 2+ jest tetraedrycznie skoordynowany z 4 Cys, w globularnej strukturze, która wiąże się jako dimer z dwoma identycznymi, ale odwróconymi sekwencjami DNA (palindrom) w obrębie głównego rowka. (Przykłady palindromów: Able was I ere I saw Elba; Dennis and Edna dine, said I, as Enid and Edna sinned.
Receptor glikokortykoidów (GR) jest szczególnym przykładem. Wiąże on DNA jako dimer. Dwie domeny wiążące DNA dimeru łączą się z dwoma sąsiadującymi głównymi rowkami DNA w sekwencji wiążącej GR (GBS), krótkiej sekwencji DNA w obrębie promotora. Meijsing i wsp. odkryli, że GBS nie tylko działa jako miejsce wiązania dla GR, umożliwiając transkrypcję genów, ale również wpływa na konformację receptora, powodując regulację transkrypcji genów w inny sposób. Grupa skonstruowała „geny reporterowe” lucyferazy, które mają GBS połączone z genem dla białka lucyferazy, które wyrażałyby białko lucyferazę (które fluoryzuje), gdyby były transkrybowane, z GBS. Odkryli oni, że względna aktywność transkrypcyjna nie koreluje z względnym powinowactwem wiązania GR do GBS. GBS, które były znacznie bardziej aktywne od innych, wiązały się porównywalnie z tymi o niższej aktywności, podczas gdy GBS o podobnej aktywności transkrypcyjnej wiązały się z różnym powinowactwem. Pokazuje to, że GBS nadaje unikalną funkcję związanemu z nim GR (tzn. na transkrypcję nie wpływa po prostu to, czy GR jest związany z GBS, czy nie). Stwierdzono, że „dźwigniowe ramię” receptora ulega zmianom konformacyjnym po związaniu z DNA, przy czym zmiany te są specyficzne dla sekwencji, z którą się wiąże. Zmutowane białko, GR-γ, identyczne z białkiem typu dzikiego, GR-α, z wyjątkiem ramienia dźwigni, wykazywało różną aktywność transkrypcyjną, mimo że wiązało się z tym samym miejscem w DNA, co pokazuje, że ramię dźwigni i jego konformacja wpływa na transkrypcję.
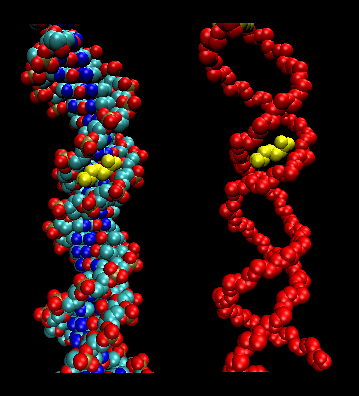
- leucynowe suwaki (lub nożyczki): (eukariota) Białka te zawierają odcinki 35 aminokwasów, w których Leu występuje wielokrotnie w odstępach 7 aminokwasowych. Te regiony białka tworzą amfifilowe heliksy, z Leu na jednej stronie, jeden Leu po dwóch skrętach helisy. Dwa z tych białek mogą tworzyć dimer, stabilizowany przez wiązanie tych niepolarnych, bogatych w leucynę amfifilowych heliksów ze sobą, tworząc cewkę, podobnie jak w białku mięśniowym – miozynie. Suwak leucynowy reprezentuje domenę wiążącą białko. Domena wiążąca DNA znajduje się w pierwszych 30 N-końcowych aminokwasach, które są podstawowe i tworzą helisę alfa, gdy białko wiąże się z DNA. Suwak leucynowy działa następnie w celu połączenia dwóch białek wiążących DNA, umożliwiając heliksom N-końcowych zasad oddziaływanie z głównym rowkiem DNA w sposób specyficzny dla danej zasady. Walina i izoleucyna, wraz z leucyną, często występują w odcinkach aminokwasów, które mogą oddziaływać tworząc inne rodzaje cewek.
Figura: suwaki leucyny (wykonane za pomocą VMD)
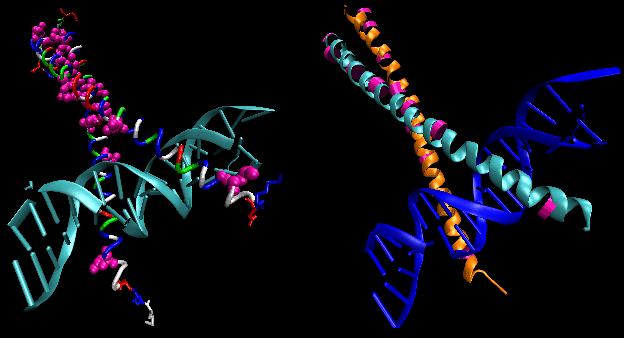
![]() Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
Jmol: Updated Leucine Zipper Jmol14 (Java) | JSMol (HTML5)
Podobnie jak nukleazy z palcami cynkowymi zostały użyte do indukowania naprawy mutacji, w innym badaniu genomu szczura użyto specjalnie zaprojektowanych ZFNs do wywołania przerw w ds-DNA, które zawierają mutacje z niedokładnego mechanizmu naprawy DNA (przez NHEJ) i stąd zawierały specyficzne mutacje (Geurts, et al. 2009). Proces ten, �nockout of the gene, zapobiega produkcji białka normalnie transkrybowanego przez gen docelowy. Pięcio- i sześciopalczaste ZFN zostały użyte do osiągnięcia wysokiego poziomu specyficzności w ukierunkowanym wiązaniu się z genem dla trzech różnych białek: białka zielonej fluorescencji (GFP), immunoglobuliny M (IgM) i Rab38. Nokaut powiódł się u 12% badanych szczurów; zwierzęta te nie miały białka typu dzikiego i nie wykazywały żadnej ekspresji. ZFN były na tyle specyficzne, że nie zaobserwowano mutacji w żadnym z 20 przewidywanych miejsc nie docelowych. Badanie to wspiera opłacalność kontroli transkrypcji i ekspresji w leczeniu chorób oraz znaczenie specyficznego wiązania.
Widzieliśmy, że dwa główne czynniki przyczyniają się do specyficznego rozpoznawania DNA przez białka; tworzenie wiązań wodorowych ze specyficznymi donorami nukleotydów i akceptorami w głównym rowku oraz zależne od sekwencji deformacje helisy DNA do zmienionych kształtów ze zwiększonym powinowactwem ligandów białkowych. Na przykład białko TBP (Tata Binding Protein) może oddziaływać z poszerzonym małym rowkiem w ramce TATA. Nowe ustalenia wspierają, że dodatkowo białka są w stanie wykorzystać informacje w drobnych rowkach, które stały się „zwężone” w zależności od sekwencji nukleotydów.
Ścieżki DNA wzbogacone w A mogą prowadzić do skręcających konformacji, które powodują wiązanie wodorowe między parami zasad w głównych rowkach, powoduje zwężenie drobnych rowków. Duże ilości par zasad AT koncentrują się w wąskich rowkach mniejszych (szerokość <5,0 �), a pary zasad CG występują częściej w szerokich rowkach mniejszych.
Jak zwężenie rowków mniejszych wpływa na rozpoznawanie DNA? Wąskie drobne rowki zwiększają ujemny potencjał elektrostatyczny DNA, czyniąc go bardziej specyficznym i rozpoznawalnym miejscem. Fosforany szkieletu DNA są bliżej środka rowka, gdy jest on wąski, co koreluje wąskie drobne rowki z bardziej ujemnym potencjałem elektrostatycznym.
The minor grove-interacting części białek zawierają argininę, której łańcuch boczny może być zakwaterowany w bardziej wąskie i negatywne minor groove. Argininy mogą wiązać się i w niektórych przypadkach wstawiać się jako krótkie motywy sekwencyjne, które zwiększają specyficzność rozpoznawania kształtu DNA. Arg jest preferowane w stosunku do Lys, ponieważ efektywny promień ładunku w Arg jest większy niż nośnika ładunku w Lys. Prowadziłoby to do zmniejszenia energii desolwatacji dla Arg, co sprzyjałoby jego wiązaniu do zwężonego głównego rowka. Odkrycie to pokazuje, że „rola kształtu DNA musi być brana pod uwagę przy anotacji całego genomu i przewidywaniu miejsc wiązania czynników transkrypcyjnych”.
Figura: Arg in T3c Transposase binding in Narrowed Minor Grove of T3c Transposon
- Sliding Model for protein/DNA Interactions
Contributors and Attributions
- Prof. Henry Jakubowski (College of St. Benedict/St. John’s University)
.