- Wprowadzenie
- Wyniki
- Cell Accumulation and Attachment to Mineral Requires Chemotaxis and Extracellular Electron Transport Genes in S. oneidensis MR-1
- Charakteryzowanie kongregacji wokół IEA w innych szczepach Shewanella
- Dyskusja
- Materiały i metody
- Hodowla i szczepy
- Synteza minerałów
- Cell Accumulation after Photo-Bleaching (CAAP) Time-Lapse Experiments
- Mikroskopowe uchwycenie ruchów komórek
- Analiza pływania
- Wkład autorów
- Oświadczenie o konflikcie interesów
- Podziękowania
- Materiały uzupełniające
Wprowadzenie
W późnych latach 80-tych, Shewanella oneidensis MR-1 (Myers i Nealson, 1988a), a później kilka gatunków Geobacter (Lovley i in., 1993; Champine i in., 2000) okazały się zdolne do przenoszenia elektronów na nierozpuszczalne akceptory elektronów (IEA), takie jak nierozpuszczalne tlenki metali i/lub naładowane elektrody: proces ten nazywany jest zewnątrzkomórkowym transportem elektronów (EET) (Myers i Nealson, 1988b; Venkateswaran i in., 1999; Bond i Lovley, 2003). Zdolność ta wzbudziła duże zainteresowanie w odniesieniu do cykli biogeochemicznych, bioremediacji, korozji, przetwarzania nanomateriałów i produkcji energii (Bretschger i in., 2007; Kan i in., 2011; Hsu i in., 2012). Chociaż wiadomo, że kilka grup mikrobów jest zdolnych do EET, główne badania mechanistyczne zostały przeprowadzone tylko na dwóch systemach modelowych, Shewanella (Fredrickson et al., 2008; Shi et al., 2009) i Geobacter (Lovley et al., 2004).
Do tej pory wyizolowano ponad 100 innych szczepów Shewanella z wielu różnych środowisk, w tym z otwartej kolumny wodnej, łupków piaskowcowych, osadów morskich i słodkowodnych, rurociągów naftowych, solanek naftowych, a nawet zbiorowisk glonów na szczycie lodu antarktycznego (Hau i Gralnick, 2007). Genomy ponad 20 z tych gatunków zostały w pełni zsekwencjonowane (Fredrickson i in., 2008). Wykazano, że kilka z tych gatunków jest zdolnych do EET do IEA, w tym S. oneidensis MR-1, Shewanella putrefaciens CN32, S. sp. ANA-3, S. sp. W3-18-1, Shewanella amazonensis SB2B, Shewanella frigidimarina NCIMB 400 i Shewanella loihica PV-4 (Fredrickson i in., 1998; Venkateswaran i in., 1998; Gao i in., 2006; Bretschger, 2008). Inni członkowie rodzaju Shewanella, tacy jak Shewanella baltica OS217 i Shewanella denitrificans OS155 (Tabela 1) nie są zdolni do EET (Brettar i in., 2002). Spośród wszystkich tych szczepów, kongregacja w odpowiedzi na IEA została zbadana tylko dla MR-1.

Tabela 1. Genetyczne porównanie Shewanella spp. i ich pierwotnych siedlisk.
W obrębie rodzaju Shewanella, mechanizm EET MR-1 został najszerzej scharakteryzowany. MR-1 stosuje kilka metod redukcji nierozpuszczalnych IEAs: (1) bezpośrednie EET za pośrednictwem zewnątrzkomórkowych cytochromów wielohemowych (Beliaev i Saffarini, 1998; Myers i Myers, 2001, 2002; Meyer i in., 2004; Mitchell i in., 2012; Kracke i in., 2015) (Rysunek 1A); (2) mediowane EET z wykorzystaniem rozpuszczalnych czółenek elektronowych związanych z cytochromami błonowymi (Lovley i in., 1996; Marsili i in., 2008; Li i in., 2012; Kotloski i Gralnick, 2013; Okamoto i in, 2014); (3) mediowane EET wykorzystujące przewodzące rozszerzenia błony zewnętrznej zawierające cytochromy (Gorby i in., 2006; El-Naggar i in., 2010); oraz (4) przewodzące macierze zewnątrzkomórkowe zawierające przewodzące i półprzewodzące minerały (Kato i in., 2010). W szczepie MR-1 zidentyfikowano kilka genów, które okazały się niezbędne dla EET (Rysunek 1A i Tabela 2), w tym tetrahemowy cytochrom cymA (SO_4591) i kombinację mtrBC/omcA (SO_1776, SO_1778 i SO_1779), które kodują składnik decahemowy cytochromu c i tetrahemowy cytochrom c niezbędny do redukcji kilku beztlenowych akceptorów elektronów, w tym tlenków metali (Myers i Myers, 2001, 2002; Schwalb i in., 2003). Ponieważ wszystkie te mechanizmy opierają się na bliskości komórki do IEA dla EET, ważne jest zrozumienie wyczuwania komórek i migracji netto w kierunku IEA. Jeśli chodzi o kongregację, taksony redoks lub taksony energetyczne, wiele badań przeprowadzono na MR-1 ze względu na jego wszechstronne wykorzystanie akceptora elektronów (Bencharit i Ward, 2005; Baraquet i in., 2009; Harris i in., 2010). Taksja energetyczna jest terminem, który szeroko obejmuje aerotaksję, fototaksję, taksję redoks, taksję do alternatywnych akceptorów elektronów i chemotaksję do utleniających się substratów (Alexandre i in., 2004).
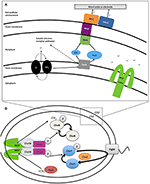
Rysunek 1. (A) Pozakomórkowy transport elektronów (EET) w Shewanella oneidensis MR-1 buduje siłę napędową protonów (pmf). W warunkach beztlenowych członkowie rodzaju Shewanella mogą transportować elektrony z błony wewnętrznej, peryplazmy, błony zewnętrznej i elektrody za pomocą łańcucha cytochromów i menachinonów (MQ) znanych wspólnie jako zewnątrzkomórkowy transport elektronów (EET). Ekspresja cytochromów EET może ulegać zmianom w zależności od akceptora elektronów dostępnego w środowisku. Liczba grup hemowych zawierających żelazo typu c podana jest wewnątrz (nawias). Elektrony przepływaj± od donorów elektronów, takich jak mleczan, do redukcji chinonów (Q), które jednocze¶nie przenosz± H+ do peryplazmy, buduj±c pmf, a jednocze¶nie przekazuj± elektrony do CymA. W przypadku braku rozpuszczalnych akceptorów elektronów, elektrony są przekazywane do kompleksu błony zewnętrznej MtrCAB. Kompleks MtrCAB może oddawać elektrony bezpośrednio do terminalnego akceptora elektronów, którym może być minerał lub elektroda anodowa, albo poprzez cząsteczki flawiny. pmf napędza produkcję ATP i rotację polarnej flagelli. „Samoczułe” metyloakceptorowe białka chemotaksji (MCPs) kontrolują rotację flagelli poprzez system transdukcji sygnału chemotaksji (B) i mogą wykrywać zmiany w stężeniu H+ podczas redukcji metalu. (B) Prawdopodobny szlak transdukcji sygnału chemotaksji u Shewanella. W odpowiedzi na stymulację, struktura MCP przesuwa się jak tłok, powodując spowolnienie lub zatrzymanie auto-fosforylacji CheA. CheY i CheB nie są więc fosforylowane, a brak CheY-P umożliwia płynne pływanie. Ta stymulacja ma również inny efekt – CheB jest nieaktywny bez fosforylacji (nie może działać jako metyloesteraza), a to pozwala białku CheR (stale aktywnej metylotransferazie) konkurować i swobodnie metylizować region metyloakceptorowy dimeru MCP (domena HAMP). Metylacja MCP powoduje zwiększenie tempa autofosforylacji reszt histydynowych CheA. Dlatego system transdukcji sygnału ma kontrolę nad częstotliwością odwracania flagelli w obecności zwiększonych lub zmniejszonych bodźców, co prowadzi do serii pływania „biegnij i odwracaj”.

Tabela 2. Geny MR-1 opisane w tekście.
Dobrze udokumentowano, że akumulacja komórek MR-1 w odpowiedzi na rozpuszczalne akceptory elektronów jest formą taksji energetycznej, która zależy od strumienia H+ i ustanowienia protonowej siły napędowej (Baraquet i in., 2009) (Rysunek 1). Częścią tej odpowiedzi jest szybsze pływanie, co obserwuje się również w przypadku transporterów elektronów, takich jak ryboflawina lub 2,6-disulfonian antrachinonu (AQDS) (Bencharit i Ward, 2005; Harris i in., 2010; Li i in., 2012). W przeciwieństwie do tego, gromadzenie się komórek wokół IEA, które zostało nazwane kongregacją (Nealson i in., 1995), obejmuje zarówno zwiększoną prędkość pływania po kontakcie z IEA (zwaną elektrokinezą), jak i zwiększone cofanie się pływania po zmniejszeniu PMF. Odwracanie pływania umożliwia wielokrotne przejściowe spotkania komórki z IEA (trwające 1-100 ms), a szybkość, z jaką pływające komórki przechodzą do nieodwracalnego przywiązania do IEA podczas kongregacji, nie została jeszcze określona ilościowo.
Mechanizm(y), który(e) komórki wykorzystują do zlokalizowania IEA, pozostaje(ą) niejasny(e) (Nealson i in., 1995; Bencharit i Ward, 2005; Harris i in., 2010). Wczesne doniesienia sugerowały, że inny badany organizm modelowy Geobacter, gromadzi się wokół IEA poprzez wyczuwanie gradientu zredukowanych jonów metali (Childers i in., 2002), jednakże zredukowane jony metali nie są zaangażowane w mechanizm wyczuwania wykorzystywany przez MR-1 (Bencharit i Ward, 2005). Niedawno opisano kongregację bakterii w odpowiedzi na poised elektrodami, wskazując na wyczuwanie redoks, a nie wyczuwanie jonów metali, jako czynnik wyzwalający odpowiedź (Harris i in., 2010). Dodatnie potencjały przyłożone do elektrody (200-600 mV vs. Ag/AgCl) powodowały gromadzenie się MR-1, podobnie jak w przypadku tlenków metali (Harris i in., 2012). Potencjały redoks minerałów zawierających MnO2 wahają się pomiędzy 400 a 600 mV vs. Ag/AgCl i łatwiej przyjmują elektrony niż minerały Fe(OH)3, które posiadają równoważny potencjał opanowania 100 do 300 mV vs. Ag/AgCl (Burdige, 1993). W poprzedniej pracy wysunięto hipotezę, że charakterystyczne pływanie MR-1 wokół IEA jest regulowane przez dwa samoczułe receptory chemotaksji, białka metyloakceptorowe (MCPs) z domenami Ca+ channel chemotaxis receptor (Cache) (SO_2240) i Per/Arnt/Sim (PAS) (SO_1385), oraz przez kinazę białkową transdukcji sygnału chemotaksji CheA-3 (SO_3207), aby umożliwić komórce zbadanie potencjału redoks lub zdolności przyjmowania elektronów przez powierzchnię (Tabela 2 i Rysunek 1B) (Harris i in., 2012). Przed tym badaniem nieznane były geny odpowiedzialne za ruchliwe przyłączanie komórek na i wokół IEA.
W tym raporcie badamy mechanizm kongregacji różnych szczepów Shewanella poprzez monitorowanie wzorów pływania i przyłączania komórek do MnO2 i Fe(OH)3. Oprócz badania WT i kilku mutantów delecyjnych MR-1, przebadano również inne gatunki Shewanella (patrz Tabela 1). Wykazano, że wiele szczepów jest zdolnych do kongregacji wokół MnO2 i FeOH3, podczas gdy inne reagowały wybiórczo na MnO2 (SB2B) lub Fe(OH)3 (W3-18-1). Kiedy monitorowano przyczepność komórek do powierzchni mineralnych, zaobserwowaliśmy silną korelację pomiędzy zdolnością komórek do agregacji, a przyczepnością komórek do powierzchni IEA. Następnie porównaliśmy genomy tych gatunków, aby znaleźć geny kandydujące zaangażowane w fenotypy pływania w skupiskach, akumulacji i przyłączania komórek w odpowiedzi na specyficzną powierzchnię MAE.
Wyniki
Cell Accumulation and Attachment to Mineral Requires Chemotaxis and Extracellular Electron Transport Genes in S. oneidensis MR-1
Większość wczesnych badań nad taksją energetyczną w MR-1 wykorzystywała metodę rojowych testów płytowych (Nealson et al., 1995; Baraquet i in., 2009; Li i in., 2012). Tutaj oferujemy bardziej dogłębną charakterystykę tych nieznanych jeszcze mechanizmów taksowania energii poprzez zastosowanie ilościowej metody śledzenia pływania pojedynczych komórek w płynnym podłożu w odpowiedzi na IEA oraz akumulacji komórek po foto-wybielaniu (CAAP) w celu zmierzenia szybkości przyłączania się komórek (Li i in., 2010). CAAP wykorzystuje promieniowanie lasera UV z mikroskopu konfokalnego do nieodwracalnego zaciemnienia (wygaszenia fluorescencji) komórek znakowanych GFP na i wokół danej IEA. Poprzez kwantyfikację fluoryzujących komórek w miarę ich przemieszczania się do zaciemnionej strefy, tempo akumulacji i przyłączania może być określone ilościowo, a różne szczepy porównane. Aby uznać, że komórka jest przytwierdzona, jej pozycja jest weryfikowana przez analizę obrazu 3D pola widzenia. Jeśli komórka zatrzyma się na powierzchni minerału, wówczas uznaje się ją za „przyczepioną”. Siła wiązań pomiędzy stacjonarnymi komórkami MR-1 a powierzchniami została zmierzona za pomocą pincety optycznej w oddzielnym badaniu (Gross i El-Naggar, 2015). Metoda ta pozwala na rozróżnienie pomiędzy ukierunkowanym przyłączeniem komórek, a przypadkowym przyłączeniem elektrostatycznym.
Jak pokazano na rysunku 2, komórki WT MR-1 przyłączyły się do powierzchni mineralnej po 30 min z pewnym dużym odchyleniem w liczbie, 2,655 ± 1,352 komórek/mm2. W tym czasie komórki wykazują pływanie „touch and go”, nawiązując przejściowy kontakt z powierzchnią mineralną MnO2. Po 2 h liczba nowych komórek przyczepionych do powierzchni mineralnej wzrosła do 4,300 ± 584 komórek/mm2 powierzchni mineralnej, podczas gdy dodatkowe komórki ruchliwe nadal się gromadziły (Wideo S1, S2, i S17). Mutanty z potrójną delecją w kluczowych genach EET mtrBC/omcA (SO_1776, SO_1778, SO_1779), pojedynczą delecją cymA (SO_4591) i głównego chemoreceptora taksydów energetycznych MCP Cache (SO_2240) zostały wcześniej powiązane z fenotypem kongregacji pływackiej (Harris i in., 2012). Mutanty delecyjne (ΔcymA, Δmcp_cache i ΔmtrBC/omcA) były ruchliwe i zdolne do odwrócenia kierunku pływania, ale nie były zdolne do gromadzenia się i wykazywały niewielkie lub żadne przywiązanie do MnO2 podczas eksperymentu (Figura 2C i Rysunki S1A,B). Akumulacja WT w strefie wybielonej przy t = 2 h wynosi średnio 4,300 ± 584 komórek/mm2, podczas gdy mutanty Δmcp_cache i ΔmtrBC/omcA akumulują się w znikomej liczbie (Figura 2C i S1CD).
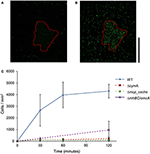
Figura 2. Pływający MR-1 może migrować w kierunku nierozpuszczalnych minerałów akceptora elektronów i przyczepiać się. Reprezentatywny obraz konfokalnej mikroskopii fluorescencyjnej komórek WT MR-1 w czasie t = 0 i t = 120 min (A,B). Pływające komórki WT MR-1 GFP wprowadzono do cząsteczki MnO2 (czerwony przerywany kontur) w beztlenowo zamkniętej kapilarze. W momencie t = 0 wszystkie komórki uległy nieodwracalnemu fotowybieleniu w obszarze 250 na 250 μm wokół cząsteczki (A). Następnie zliczano fluorescencyjne komórki spoza strefy wybielonej, które wpływały do ramki i przyczepiały się do powierzchni minerału. Czarny pionowy pasek skali po prawej stronie reprezentuje 100 μm. Wykres (C) porównuje przyleganie WT MR-1 do cząsteczki MnO2 w ciągu 120 min z mutantami delecji chemotaksji i zewnątrzkomórkowego transferu elektronów (MR-1 Δmcp_cache, ΔcymA i ΔmtrBC/omcA). Słupki błędów obejmują 2 odchylenia std.
Charakteryzowanie kongregacji wokół IEA w innych szczepach Shewanella
Dziewięć szczepów Shewanella przetestowano pod kątem ich zdolności do kongregacji wokół mineralnych powierzchni MnO2 i Fe(OH)3 z testem serii czasowych przyczepiania komórek do minerału (Tabela 3 i Wideo S3-S14). Podobnie jak w przypadku MR-1, wszystkie dziewięć badanych szczepów miało pojedyncze polarne flagellum, a odwrócenie kierunku pływania następowało przez odwrócenie rotacji flagellarnej (dane nie pokazane). Ślady pływania w ramach tego samego eksperymentu zostały posortowane na dwie oddzielne grupy na podstawie drogi pływania (Tabela 3): te, które kontaktowały się z nierozpuszczalną powierzchnią tlenku metalu (pływały w obrębie 2 μm) w porównaniu z tymi, które się nie kontaktowały (pływały >2 μm). Kontaktujące się pływaki, które wykazały znaczący wzrost częstotliwości cofania i prędkości pływania w porównaniu z grupą nie kontaktującą się (P < 0.05) zostały zaklasyfikowane jako pozytywne dla zachowania kongregacyjnego, jak oznaczono literami nadrzędnymi (Tabela 3).

Tabela 3. Szybkość pływania bakterii i częstotliwość cofania się wokół minerałów tlenków metali.
Streamy ANA3, CN32, i PV-4, oprócz MR-1, były pozytywne dla kongregacji zarówno wokół MnO2 jak i Fe(OH)3 (Tabela 3, Rysunek 3; Videokonferencje S1-S8). Wykazały one maksymalne tempo rewersji, gdy znajdowały się w odległości od 5 do 40 μm od powierzchni cząsteczek MnO2 lub FeOH3 (Rysunek 3). Trzy szczepy: OS217, NCIMB400 i OS155 nie były ruchliwe w czasie t = 30 min – w odpowiedzi na minerały Fe(OH)3 lub MnO2 (Tabela 3). Na przykład, częstotliwość cofania się pływających komórek MR-1 kontaktujących się z MnO2 wynosiła 0,94 ± 0,53 cofnięcia/s, podczas gdy częstotliwość cofania się komórek nie kontaktujących się wynosiła 0,62 ± 0,73 cofnięcia/s. W grupie kontaktującej się z MR-1 wzrosła również prędkość z 19,26 ± 11,2 μm/s w grupie nie kontaktującej się do 24,37 ± 6 μm/s w grupie kontaktującej się. Ponieważ wystąpił zarówno statystycznie istotny wzrost prędkości pływania, jak i cofanie się w taki sposób, aby umożliwić komórkom pozostanie w pobliżu cząsteczki tlenku metalu, szczep ten uznano za kongregacyjny pozytywny.
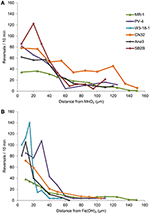
Rysunek 3. (A,B) Częstotliwość cofania się (oś y) pływających komórek Shewanella vs. odległość (oś x) od cząsteczki MAE. Średnie częstotliwości cofania się poszczególnych śledzonych komórek pływających są podzielone na przedziały 5 μm wzdłuż osi x dla eksperymentów z cząsteczką MnO2 (A) lub Fe(OH)3 (B).
Ślady pływania (30 s) komórek Shewanella spp. które wykazały preferencję dla minerałów tlenków metali są zaznaczone na Rysunkach 4A-F. Komórki SB2B nie wykazywały żadnej reakcji pływania na Fe(OH)3 (Figura 4D), podczas gdy wykazywały aktywną kongregację wokół cząstek MnO2 (Figura 4A). W przeciwieństwie do tego, komórki W3-18-1 gromadziły się wokół cząsteczek Fe(OH)3 (Figura 4C), ale wykazywały znacznie zmniejszoną aktywność pływania i odwracania wokół MnO2 (Figura 4F; Videos S9, S14).
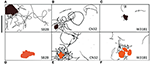
Figura 4. (A-F) Panel trzech torów pływackich (30 s) Shewanella spp. wykazał preferencję dla minerałów tlenków metali. Zbadano zachowanie trzech ruchliwych Shewanella spp. w odpowiedzi na MnO2 (górny rząd-czarna kolorowa cząsteczka) i Fe(OH)3 (dolny rząd-pomarańczowa kolorowa cząsteczka). Kongregacja zachodzi w warunkach beztlenowych, tory pływackie zaznaczono kolorem czarnym. SB2B (po lewej), CN32 (w środku) i W3181 (po prawej). Pływanie komórek było śledzone ręcznie. Pasek skali w lewym górnym rogu = 50 μm. Brązowy kolor reprezentuje MnO2, a pomarańczowy – Fe(OH)3. Gdy nie wykryto komórek ruchliwych, wskazuje na to brak czarnych linii.
Dyskusja
Członkowie rodzaju Shewanella są heterotroficznymi, fakultatywnymi aerobami zdolnymi do wykorzystania szerokiego zakresu substancji organicznych i nieorganicznych jako źródeł energii. Wiele szczepów Shewanella zostało wyizolowanych z kolumny wodnej i osadów w miejscach na całym świecie. Oprócz rozpuszczalnych akceptorów elektronów, wiele z tych organizmów może oddychać szerokim asortymentem naturalnie występujących nierozpuszczalnych tlenków metali w warunkach anoksycznych.
W naszym badaniu zachowania kongregacyjnego u ośmiu gatunków Shewanella, użyliśmy śledzenia komórek z analizą komputerową i analizą serii czasowych mocowania komórek do MnO2 lub Fe(OH)3 w celu wykazania, że pięć z ośmiu Shewanellae było zdolnych do tego zachowania CN32, ANA-3, W3-18-1, SB2B i PV-4) i że niektóre szczepy (W3-18-1, SB2B) wykazują preferencję dla jednego tlenku metalu nad drugim w tych warunkach (Rysunek 4). Takie wyniki są zgodne z poglądem, że bakterie te przystosowały się do przeważającego nierozpuszczalnego akceptora elektronów występującego w środowisku, z którego zostały wyizolowane. Ponadto, trzy szczepy Shewanella, które zostały wyizolowane z kolumny wody, nie gromadziły się w odpowiedzi na IEA. Czy różnice te wynikają z braku genów zaangażowanych w EET (jak w OS217), czy też z innych powodów, będzie kwestią przyszłych badań.
W innych badaniach, nocny wzrost szczepów Shewanella porównujących szybkość redukcji różnych tlenków metali w porównaniu głowa do głowy, wykazano, że redukują one tlenki metali preferencyjnie z ich niszy środowiskowej (Bretschger et al., 2007). Przedstawione tutaj wyniki są zgodne z hipotezą, że gatunki Shewanella wykształciły zachowania związane z gromadzeniem i przyczepianiem się, zgodne ze środowiskami, z których zostały wyizolowane (Tabela 3). Na przykład, W3-18-1 wydaje się wykazywać znaczącą skłonność do gromadzenia się w obecności i przyłączania do minerałów Fe(OH)3 występujących na szelfie kontynentalnym Pacyfiku (Harris i in., 2012), podczas gdy SB2B preferuje MnO2 (Venkateswaran i in., 1998), podobnie jak w osadach rzeki Amazonki.
Porównanie genomowe w Tabeli 1 sugeruje, że obecność cytochromu oktahemy (SO_4142) może być istotna dla pływania w odpowiedzi na stosunkowo „niskie” potencjały redoks (100-300 mV vs. Ag/AgCl) Fe(OH)3. Natomiast mtrF (SO_1780) może być potrzebny do odpowiedzi na relatywnie „wyższe” potencjały redoks MnO2 (pomiędzy 400 a 600 mV vs. Ag/AgCl). Tę hipotezę można by przetestować z mutantami delecyjnymi w MR-1. Niniejsza praca uzupełnia wcześniejszą pracę Harrisa i wsp. (2012), ujawniając, że geny zaangażowane w efekt netto zachowania ruchliwego w kierunku minerałów IEA lub elektrod kumulują się w odpowiednich skalach czasowych 1-30 min (Rysunek 2) (Harris i wsp., 2012). Nasze odkrycia przy użyciu techniki mikroskopii konfokalnej CAAP wykazały, że kongregacja prowadzi do powolnej migracji komórek w kierunku minerałów IEA z ostatecznym ich przyłączeniem. Tak więc, zachowanie to jest odpowiednio określane jako kongregacja, ponieważ opisuje gromadzenie się lub akumulację bakterii ruchliwych wokół IEA. Wykazaliśmy tutaj, że geny mcp cache i mtrBC/omcA są niezbędne dla fenotypu gromadzenia się i przyłączania w MR-1, oprócz tego, że są odpowiedzialne za charakterystyczne wzorce pływania o zwiększonej prędkości i zachowania typu biegnij i odwracaj, które zostały zidentyfikowane wcześniej (Harris i in., 2012).
Wyniki eksperymentów z mutantami ΔcymA, ΔmtrBC/omcA i Δmcp_cache w MR-1 wykazują zahamowanie akumulacji, przywiązania i zachowania kongregacyjnego w odpowiedzi na wszystkie MAE. Można zatem postawić hipotezę, że obecność homologicznych genów EET (cymA, mtrB, mtrC, omcA) oraz genu chemotaksji akceptującego metyl (mcp_cache) determinuje odpowiedzi fenotypowe, które obserwujemy u innych Shewanella spp. (Tabela 3). Genetyczne porównanie szczepów, które mogą reagować na „niższy” potencjał redox IEA, wskazuje, że peryferyjne cytochromy oktahemy błony zewnętrznej (takie jak SO_4142) mogą odgrywać pewną rolę w odpowiedzi na „niższy” potencjał redox IEA. Stąd te obserwacje dotyczące podtrzymywanego pływania wokół specyficznych minerałów odpowiadały specyficznym genotypom różnych gatunków.
Podczas wielu MFC (Kotloski i Gralnick, 2013) i redukujących metale eksperymentów hodowli wsadowych, nie mierzono taksowania energii z udziałem zewnątrzkomórkowego transferu elektronów, czyli zdolności do kongregacji (Kotloski i Gralnick, 2013). W testach redukcji tlenków metali trójwymiarowe rozmieszczenie komórek i ich ruchliwość mogą w znacznym stopniu wpływać na redukcję metalu z powodu prędkości wytrząsarki inkubatora, wymiarów kolby hodowlanej lub mieszania. Zachowania związane z gromadzeniem się komórek bezpośrednio wpływają na ich przyłączanie się do IEAs. Związek między kongregacją a tworzeniem nanopodobnych wyrostków jest wciąż nieznany (Pirbadian i in., 2015), chociaż parametry ruchliwości i kongregacji są rzadko monitorowane w tych badaniach (Gorby i in., 2005; Reguera i in., 2005). Transformacja tych podstawowych genów kongregacji (cymA, mtrB, mtrA, omcA, mcp_pas, i mcp_cache) do innych gatunków bakterii, z pojedynczym polarnym flagellum, może kiedyś poprawić możliwości bioremediacji poprzez możliwość indukowania przyłączania się bakterii i kolonizacji powierzchni, które w przeciwnym razie byłyby trudne lub niemożliwe.
Materiały i metody
Hodowla i szczepy
MR-1 i kilka mutantów delecyjnych wywodzących się z MR-1 zostało zbadanych w tym badaniu (Tabela 2) (Beliaev i Saffarini, 1998; Myers i Myers, 2002). Szczepy inokulowano z zapasów glicerolu przechowywanych w temperaturze -80°C na płytki Luria-Bertani (LB) i hodowano przez noc w temperaturze 30°C. Pojedyncze kolonie wybierano i posiewano na płytki. Następnie wybierano pojedyncze kolonie i inokulowano je do 5 mL zdefiniowanego minimalnego podłoża (M1) (Bretschger i in., 2007) uzupełnionego 18 mM mleczanem jako źródłem energii (Bretschger i in., 2007) w probówkach o pojemności 15 mL (VWR International LLC, Randor, Pennsylvania, USA) i inkubowano w pozycji poziomej w wytrząsarce (180 rpm) przez 48 h w temperaturze 30°C. Gęstość optyczną mierzono za pomocą spektrofotometru (spektrofotometr Unico 1100RS, Dayton, New Jersey, USA). Próbki komórek pobierano przy OD600 równym 0,5 ± 0,2 (po ~48 h). W eksperymentach pływackich, pięciomililitrowe hodowle pobierano, gdy komórki osiągnęły OD 0,4, mieszano je z tlenkami manganu lub żelaza i wprowadzano do szklanej kapilary (0,02 × 0,20 mm) (Vitrocom, Mountain Lakes, New Jersey, USA), którą następnie uszczelniano za pomocą smaru próżniowego, jak opisano wcześniej (Harris i in, 2010).
Synteza minerałów
Roztwór podstawowy Fe(OH)3 został przygotowany zgodnie z protokołem Cornella i Schwertmanna, a następnie zweryfikowany przez defrakcję rentgenowską (Schwertmann i Cornell, 2008). Przygotowanie koloidalnego MnO2 rozpoczęto od rozpuszczenia 8 g KMnO4 w 200 mL, przy zachowaniu wszelkich możliwych środków ostrożności. Roztwór był stale mieszany przy użyciu mieszadła magnetycznego na wysokim poziomie i podgrzewany poniżej temperatury wrzenia. Następnie dodano 5 mL 10 M wodorotlenku sodu, aby zneutralizować kwas powstały w wyniku reakcji. W oddzielnej kolbie rozpuszczono 15 g chlorku manganu w 75 mL wody destylowanej. Następnie roztwór ten powoli mieszano z roztworem nadmanganianu (w dygestorium chemicznym) przez 75 min. Po schłodzeniu roztworu, został on następnie przemyty przez odwirowanie i pięciokrotnie przepłukany wodą dejonizowaną (DI) (18 Meg-Ohm cm). Końcowy osad pozostawiono do wyschnięcia przez filtr próżniowy w czystej ławce i suszono przez 36 h. Otrzymane minerały analizowano metodą dyfrakcji rentgenowskiej w celu potwierdzenia produkcji Fe(OH)3 i MnO2 (Bretschger et al., 2007; Salas et al., 2010).
Zawiesiny cząstek mineralnych mieszano z kulturą w końcowym stężeniu 300 mg/mL MnO2 lub Fe(OH)3. Następnie komórki zanurzano kapilarnie w prostokątnych rurkach kapilarnych (0,02 × 0,20 mm) (Vitrocom, Mountain Lakes, New Jersey, USA). Probówki uszczelniano silikonowym smarem próżniowym (Dow Corning, Midland, Milwaukie, USA) i obserwowano za pomocą mikroskopii świetlnej, mikroskopii fluorescencyjnej i mikroskopii konfokalnej.
Cell Accumulation after Photo-Bleaching (CAAP) Time-Lapse Experiments
Wszystkie szczepy znakowane fluorescencyjnie (GFP) transformowano zgodnie z wcześniejszym opisem (McLean i in., 2008), a następnie hodowane w warunkach tlenowych na zdefiniowanym podłożu minimalnym z 25 μg/ml kanamycyny i 18 mM mleczanu przez 48 h w 30°C. Z pięciomililitrowych hodowli pobierano próbki, gdy komórki osiągały OD 0,4, mieszano je z tlenkami manganu lub żelaza i wprowadzano do szklanej kapilary (0,02 × 0,20 mm) (Vitrocom, Mountain Lakes, New Jersey, USA), którą następnie uszczelniano za pomocą smaru próżniowego, jak opisano wcześniej (Harris i in., 2010). Oznakowane GFP komórki WT MR-1, ΔcymA, Δmcp_cache i ΔmtrBC/omcA wybielano przy użyciu ustawień maksymalnej intensywności światła z obiektywem 60X w odwróconym mikroskopie konfokalnym Leica TCS SPE (Wetzlar, Niemcy) przez 15 min. Aby upewnić się, że wybielanie miało miejsce, poklatkowo przechwytywano obszar ekranu (250 × 250 μm wybranego obszaru) co minutę, aż oryginalne komórki wydawały się ciemne, a otaczające je komórki pozostawały jasno fluorescencyjne. Obrazy były następnie rejestrowane przy użyciu wzbudzenia 588 nm i emisji 530 nm. Film poklatkowy z całego przekroju probówki był rejestrowany przy użyciu oprogramowania Leica Imaging i funkcji „auto focus” przez następne 3 h. Komórki były również obserwowane w trybie światła przechodzącego w celu sprawdzenia, czy wybielone komórki były ruchliwe i nienaruszone. Oddzielna kontrola negatywna, ze znakowaną GFP Δmcp_cache, była rejestrowana przez 3 h. W tej kontroli negatywnej nie zaobserwowano komórek gromadzących się w strefie ciemnej, ani też wybielone komórki nie odzyskały fluorescencji GFP. Odpowiedź całej kapilary (wysokość 30 μm) została uchwycona przy użyciu fotografii poklatkowej, a suma komórek we wszystkich 20 stosach osi z została określona (przy użyciu metody analizy komputerowej poniżej) dla każdego punktu czasowego.
Mikroskopowe uchwycenie ruchów komórek
Metody śledzenia i analizy bakterii były identyczne z poprzednimi badaniami wykorzystanymi do Figury 3 i odnotowanymi w Tabeli 3 (Harris et al., 2012). Zarówno komputerowe jak i ręczne ślady pływania bakterii były standaryzowane przy użyciu linijki ze skalą (100 μm). W każdym eksperymencie zarejestrowano ogólną aktywność pływacką w obrębie klatki wideo – co odpowiada polu widzenia 107 × 193 μm – a wideo znormalizowano w czasie, aby podać prędkości pływania w μm/s. Kilka parametrów zostało zmierzonych dla każdego toru pływania bakterii, takich jak całkowita odległość poruszania się, czas toru od pierwszego pojawienia się i zniknięcia bakterii, liczba nawrotów, odległość pomiędzy każdym nawrotem a tlenkiem metalu oraz odległość pomiędzy tlenkiem metalu a początkiem toru bakterii.
Analiza pływania
Komórki były śledzone ręcznie z danych wideo (30 klatek/s), klatka po klatce, i mierzone przez oprogramowanie do analizy obrazu ImageJ. Dane wejściowe obejmują prędkość pływania, pozycję wyjściową bakterii w odniesieniu do najbliższej powierzchni MAE, a pozycja każdego zdarzenia cofania się bakterii została zidentyfikowana i zarejestrowana w odniesieniu do odległości od najbliższej powierzchni MAE (Rysunek 3 i Tabela 3). W celu określenia aktywności pływania po kontakcie z IEA, pływające komórki podzielono na dwie grupy do analizy: komórki, które pływały w odległości do 2 μm od cząsteczki uznano za „kontaktowe”, a te, które nie pływały w odległości do 2 μm od powierzchni cząsteczki uznano za „niekontaktowe”. Oprócz opisanych powyżej metod śledzenia dłoni, dane eksperymentalne zostały następnie posortowane komputerowo i przeanalizowane przez algorytm wcześniej opisany w celu uzyskania obliczonych danych dotyczących pływania (Crocker i Grier, 1996; Harris i in., 2012; Harris, 2013). Aby stworzyć ryciny 3, 4, wszystkie dane eksperymentalne z czterech oddzielnych replik biologicznych zostały połączone, zebrane i uśrednione w przedziały według odległości od cząstki IEA. Ponieważ dane te zostały połączone w odległości, słupki błędów nakładają się na siebie; nie można dokonać porównania częstotliwości odwracania, w danej odległości, między szczepami, ponieważ ta metoda wizualizacji wyklucza identyfikatory eksperymentów.
Wkład autorów
HH: zaprojektował i wykonał eksperymenty; HH i IS-A: napisał i poprawił papier; ES, ME-N, i JM: pomogli zaprojektować eksperymenty; WT: pomógł wykonać analizę danych; JM i KN: poprawili manuskrypt.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Szczególne podziękowania dla Mandy J. Ward i Gijsa Kuenena za porady dotyczące badań i projektowania eksperymentów. Dziękujemy Meaghan Sullivan za jej ręczne analizy śledzenia. Dziękujemy Cecile Jourlin-Castelli, Samantha Reed, Jun Li i Davidowi Culley za dostarczenie mutantów Δmcp_cache, ΔmtrBC/omcA i ΔcymA. Finansowanie tej pracy zostało zapewnione przez Air Force Office of Scientific Research Award . Badania IS-A były wspierane przez stypendium NASA Planetary Biology Internship.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fmicb.2017.02568/full#supplementary-material
Alexandre, G., Greer-Phillips, S., and Zhulin, I. B. (2004). Ecological role of energy taxis in microorganisms. FEMS Microbiol. Rev. 28, 113-126. doi: 10.1016/j.femsre.2003.10.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Baraquet, C., Théraulaz, L., Iobbi-Nivol, C., Méjean, V., and Jourlin-Castelli, C. (2009). Unexpected chemoreceptors mediate energy taxis towards electron acceptors in Shewanella oneidensis. Mol. Microbiol. 73, 278-290. doi: 10.1111/j.1365-2958.2009.06770.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Beliaev, A. S., and Saffarini, D. A. (1998). Shewanella putrefaciens mtrB encodes an outer membrane protein required for Fe(III) and Mn(IV) Reduction. J. Bacteriol. 180, 6292-6297.
PubMed Abstract | Google Scholar
Bencharit, S., and Ward, M. J. (2005). Chemotactic responses to metals and anaerobic electron acceptors in Shewanella oneidensis MR-1. J. Bacteriol. 187, 5049-5053. doi: 10.1128/JB.187.14.5049-5053.2005
PubMed Abstract | CrossRef Full Text | Google Scholar
Bond, D. R., and Lovley, D. R. (2003). Electricity production by Geobacter sulfurreducens attached to electrodes. Appl. Environ. Microbiol. 69, 1548-1555. doi: 10.1128/AEM.69.3.1548-1555.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bowman, J. P., McCammon, S. A., Nichols, D. S., Skerratt, J. H., Rea, S. M., Nichols, P. D., et al. (1997). Shewanella gelidimarina sp. nov. and Shewanella frigidimarina sp. nov., novel antarctic species with the ability to produce eicosapentaenoic acid (20:5ω3) and grow anaerobically by dissimilatory Fe(III) reduction. Int. J. Syst. Bacteriol. 47, 1040-1047. doi: 10.1099/00207713-47-4-1040
PubMed Abstract | CrossRef Full Text | Google Scholar
Bretschger, O. (2008). Electron Transfer Capability and Metabolic Processes of the Genus Shewanella with Applications to the Optimization of Microbial Fuel Cells. University of Southern California, ProQuest Dissertations Publishing, 3325185.
Google Scholar
Bretschger, O., Obraztsova, A., Sturm, C. A., Chang, I. S., Gorby, Y. A., Reed, S. B., et al. (2007). Current production and metal oxide reduction by Shewanella oneidensis MR-1 wild type and mutants. Appl. Environ. Microbiol. 73:7003. doi: 10.1128/AEM.01087-07
PubMed Abstract | CrossRef Full Text | Google Scholar
Brettar, I., Christen, R., and Höfle, M. G. (2002). Shewanella denitrificans sp nov., a vigorously denitrifying bacterium isolated from the oxic-anoxic interface of the Gotland Deep in the central Baltic Sea. Int. J. Syst. Evol. Microbiol. 52, 2211-2217. doi: 10.1099/00207713-52-6-2211
PubMed Abstract | CrossRef Full Text | Google Scholar
Burdige, D. J. (1993). The biogeochemistry of manganese and iron reduction in marine sediments. Earth Sci. Rev. 35, 249-284. doi: 10.1016/0012-8252(93)90040-E
CrossRef Full Text | Google Scholar
Champine, J. E., Underhill, B., Johnston, J. M., Lilly, W. W., and Goodwin, S. (2000). Electron transfer in the dissimilatory iron-reducing bacterium Geobacter metallireducens. Anaerobe 6, 187-196. doi: 10.1006/anae.2000.0333
CrossRef Full Text | Google Scholar
Childers, S. E., Ciufo, S., and Lovley, D. R. (2002). Geobacter metallireducens accesses insoluble Fe(III) oxide by chemotaxis. Nature 416, 767-769. doi: 10.1038/416767a
PubMed Abstract | CrossRef Full Text | Google Scholar
Coursolle, D., and Gralnick, J. A. (2010). Modularity of the Mtr respiratory pathway of Shewanella oneidensis strain MR-1. Mol. Microbiol. 77, 995-1008. doi: 10.1111/j.1365-2958.2010.07266.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Crocker, J. C., and Grier, D. G. (1996). Metody cyfrowej mikroskopii wideo do badań koloidalnych. J. Colloid Interface Sci. 179, 298-310. doi: 10.1006/jcis.1996.0217
CrossRef Full Text | Google Scholar
El-Naggar, M. Y., Wanger, G., Leung, K. M., Yuzvinsky, T. D., Southam, G., Yang, J., et al. (2010). Transport elektryczny wzdłuż bakteryjnych nanowirów z Shewanella oneidensis MR-1. Proc. Natl Acad. Sci. U.S.A. 107, 18127-18131. doi: 10.1073/pnas.1004880107
PubMed Abstract | CrossRef Full Text | Google Scholar
Fredrickson, J. K., Romine, M. F., Beliaev, A. S., Auchtung, J. M., Driscoll, M. E., Gardner, T. S., et al. (2008). Towards environmental systems biology of Shewanella. Nat. Rev. Microbiol. 6, 592-603. doi: 10.1038/nrmicro1947
PubMed Abstract | CrossRef Full Text | Google Scholar
Fredrickson, J. K., Zachara, J. M., Kennedy, D. W., Dong, H., Onstott, T. C., Hinman, N. W., et al. (1998). Biogenic iron mineralization accompanying the dissimilatory reduction of hydrous ferric oxide by a groundwater bacterium. Geochim. Cosmochim. Acta 62, 3239-3257. doi: 10.1016/S0016-7037(98)00243-9
CrossRef Full Text | Google Scholar
Gao, H., Obraztova, A., Stewart, N., Popa, R., Fredrickson, J. K., Tiedje, J. M., et al. (2006). Shewanella loihica sp. nov., isolated from iron-rich microbial mats in the Pacific Ocean. Int. J. Syst. Evol. Microbiol. 56, 1911-1916. doi: 10.1099/ijs.0.64354-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Gorby, Y. A., Beveridge, T. J., and Wiley, W. R. (2005). „Composition, reactivity, and regulation of extracellular metal-reducing structures (nanowires) produced by dissimilatory metal reducing bacteria,” in Annual NABIR PI Meeting (Warrenton, VA).
Google Scholar
Gorby, Y. A., Yanina, S., McLean, J. S., Rosso, K. M., Moyles, D., Dohnalkova, A., et al. (2006). Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms. Proc. Natl. Acad. Sci. U.S.A. 103, 11358-11363. doi: 10.1073/pnas.0604517103
PubMed Abstract | CrossRef Full Text | Google Scholar
Gross, B. J., and El-Naggar, M. Y. (2015). A combined electrochemical and optical trapping platform for measuring single cell respiration rates at electrode interfaces. Rev. Sci. Instrum. 86:064301. doi: 10.1063/1.4922853
PubMed Abstract | CrossRef Full Text | Google Scholar
Harris, H. W. (2013). Identification of a New Bacterial Sensing Mechanism: Characterization of Bacterial Insoluble Electron Acceptor Sensing. University of Southern California.
Google Scholar
Harris, H. W., El-Naggar, M. Y., Bretschger, O., Ward, M. J., Romine, M. F., Obraztsova, A. Y., et al. (2010). Electrokinesis is a microbial behavior that requires extracellular electron transport. Proc. Natl. Acad. Sci. U.S.A. 107, 326-331. doi: 10.1073/pnas.0907468107
PubMed Abstract | CrossRef Full Text | Google Scholar
Harris, H. W., Naggar, M. Y., and Nealson, K. H. (2012). Shewanella oneidensis MR-1 chemotaxis proteins and electron-transport chain components essential for congregation near insoluble electron acceptors. Biochem. Soc. Trans. 40, 1167-1177. doi: 10.1042/BST20120232
PubMed Abstract | CrossRef Full Text | Google Scholar
Hau, H. H., and Gralnick, J. A. (2007). Ecology and biotechnology of the genus Shewanella. Annu. Rev. Microbiol. 61, 237-258. doi: 10.1146/annurev.micro.61.080706.093257
PubMed Abstract | CrossRef Full Text | Google Scholar
Hsu, L., Masuda, S. A., Nealson, K. H., and Pirbazari, M. (2012). Evaluation of microbial fuel cell Shewanella biocathodes for treatment of chromate contamination. R. Soc. Chem. Adv. 2, 5844-5855. doi: 10.1039/c2ra20478a
CrossRef Full Text | Google Scholar
Kan, J., Hsu, L., Cheung, A. C. M., Pirbazari, M., and Nealson, K. H. (2011). Current production by bacterial communities in microbial fuel cells enriched from wastewater sludge with different electron donors. Environ. Sci. Technol. 45, 1139-1146. doi: 10.1021/es102645v
PubMed Abstract | CrossRef Full Text | Google Scholar
Kato, S., Nakamura, R., Kai, F., Watanabe, K., and Hashimoto, K. (2010). Respiratory interactions of soil bacteria with (semi)conductive iron-oxide minerals. Environ. Microbiol. 12, 3114-3123. doi: 10.1111/j.1462-2920.2010.02284.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotloski, N. J., and Gralnick, J. A. (2013). Flavin electron shuttles dominate extracellular electron transfer by Shewanella oneidensis. MBio 4:e00553. doi: 10.1128/mBio.00553-12
PubMed Abstract | CrossRef Full Text | Google Scholar
Kracke, F., Vassilev, I., and Krömer, J. O. (2015). Microbial electron transport and energy conservation – the foundation for optimizing bioelectrochemical systems. Front. Microbiol. 6:575. doi: 10.3389/fmicb.2015.00575
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Go, A. C., Ward, M. J., and Ottemann, K. M. (2010). The chemical-in-plug bacterial chemotaxis assay is prone to false positive responses. BMC Res. Notes 3:77. doi: 10.1186/1756-0500-3-77
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Romine, M. F., and Ward, M. J. (2007). Identification and analysis of a highly conserved chemotaxis gene cluster in Shewanella species. FEMS Microbiol. Lett. 273, 180-186. doi: 10.1111/j.1574-6968.2007.00810.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, R., Tiedje, J. M., Chiu, C., and Worden, R. M. (2012). Soluble electron shuttles can mediate energy taxis toward insoluble electron acceptors. Environ. Sci. Technol. 46, 2813-2820. doi: 10.1021/es204302w
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovley, D. R., Coates, J. D., Blunt-Harris, E. L., Phillips, E. J. P., and Woodward, J. C. (1996). Humic substances as electron acceptors for microbial respiration. Nature 382, 445-448. doi: 10.1038/382445a0
CrossRef Full Text | Google Scholar
Lovley, D. R., Giovannoni, S. J., White, D. C., Champine, J. E., Phillips, E. J., Gorby, Y. A., et al. (1993). Geobacter metallireducens gen. nov. sp. nov., a microorganism capable of coupling the complete oxhidation of organic compounds to the reduction of iron and other metals. Arch. Microbiol. 159, 336-344. doi: 10.1007/BF00290916
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovley, D. R., Holmes, D. E., and Nevin, K. P. (2004). Dissimilatory Fe(III) and Mn(IV) reduction. Adv. Microb. Physiol. 49, 219-286. doi: 10.1111/j.1462-2920.2004.00593.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Marsili, E., Baron, D. B., Shikhare, I. D., Coursolle, D., Gralnick, J. A., Bond, D. R., et al. (2008). Shewanella secretes flavins that mediate extracellular electron transfer. Proc. Natl. Acad. Sci. U.S.A. 105, 3968-3973. doi: 10.1073/pnas.0710525105
PubMed Abstrakt | CrossRef Full Text | Google Scholar
McLean, J. S., Majors, P. D., Reardon, C. L., Bilskis, C. L., Reed, S. B., Romine, M. F., et al. (2008). Investigations of structure and metabolism within Shewanella oneidensis MR-1 biofilms. J. Microbiol. Methods 74, 47-56. doi: 10.1016/j.mimet.2008.02.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Meyer, T. E., Tsapin, A. I., Vandenberghe, I., de Smet, L., Frishman, D., Nealson, K. H., et al. (2004). Identification of 42 possible cytochrome C genes in the Shewanella oneidensis genome and characterization of six soluble cytochromes. Omics 8, 57-77. doi: 10.1089/153623104773547499
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitchell, A. C., Peterson, L., Reardon, C. L., Reed, S. B., Culley, D. E., Romine, M. R., et al. (2012). Role of outer membrane c-type cytochromes MtrC and OmcA in Shewanella oneidensis MR-1 cell production, accumulation, and detachment during respiration on hematite. Geobiology 10, 355-370. doi: 10.1111/j.1472-4669.2012.00321.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Murray, A. E., Lies, D., Li, G., Nealson, K., Zhou, J., and Tiedje, J. M. (2001). DNA/DNA hybridization to microarrays reveals gene-specific differences between close related microbial genomes. Proc. Natl. Acad. Sci. U.S.A. 98, 9853-9858. doi: 10.1073/pnas.171178898
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Myers, J. M. (1997). Cloning and sequence of cymA, a gene encoding a tetraheme cytochrome c required for reduction of iron(III), fumarate, and nitrate by Shewanella putrefaciens MR-1. J. Bacteriol. 179, 1143-1152. doi: 10.1128/jb.179.4.1143-1152.1997
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Myers, J. M. (2002). MtrB Is required for proper incorporation of the cytochromes OmcA and OmcB into the outer membrane of Shewanella putrefaciens MR-1. Appl. Environ. Microbiol. 68, 5585-5594. doi: 10.1128/AEM.68.11.5585-5594.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Nealson, K. H. (1988a). Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science 240, 1319-1321. doi: 10.1126/science.240.4857.1319
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, C. R., and Nealson, K. H. (1988b). Microbial reduction of manganese oxides: Interactions with iron and sulfur. Geochim. Cosmochim. Acta 52, 2727-2732. doi: 10.1016/0016-7037(88)90041-5
CrossRef Full Text | Google Scholar
Myers, J. M., and Myers, C. R. (2001). Role for outer membrane cytochromes OmcA and OmcB of Shewanella putrefaciens MR-1 in reduction of manganese dioxide. Appl. Environ. Microbiol. 67, 260-269. doi: 10.1128/AEM.67.1.260-269.2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Nealson, K. H., Moser, D. P., and Saffarini, D. A. (1995). Anaerobic electron acceptor chemotaxis in Shewanella putrefaciens. Appl. Environ. Microbiol. 61, 1551-1554.
PubMed Abstract | Google Scholar
Okamoto, A., Kalathil, S., Deng, X., Hashimoto, K., Nakamura, R., and Nealson, K. H. (2014). Cell-secreted flavins bound to membrane cytochromes dictate electron transfer reactions to surfaces with diverse charge and pH. Sci. Rep. 4:5628. doi: 10.1038/srep05628
PubMed Abstract | CrossRef Full Text | Google Scholar
Pirbadian, S., Barchinger, S. E., Leung, K. M., Byun, H. S., Jangir, Y., Bouhenni, R. A., et al. (2015). Bacterial nanowires of Shewanella oneidensis MR-1 are outer membrane and periplasmic extensions of the extracellular electron transport components. Biophys. J. 108:368a. doi: 10.1016/j.bpj.2014.11.2016
CrossRef Full Text | Google Scholar
Reguera, G., McCarthy, K. D., Mehta, T., Nicoll, J. S., Tuominen, M. T., Lovely, D. R., et al. (2005). Extracellular electron transfer via microbial nanowires. Nature 435, 1098-1101. doi: 10.1038/nature03661
PubMed Abstract | CrossRef Full Text | Google Scholar
Salas, E. C., Berelson, W. M., Hammond, D. E., Kampf, A. R., and Nealson, K. H. (2010). The impact of bacterial strain on the products of dissimilatory iron reduction. Geochim. Cosmochim. Acta 74, 574-583. doi: 10.1016/j.gca.2009.10.039
PubMed Abstract | CrossRef Full Text | Google Scholar
Saltikov, C. W., Cifuentes, A., Venkateswaran, K., and Newman, D. K. (2003). The ars detoxification system is advantageous but not required for As(V) respiration by the genetically tractable Shewanella species strain ANA-3. Appl. Environ. Microbiol. 69, 2800-2809. doi: 10.1128/AEM.69.5.2800-2809.2003
CrossRef Full Text | Google Scholar
Schwalb, C., Chapman, S. K., and Reid, G. A. (2003). The tetraheme cytochrome CymA is required for anaerobic respiration with dimethyl sulfoxide and nitrite in Shewanella oneidensis. Biochemistry 42, 9491-9497. doi: 10.1021/bi034456f
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwertmann, U., and Cornell, R. M. (2008). Iron Oxides in the Laboratory. Weinheim: John Wiley & Sons.
Google Scholar
Shi, L., Richardson, D. J., Wang, Z., Kerisit, S. N., Rosso, K. M., Zachara, J. M., et al. (2009). The roles of outer membrane cytochromes of Shewanella and Geobacter in extracellular electron transfer. Environ. Microbiol. Rep. 1, 220-227. doi: 10.1111/j.1758-2229.2009.00035.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Venkateswaran, K., Dollhopf, M. E., Aller, R., Stackebrandt, E., and Nealson, K. H. (1998). Shewanella amazonensis sp. nov., a novel metal-reducing facultative anaerobe from Amazonian shelf muds. Int. J. Syst. Bacteriol. 48, 965-972.
PubMed Abstract | Google Scholar
Venkateswaran, K., Moser, D. P., Dollhopf, M. E., Lies, D. P., Saffarini, D. A., MacGregor, B. J., et al. (1999). Polyphasic taxonomy of the genus Shewanella and description of Shewanella oneidensis sp. nov. Int. J. Syst. Bacteriol. 49, 705-724. doi: 10.1099/00207713-49-2-705
PubMed Abstract | CrossRef Full Text | Google Scholar
Ziemke, F., Höfle, M. G., Lalucat, J., and Rossellö-Mora, R. (1998). Reclassification of Shewanella putrefaciens Owen’s genomic group II as Shewanella baltica sp. nov. Int. J. Syst. Bacteriol. 48, 179-186. doi: 10.1099/00207713-48-1-179
PubMed Abstract | CrossRef Full Text | Google Scholar
.