Introduction
Stosowanie naturalnych środków leczniczych jest starożytną tradycją nadal praktykowaną, przy czym >60% światowej populacji zajmuje się różnymi problemami zdrowotnymi, w tym nowotworami, stosując medycynę tradycyjną jako pierwszy wybór (Sultana et al., 2014). Jednak leczenie nowotworów jest złożone, a obecne możliwości dla pacjentów zależą od rodzaju i stadium nowotworu, oprócz wieku, płci i ogólnego stanu zdrowia pacjenta. Chociaż chemioterapia jest zwykle skuteczna we wczesnych stadiach raka, jej skuteczność zależy od schematu podawania leku i stanu fizjologicznego pacjenta. Niemniej jednak, głównym problemem związanym z chemioterapią jest jej toksyczność, ponieważ stosowane leki mają tendencję do wpływania na komórki nowotworowe, jak również na komórki prawidłowe, z wysokim indeksem proliferacyjnym generującym uszkodzenia uboczne u pacjentów. Co więcej, komórki nowotworowe mogą rozwinąć oporność na leczenie, dając przerzuty, a tym samym osłabiając odpowiedź na leczenie i zmniejszając możliwość przeżycia wolnego od choroby. Dlatego jednym z kluczowych wyzwań w odkrywaniu leków jest zmniejszenie toksyczności środków chemioterapeutycznych i opracowanie bardziej skutecznych i wydajnych leków w celu poprawy leczenia, czasu powrotu do zdrowia i ogólnej jakości życia pacjentów.
Produkty naturalne stanowią bogate źródło struktur chemicznych do rozwoju terapii przeciwnowotworowych. W dziedzinie farmacji onkologicznej 49% leków stosowanych w chemioterapii pochodzi ze źródeł naturalnych, takich jak rośliny, mikroorganizmy i organizmy morskie, lub jest przez nie inspirowanych (Newman i Cragg, 2016). Przykłady obejmują alkaloidy vinca i taksany (środki wiążące tubulinę), a także podofilotoksyny, antracykliny i etopozydy (inhibitory topoizomerazy) (Da Rocha i in., 2001; Nobili i in., 2009). Przykłady te ilustrują potencjał produktów naturalnych w odkrywaniu leków.
AAs są wtórnymi metabolitami wytwarzanymi przez rodzinę Annonaceae (Rysunek 1). W medycynie tradycyjnej owoce z rodzaju Annona są stosowane w leczeniu gorączki, bólu, reumatyzmu, biegunki i zapalenia stawów, a ich liście w leczeniu cukrzycy, bólów głowy i bezsenności (Moghadamtousi et al., 2015a). Annona reticulate była stosowana w Afryce jako środek przeciwdysenteryczny i przeciwrobaczy, a A. squamosa jest wykorzystywana w Indiach do leczenia różnych schorzeń, w tym nowotworów złośliwych (Savithramma i in., 2011). Ponadto, A. muricata jest popularnym środkiem leczniczym w Ameryce, Afryce i Indiach w leczeniu nowotworów (Moghadamtousi et al., 2015a), natomiast w Meksyku A. macroprophyllata, A. muricata i A. purpurea są stosowane w leczeniu guzów skóry i raka żołądka (Alonso-Castro et al., 2011; Brindis et al., 2013). Według etnofarmakologicznego przeglądu roślin leczniczych w Meksyku, rodzaj Annona może być również badany w leczeniu raka jelita grubego (Jacobo-Herrera i in., 2016). Dowody te wskazują, że AA są molekułami o znaczącym potencjale bioaktywnym.

Rysunek 1 Jądro acetogenin: liniowe, epoksydowe, mono-tetrahydrofuran (THF), bis-THF i tris-THF.
Do tej pory opisano ponad 500 AA; związki te charakteryzują się długim łańcuchem alifatycznym z α, β-nienasyconym pierścieniem γ-laktonowym i 0-3 pierścieniami tetrahydrofuranu (THF) (Yuan i in., 2015), i wykazały aktywność cytotoksyczną wobec różnych ludzkich linii komórkowych raka (tj. płuc, piersi, okrężnicy, nerek, trzustki, prostaty, wątroby i pęcherza moczowego) (przegląd w Zeng i in., 1996; Chávez i Mata, 1998; Wang et al., 2002; Yuan et al., 2003; Mangal et al., 2016; Miao et al., 2016a; Miao et al., 2016b) oprócz aktywności przeciwnowotworowej in vivo (Chen et al., 2012a; Chen et al., 2012b). W niniejszym artykule dokonaliśmy przeglądu najnowszych doniesień na temat AAs w dziedzinie odkrywania leków w onkologii.
Materiały i Metody
Wykonaliśmy wyszukiwanie w bazie PubMed z użyciem następujących terminów kluczowych: „acetogeniny i rak”, „acetogeniny aktywność antytumorowa”, „acetogeniny cytotoksyczność” i „acetogeniny mechanizm działania”, wśród innych kombinacji. Dokonaliśmy przeglądu artykułów opublikowanych w ciągu ostatnich 15 lat, które opierały się na dwóch kryteriach: rośliny o zastosowaniu leczniczym oraz metodologia frakcjonowania wspomagana testami biologicznymi. Dane in vitro są oparte wyłącznie na aktywności czystych związków, podczas gdy w badaniach in vivo, ekstrakty ziołowe były również brane pod uwagę ze względu na brak badań w modelach zwierzęcych.
Wyniki i dyskusja
Badania in vitro
W dziedzinie produktów naturalnych, poszukiwanie bioaktywnych cząsteczek zazwyczaj wiąże się z frakcjonowaniem ekstraktów metodą bioassay-guided w celu znalezienia głównej cząsteczki lub cząsteczek odpowiedzialnych za aktywność. Jednakże, wiele wtórnych metabolitów może być ukierunkowanych na wiele cech nowotworów. Ogólnie rzecz biorąc, przemysł farmaceutyczny jest zainteresowany lekami, które wykazują więcej niż jedną interakcję molekularną i obejmują różne cele molekularne.
Acetogeniny są cząsteczkami o wielkim potencjale dla przyszłej terapii przeciwnowotworowej. Ich najbardziej znaczącą aktywnością biologiczną jest hamowanie mitochondrialnego Kompleksu I dzięki ich strukturze bis-THF. Rzeczywiście, wcześniej stwierdzono, że mono-THF AAs posiadające łańcuch alkilowy łączący cząsteczkę laktonową z grupą THF są niekompetycyjnymi inhibitorami kompleksu I (tj. oksydoreduktazy NADH: ubichinon) w łańcuchu oddechowym, co prowadzi do blokady fosforylacji oksydacyjnej i w konsekwencji do zmniejszenia produkcji ATP (Tormo i in., 1999; Chen i in., 2012). Takie zahamowanie obejmuje dużą grupę szlaków, które mogą indukować śmierć komórki, w tym apoptozę i autofagię, lub działać w innych sieciach metabolicznych jako inhibitory enzymu dehydrogenazy mleczanowej A, jako przeciwutleniacz lub poprzez zatrzymanie cyklu komórkowego.
Co więcej, A. muricata (Moghadamtousi i in., 2015a) i A. squamosa L. (Chen et al., 2012a; Chen et al., 2012b; Chen et al., 2012c; Chen et al., 2016) zostały zgłoszone, aby mieć aktywność cytotoksyczną przeciwko kilku ludzkim lub innym liniom komórek nowotworowych ssaków. W szczególności, AA annosquatins A (1) i B (2) wykazują selektywność wobec linii komórkowych MCF-7 i A-549, odpowiednio (Chen et al., 2012c). W tabeli 1 przedstawiono ostatnio odkryte AA wykazujące aktywność cytotoksyczną, a także inne, mniej aktualne związki, które wykazują aktywność przeciwnowotworową in vivo (tabela 2).
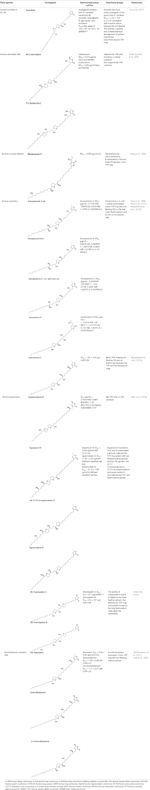
Tabela 1 Aktywność cytotoksyczna acetogenin in vitro w różnych nowotworowych liniach komórkowych.

Tabela 2 Aktywność przeciwnowotworowa in vivo acetogenin i wybranych ekstraktów bogatych w acetogeniny.
Apoptoza jest naturalną strategią śmierci komórkowej, która zabija niepotrzebne lub uszkodzone komórki. Głównymi genami zaangażowanymi w ten proces są p53 i rodzina bcl2; pierwszy z nich jest supresorem nowotworu, natomiast drugi może być proapoptotyczny (m.in. BAD, BAX i BAK) lub antyapoptotyczny (bcl2, i bcl-x) (Okada i Mak, 2004). Podstawową funkcją p53 jest zapobieganie replikacji komórek z uszkodzeniami DNA. Dlatego p53 jest nieaktywny, a uszkodzone komórki nadal rosną i replikują mutacje DNA, co prowadzi do chorób takich jak nowotwory (Igney i Krammer, 2002; Okada i Mak, 2004). Dlatego też dotychczasowe badania można podzielić na dwa główne tematy: indukcja apoptozy lub mechanizmy oporności na apoptozę.
Obecne chemioterapeutyki indukujące apoptozę powodują poważne skutki wtórne u pacjentów. W związku z tym priorytetem jest poszukiwanie mniej toksycznych leków, a produkty naturalne mają pomóc w opracowaniu leków modulujących apoptozę. W tym kontekście, AA zwiększają aktywność kaspazy 3 i 8 (efektorów apoptozy), podczas gdy zmniejszają ekspresję survivinu i Bcl-2, zwiększając w ten sposób apoptozę. AA annonacyna (3) promuje apoptozę w komórkach nowotworowych poprzez aktywację szlaków kaspazy 3 i Bax (Yuan i in., 2003), podczas gdy skwamocyna indukuje apoptozę poprzez ekspresję proapoptotycznych genów Bax i Bad, co skutkuje rozszczepieniem PARP i zwiększoną aktywnością kaspazy 3 w komórkach raka pęcherza moczowego T24 (Yuan i in., 2006). Kontrastuje to z wcześniejszymi wynikami, w których skwamocyna nie indukowała apoptozy w komórkach raka piersi, ale hamowała proliferację poprzez blokowanie cyklu komórkowego w fazie G1 (Raynaud i in., 1999).
Metanolowy ekstrakt z A. reticulata hamuje ekspresję kaspaz 6 i 9 w komórkach raka okrężnicy i wątroby (Mondal i in., 2007), podczas gdy organiczne i wodne ekstrakty A. squamosa obniżają ekspresję Bcl-2 w komórkach raka piersi MCF-7 i komórkach białaczki K-562, wskazując na ich działanie jako induktorów apoptozy (Pardhasaradhi et al., 2005). Ponadto ekstrakt z liści A. muricata indukuje ekspresję kaspaz 3 i 9 oraz hamuje proliferację komórek poprzez zmniejszenie fosfo-ERK i fosfo-AKT w komórkach MIA PaCa-2 (Yiallouris et al., 2018).
As prowadzą również do zatrzymania cyklu, co ma wpływ na proliferację komórek nowotworowych. AAs regulują cykl komórkowy w przejściu G1/S poprzez hamowanie ekspresji cykliny D1 w ludzkich komórkach raka wątrobowokomórkowego (Qian i in., 2015). W tym kontekście, ekstrakt z A. muricata zatrzymuje cykl komórkowy w fazie G1 i zmniejsza liczbę komórek w fazie S w sposób zależny od stężenia poprzez zmniejszenie ekspresji cykliny D1, ważnego białka regulacyjnego cyklu komórkowego (Torres i in., 2012). Podobny efekt zaobserwowano w przypadku skwamocyny, która zatrzymuje komórki w fazie G1 w komórkach raka pęcherza moczowego T24 (Yuan i in., 2006). Pomimo istotności cyklu komórkowego, niewiele badań dotyczyło tego, jak AAs wpływają na ten mechanizm.
Glikoliza tlenowa, mechanizm wykorzystywany przez komórki nowotworowe do pozyskiwania energii przy braku tlenu (Figueroa-González i wsp., 2016; García-Castillo i wsp., 2017), jest również celem AAs. Różne białka i enzymy glikolityczne są upregulowane przez HIF-1, ważny czynnik transkrypcyjny zaangażowany w glikolizę tlenową w komórkach nowotworowych. Co ciekawe, ekstrakt z A. muricata obniżył ekspresję HIF-1α i NF-κB, a także poziom transportera glukozy GLUT1 oraz enzymów HKII i LDHA w komórkach raka trzustki (Torres i in., 2012). Ponadto ekstrakt z liści A. muricata wykazywał działanie antyproliferacyjne w nowotworowych liniach komórkowych i promował śmierć komórek poprzez hamowanie pomp NKA i SERCA (Yiallouris i in., 2018).
Z drugiej strony, gen MDR1 koduje glikoproteinę P błony komórkowej, kluczowe białko transporterowe, które ekstruduje leki przeciwnowotworowe z wnętrza komórek, ograniczając w ten sposób ich wewnątrzkomórkową akumulację i zmniejszając ich toksyczność (Figueroa-González et al., 2012). Metabolity wtórne, takie jak flawonole, ginsenozydy, polifenole, alkaloidy i glikozydy żywicy, wykazały interesujące wyniki w modulowaniu P-gp w liniach komórek nowotworowych (Phang i in., 1993; Beck i in., 1988; Silva i in., 2001; Jodoin i in., 2002; Zhou i in., 2004; Figueroa-González i in., 2012). Ponadto, AAs mogą obniżać ekspresję genów MDR1 i MRP1 w lekoopornym ludzkim raku wątrobowokomórkowym, jak również ekspresję topoizomerazy IIα i S-transferazy glutationowejΠ (Qian et al., 2015).
Ostatnio autofagia wzbudziła zainteresowanie jako mechanizm śmierci komórki. Autofagia jest procesem katabolicznym, który komórki eukariotyczne aktywują, gdy znajdują się pod wpływem stresu, takiego jak głodzenie komórek lub obecność patogenów (He i Klionsky, 2009). Podczas tego procesu, komórka przetwarza białka lub niefunkcjonalne organelle w wieloetapowym procesie obejmującym degradację lizosomalną, aby ostatecznie odzyskać homeostazę komórkową (Kenific i Debnath, 2015). Jako takie, deregulacja strumienia autofagii może prowadzić do nowotworów, ponieważ recykling makromolekuł, niefunkcjonalnych organelli i białek zapewnia komórkom nowotworowym wysokie wymagania metaboliczne do proliferacji komórek (Kenific i Debnath, 2015; García-Castillo i in., 2017). W tym scenariuszu autofagia stała się atrakcyjnym celem terapeutycznym, a AAs mogą być zdolne do hamowania tego procesu. Liu i wsp. (2012) donieśli, że związek AA005 (analog acetogeniny) hamował produkcję ATP, aktywował AMPK i blokował szlak mTOR Complex 1, aby w końcu indukować autofagię w komórkach raka jelita grubego i zatrzymać cykl komórkowy w fazie G1. Związek ten jest mimetykiem AA, w którym jednostka eterowa glikolu etylenowego zastępuje dwa pierścienie THF. Taka modalność chemiczna zapewnia wyższą aktywność biologiczną, co jest przykładem plastyczności AAs, którą można uznać za inspirację do tworzenia nowych, silniejszych cząsteczek o różnych celach farmakologicznych.
Antitumor Activity of Acetogenins in Animal Models
Dane dotyczące aktywności przeciwnowotworowej AAs i ekstraktów z Annony są szczególnie obiecujące, ponieważ związki te wykazywały aktywność przeciwnowotworową w modelach zwierzęcych. Badania in vivo dostarczają kluczowych informacji na temat działania leku w całym organizmie i pozwalają ocenić nie tylko ich działanie przeciwnowotworowe, ale także toksyczność w różnych narządach. Co ważne, zwierzęta są obiektami doświadczalnymi, które umożliwiają prowadzenie obserwacji klinicznych, w tym ocenę wyników klinicznych, progresji i przeżycia wolnego od choroby oraz nawrotów choroby.
Octan etylu ekstraktu z A. squamosa, który jest bogaty w AAs 12,15-cis-squamostatin-A (4) i bullatacin (5) zmniejszał wzrost guzów wątrobowokomórkowych u myszy przy maksymalnym wskaźniku hamowania wynoszącym 69,55% w porównaniu z kontrolą pozytywną (cyklofosfamid) (Chen i in., 2012b). Zasugerowano, że konfiguracja cis w jednym ze składników może być odpowiedzialna za aktywność cytotoksyczną preparatu ziołowego. Ponadto, bullatacyna (5) wyizolowana z A. squamosa w dawce 15 μg/kg skutecznie ograniczała wzrost guza u myszy noszących ksenograft S180 i HepS odpowiednio o 65,8 i 63,4%. Wyniki te są lepsze od tych uzyskanych przy zastosowaniu wyższych stężeń taksolu (40 μg/kg). Bullatacyna (5) posiada przylegającą cząsteczkę bis-THF i trzy grupy hydroksylowe, które prawdopodobnie stanowią strukturę bioaktywną (Chen et al., 2012a).
Olej z nasion A. squamosa hamował 53,54% wzrostu guza u myszy noszących komórki H22 (Chen et al., 2016) i zmniejszał ekspresję IL-6, Jak i różnych fosforylowanych transduktorów sygnału i aktywatorów szlaku transkrypcji p-Stat3. Donoszono również, że α, β-nienasycone cząsteczki γ-laktonu obecne w AAs są akceptorami reakcji Michaela (Ji i in., 2012), które hamują aktywację Stat3, celu terapeutycznego zaangażowanego w proliferację komórek, apoptozę, zapalenie i angiogenezę (Cafferkey i Chau, 2016). Ekstrakt z A. muricata spowalniał wzrost guza w ksenograftach trzustki (Yiallouris et al., 2018), zmniejszając przerzuty poprzez obniżenie poziomu metaloproteinazy-9, oraz promując śmierć komórek nowotworowych poprzez nekrozę (Torres i in., 2012). W ksenografcie prostaty, ekstrakt z A. muricata wzbogacony o flawonoidy poprawił biodostępność i wykazał niższą toksyczność niż ekstrakt wzbogacony o AAs (Yang et al., 2015).
Laherradurin (6) i cherimolin-2 (7) zostały wyizolowane z rośliny leczniczej A. diversifolia i przetestowane in vivo przeciwko komórkom raka szyjki macicy i raka jelita grubego (Schlie-Guzmán et al., 2009). Oba AA redukowały rozmiar guzów HeLa z podobnymi wartościami jak doksorubicyna; oba związki wykazywały również aktywność antyproliferacyjną in vitro wobec tej samej linii komórek nowotworowych. Wyniki te są zgodne z innymi doniesieniami, gdzie najbardziej aktywną cząsteczką okazała się laherraduryna (6), która posiada przylegające do siebie cząsteczki bis-THF i strukturę β-hydroksy γ-metylowego γ-laktonu, podczas gdy cherimolina-2 (7), która zawiera nieprzylegające do siebie cząsteczki bis-THF i jednostkę γ-laktonową wykazuje zmniejszoną aktywność przeciwnowotworową. Tabela 2 przedstawia aktywność przeciwnowotworową różnych AA w modelach zwierzęcych.
Badania toksyczności
Doświadczenia z udziałem zwierząt powinny obejmować protokoły ostrej toksyczności doustnej w celu przetestowania substancji chemicznych i zaobserwowania oznak toksyczności; minimalizują one liczbę wymaganych zwierząt, zapewniają prawidłowe podawanie dawek w doświadczeniach i pozwalają uniknąć cierpienia (OECD, 2008). Jednakże, jak dotąd, istnieje niewiele informacji dotyczących toksyczności AAs lub ekstraktów z Annony. Na przykład LD50 dla ekstraktu etanolowego A. muricata u myszy wynosiło 1,67 g/kg według Sousa et al. (2010). Arthur et al. (2011) podali LD50 (<5 g/kg) wodnego ekstraktu, odnotowując, że wyższa dawka może uszkodzić nerki. Zaobserwowano również, że ekstrakt z nasion A. squamosa może powodować uszkodzenie wątroby (Miao i in., 2016b), a ekstrakt z A. muricata wzbogacony o flawonoidy wykazywał zmniejszoną toksyczność w ksenografcie prostaty (Yang i in., 2015). Cherimolin-2 wyizolowany z A. diversifolia wykazywał działanie toksyczne i śmierć w ksenograftach SW480 w dawkach powyżej 5 mg/kg/dzień (Schlie-Guzmán i in., 2009).
Jak wyjaśniono wcześniej, AAs mogą hamować kompleks 1 łańcucha oddechowego poprzez transport łańcucha elektronowego w mitochondriach. AAs przyłączają się i blokują enzym NADH, który jest zwykle nadekspresyjny w komórkach nowotworowych, hamując produkcję ATP, co ostatecznie prowadzi do śmierci komórki. Przypuszczalnie taki mechanizm sugeruje, że AA są „nieszkodliwe” dla normalnych komórek; nadal należy przeprowadzić więcej badań, aby zapewnić selektywność tych cząsteczek.
Wniosek
Chemoterapia nie jest specyficzna dla komórek nowotworowych; powoduje kilka niepożądanych skutków ubocznych, takich jak uszkodzenie normalnych tkanek i narządów. Jednak najważniejszym aspektem konwencjonalnej chemioterapii jest to, że w znacznej liczbie przypadków komórki nowotworowe rozwijają mechanizmy oporności, które umożliwiają progresję guza i powstawanie przerzutów.
Poszukiwanie nowych leków w przyrodzie nie jest niczym nowym. Kilka pochodnych substancji naturalnych jest obecnie stosowanych w leczeniu różnych chorób. Na przykład taksol (paklitaksel), który został odkryty dzięki tradycyjnej wiedzy, jest uważany za najbardziej dochodowy lek przeciwnowotworowy na rynku. Co ciekawe, paklitaksel jest lekiem antymitotycznym, hamującym proliferację komórek w hodowlach komórkowych, ale w nowotworach udokumentowano, że indukuje podziały wielobiegunowe, co pokazuje, że cząsteczka może mieć różne mechanizmy działania w zależności od warunków in vitro lub warunków pacjenta. Alkaloid ten ma 30-letnią historię i ilustruje główne przeszkody w pracy z produktami naturalnymi, ich ograniczoną dostępność biologiczną i koszty produkcji, a także niesamowitą skuteczność w zabijaniu komórek nowotworowych.
Acetogeniny są wszechstronnymi cząsteczkami przeciwnowotworowymi powodującymi śmierć komórek nowotworowych poprzez różne mechanizmy. Mogą modulować wykluczanie leków chemioterapeutycznych z komórek nowotworowych i są silnymi induktorami apoptozy. Ich bioaktywna elastyczność przejawia się w zdolności do regulowania cyklu komórkowego poprzez zatrzymywanie komórek w fazie G1, promowanie apoptozy poprzez hamowanie różnych białek, a nawet indukowanie autofagii. Ponadto, wyróżnia się ich interakcje metaboliczne, szczególnie związane z czynnikami transkrypcyjnymi HIF1 i STAT3 oraz ich reperkusje w zużyciu energii, angiogenezie, zapaleniu i metastazie. Aktywność przeciwnowotworowa AAs in vivo jest obiecująca (przykładem są bullatacyna, laherraduryna i cherimolina-2). Jednakże, dane przedkliniczne nie są wystarczające do uzyskania dobrego zrozumienia farmakodynamiki i kinetyki AAs, a więcej badań ostrej toksyczności i rozpuszczalności jest potrzebnych do zapewnienia bezpieczeństwa i możliwości przeprowadzenia prób klinicznych z udziałem ludzi. Dodatkowo, włączenie różnych ligandów (tj. przeciwciał, witamin i peptydów) lub przygotowanie pochodnych specyficznych dla nowotworów może poprawić aktywność AA i dać bardziej odpowiednie leki.
Wyciągi roślinne są chemicznie złożone, a ich właściwości lecznicze często zależą od interakcji między związkami i ich proporcji w ekstrakcie. Wciąż pozostaje wiele do odkrycia w zakresie wpływu AAs na nowotwory. Dziedzina ta daje szansę na znalezienie nowych cząsteczek do leczenia tej złożonej choroby. Standaryzacja ekstraktów jest zatem możliwą alternatywą dla stosowania suplementów ziołowych, szczególnie w przypadku roślin, których aktywność farmakologiczna opiera się na kombinacji więcej niż jednego związku. Ten mini-przegląd wymienia niektóre wcześniej badane AA, które wykazują aktywność przeciwnowotworową i mogą mieć przyszłość w klinicznych badaniach nad rakiem.
Wkład Autorów
NJ-H przyczynił się do stworzenia koncepcji, napisania i omówienia artykułu; CP-P wniósł znaczący wkład w dyskusję i korektę manuskryptu; VC-T przygotował wszystkie ryciny i tabele; MM-V i AG-E wnieśli wkład w sekcję chemiczną artykułu; AZ-D wniósł znaczący wkład w dyskusję na temat biologii molekularnej artykułu. Wszyscy autorzy omówili, poprawili i zatwierdzili ostateczną wersję manuskryptu do publikacji.
Funding
Ta praca była wspierana przez Consejo Nacional de Ciencia y Tecnología (CONACYT), Meksyk (numer grantu 285884). VC-T był finansowany przez CONACYT (numer grantu doktoranckiego 267787).
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
NJ-H dziękuje CONACYT za finansowanie projektu.
Alonso-Castro, A. J., Villarreal, M. L., Salazar-Olivo, L. A., Gómez-Sánchez, M., Domínguez, F., García-Carrancá, A. (2011). Mexican medicinal plants used for cancer treatment: pharmacological, phytochemical and ethnobotanical studies. J. Ethnopharmacol. 133, 945-972. doi: 10.1016/j.jep.2010.11.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Arthur, F., Woode, E., Terlabi, E., Larbie, C. (2011). Evaluation of acute and subchronic toxicity of Annona muricata (Linn). aqueous extract in animals. Eur. J. Exp. Biol. 1 (4), 115-124.
Google Scholar
Beck, W. T., Cirtain, M. C., Glover, C. J., Felsted, R. L., Safa, A. R. (1988). Effects of indole alkaloids on multidrug resistance and labeling of P-glycoprotein by a photo affinity analog of vinblastine. Biochem. Biophys. Res. Commun. 153, 959-966. doi: 10.1016/S0006-291X(88)81321-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Brindis, F., González-Trujano, M. E., González-Andrade, M., Aguirre-Hernández, E., Villalobos-Molina, R. (2013). Aqueous extract of Annona macroprophyllata: a potential α-glucosidase inhibitor. Biomed Res. Int. 443 (2), 495-499. doi: 10.1155/2013/591313
CrossRef Full Text | Google Scholar
Cafferkey, C., Chau, I. (2016). Novel STAT3 inhibitors for treating gastric cancer (Nowe inhibitory STAT3 w leczeniu raka żołądka). Expert Opin. Investig. Drugs 25, 1023-1031. doi: 10.1080/13543784.2016.1195807
PubMed Abstract | CrossRef Full Text | Google Scholar
Chávez, D., Mata, R. (1998). Purpurediolin and purpurenin, two new cytotoxic adjacent bis-tetrahydrofuran annonaceous acetogenins from the seeds of Annona purpurea. J. Nat. Prod. 61, 580-584. doi: 10.1021/np970410
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Xu, S., Wang, Y., Li, X., Cai, B., et al. (2012a). Antitumor activity of annonaceous acetogenins in HepS and S180 xenografts bearing mice. Bioorg. Med. Chem. Lett. 22, 2717-2719. doi: 10.1016/j.bmcl.2012.02.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Sh, Xu, Chen, J., Wang, Y., Xu, H., Fan, N., et al. (2012b). Anti-tumor activity of Annona squamosa seeds extract containing annonaceous acetogenin compounds. J. Ethnopharmacol. 142, 462-466. doi: 10.1016/j.jep.2012.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, J., Wang, Y., Xu, S., Li, X. (2012c). Six cytotoxic annonaceous acetogenins from Annona squamosa seeds. Food Chem. 135, 960-966. doi: 10.1016/j.foodchem.2012.05.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, Y., Chen, Y., Shi, Y., Ch, Ma, Wang, X., Li, Y., et al. (2016). Aktywność antytumorowa oleju z nasion Annona squamosa. J. Ethnopharmacol. 193, 362-367. doi: 10.1016/j.jep.2016.08.036
PubMed Abstract | CrossRef Full Text | Google Scholar
Da Rocha, A. B., Lopes, R. M., Schwartsmann, G. (2001). Natural products in anticancer therapy. Curr. Opin. Pharmacol. 1, 364-369. doi: 10.1016/S1471-4892(01)00063-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Elisya, Y., Kardono, L. B. S., Simanjuntak, P. (2014). Formuła tabletki rozpuszczalnego w octanie etylu ekstraktu z liści soursop (Annona muricata L). AJAS 2 (3), 323-329.
Google Scholar
Figueroa-González, G., Jacobo-Herrera, N., Zentella-Dehesa, A., Pereda-Miranda, R. (2012). Reversal or multidrug resistance by morning glory resin glycosides in human breast cancer cells. J. Nat. Prod. 75 (1), 93-97. doi: 10.1021/np200864m
PubMed Abstract | CrossRef Full Text | Google Scholar
Figueroa-González, G., García-Castillo, V., Coronel-Hernández, J., López-Urrutida, E., León-Cabrera, S., Arias-Romero, L. E., et al. (2016). Przeciwzapalna i przeciwnowotworowa aktywność potrójnej terapii dla raka jelita grubego związanego z zapaleniem jelita grubego. J. Cancer 7 (12), 1632-1644. doi: 10.7150/jca.13123
PubMed Abstract | CrossRef Full Text | Google Scholar
García-Castillo, V., López-Urrutia, E., Villanueva-Sánchez, O., Ávila-Rodríguez, MÁ, Zentella-Dehesa, A., Cortés-González, C., et al. (2017). Targeting metabolic remodeling in triple negative breast cancer in a murine model. J. Cancer 8 (2), 178-189. doi: 10.7150/jca.16387
PubMed Abstract | CrossRef Full Text | Google Scholar
He, C., Klionsky, D. J. (2009). Regulation mechanisms and signaling pathways of autophagy. Annu. Rev. Genet. 43, 67-93. doi: 10.1146/annurev-genet-102808-114910
PubMed Abstract | CrossRef Full Text | Google Scholar
Igney, F. H., Krammer, P. H. (2002). Śmierć i anty-śmierć: oporność nowotworów na apoptozę. Nat. Rev. Cancer 2 (4), 277-288. doi: 10.1038/nrc776
PubMed Abstract | CrossRef Full Text | Google Scholar
Jacobo-Herrera, N. J., Jacobo-Herrera, F. E., Zentella-Dehesa, A., Andrade-Cetto, A., Heinrich, M., Pérez-Plasencia, C. (2016). Rośliny lecznicze stosowane w meksykańskiej medycynie tradycyjnej w leczeniu raka jelita grubego. J. Ethnopharmacol. 179, 391-402. doi: 10.1016/j.jep.2015.12.042
PubMed Abstract | CrossRef Full Text | Google Scholar
Ji, L., Yuan, Y., Luo, L., Chen, Z., Ma, X., Ma, Z., et al. (2012). Physalins with anti-inflammatory activity are present in Physalis alkekengi var. franchetii and can function as Michael reaction acceptors. Steroids 77, 441-447. doi: 10.1016/j.steroids.2011.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Jodoin, J., Demeule, M., Béliveau, R. (2002). Inhibition of the multidrug resistance P-glycoprotein activity by green tea polyphenols. Biochim. Biophys. Acta 1542 (1-3), 149-159. doi: 10.1016/S0167-4889(01)00175-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenific, C. M., Debnath, J. (2015). Cellular and metabolic functions for autophagy in cancer cells. Trends Cell Biol. 25 (1), 37-45. doi: 10.1016/j.tcb.2014.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Ko, Y. M., Wu, T. Y., Wu, Y. C. h., Chang, F.r., Guh, J.Y., Chuang, L. Y. (2011). Annonacin induces cell cycle-dependent growth arrest and apoptosis in estrogen receptor-α-related pathways in MCF-7 cells. J. Ethnopharmacol. 137, 1283-1290. doi: 10.1016/j.jep.2011.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Lima, L. A. R. S., Alves, T. M. A., Zani, C. L., Júnior, P. A. S., Romanha, A. J., Johann, S., et al. (2014). Aktywność cytotoksyczna, przeciwgrzybicza, trypanoidalna i leiszmaniobójcza in vitro acetogenin wyizolowanych z Annona cornifolia A. St.-Hil. (Annonaceae). An. Acad. Bras. Cienc. 86 (2), 829-839. doi: 10.1590/0001-3765201420130048
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Cheng, X., Guo, L. X., Ch, Mao, YJ, Chen, Liu, H. X., et al. (2012). Identification of an annonaceous acetogenins mimetic, AA05, as an AMPK activator and autophagy inducer in colon cancer cells. PLoS One 7 (10), e47049-e-47049. doi: 10.1371/journal.pone.0047049
CrossRef Full Text | Google Scholar
Mangal, M., Khan, M. I., Agarwal, S. M. (2016). Acetogeniny jako potencjalne środki przeciwnowotworowe. Anticancer Agents Med. Chem. 16, 138-159. doi: 10.2174/1871520615666150629101827
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Xu, X. F., Chen, Y., Chen, J. W., Li, X. (2016a). Three cytotoxic Annonaceous acetogenins from the seeds of Annona squamosa. Phytochem. Lett. 16, 92-96. doi: 10.1016/j.phytol.2016.03.006
CrossRef Full Text | Google Scholar
Miao, Y. J., Shi, Y. Y., Li, F. Q., Shan, C. h. X., Chen, Y., Chen, J. W., et al. (2016b). Metabolomiczne badania toksyczności Annona squamosa z wykorzystaniem wysokorozdzielczej spektrometrii mas w wysokosprawnej chromatografii cieczowej w połączeniu z metodą rozpoznawania wzorców i analizą szlaków metabolicznych. J. Ethnopharmacol. 184, 187-195. doi: 10.1016/j.jep.2016.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Fadaeinasab, M., Nikzad, S., Mohan, G., Ali, H. M., Kadir, H. A. (2015a). Annona muricata (Annonaceae): a review of its traditional use, isolated acetogenins and biological activities. Int. J. Mol. Sci. 16, 15625-15658. doi: 10.3390/ijms160715625
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghadamtousi, S. Z., Rouhollahi, E., Karimian, H., Fadaeinasab, M., Firoozinia, M., Abdulla, M. A., et al. (2015b). The chemopotential effect of Annona muricata leaves against azoxymethane-induced colonic aberrant crypt foci in rats and the apoptosis effect of acetogenin annomuricin E in HT-29 cells: a bioassay-guided approach. PLoS One 10 (4), e0122288. doi: 10.1371/journal.pone.0122288
PubMed Abstract | CrossRef Full Text | Google Scholar
Mondal, S. K., Mondal, N. B., Mazumder, U. K. (2007). In vitro cytotoxic and human recombinant caspase effect of Annona reticulata leaves. Indian J. Pharmacol. 39, 253-254. doi: 10.4103/0253-7613.37279
CrossRef Full Text | Google Scholar
Newman, D. J., Cragg, G. M. (2016). Produkty naturalne jako źródła nowych leków od 1981 do 2014 roku. J. Nat. Prod. 79 (3), 629-661. doi: 10.1021/acs.jnatprod.5b01055
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobili, S., Lippi, D., Witort, E., Donnini, M., Bausi, L., Mini, E., et al. (2009). Naturalne związki dla leczenia i zapobiegania nowotworom. Pharmacol. Res. 59, 365-378. doi: 10.1016/j.phrs.2009.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
OECD (2008). „Text no. 425: Acute oral toxicity: up and down procedure” w OECD Guildelines for the testing of chemicals, Section 4. OECDiLibrary. https://www.oecd-ilibrary.org/environment/test-no-425-acute-oral-toxicity-up-and-down-procedure_9789264071049_en
Google Scholar
Okada, H., Mak, T. W. (2004). Pathways of apoptotic and non-apoptotic death in tumour cells. Nat. Rev. Cancer 4 (8), 592-603. doi: 10.1038/nrc1412
PubMed Abstract | CrossRef Full Text | Google Scholar
Pardhasaradhi, B. V., Reddy, M., Ali, A. M., Kumari, A. L., Khar, A. (2005). Differential cytotoxic effects of Annona squamosa seed extracts on human tumour cell lines: role of reactive oxygen species and glutathione. J. Biosci. 30, 237-244. doi: 10.1007/BF02703704
PubMed Abstract | CrossRef Full Text | Google Scholar
Phang, J. M., Poore, M., Lopaczynska, J., Yeh, G. C. (1993). Flavonol-stimulate efflux of 7,12-dimethylbenz(a)anthracene in multidrug-resistant breast cancer cells. Cancer Res. 53, 5977-5981.
PubMed Abstract | Google Scholar
Qian, J. Q., Sun, P., Pan, Z. Y., Fang, Z. Z. (2015). Annonaceous acetogenins reverse drug resistance of human hepatocellular carcinoma BEL-7402/5-FU and HepG2/ADM cell lines. Int. J. Clin. Exp. Pathol. 8 (9), 11934-11944.
PubMed Abstract | Google Scholar
Raynaud, S., Némati, F., Miccoli, L., Michel, P., Poupon, M. F., Fourneau, C., et al. (1999). Antitumoral effects of squamocin on parental and multidrug resistant MCF7 (human breast adenocarcinoma) cell lines. Life Sci. 65 (5), 525-533. doi: 10.1016/S0024-3205(99)00273-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Savithramma, N., Rao, M. L., Suhrulatha, D. (2011). Screening of medicinal plants for secondary metabolites. MEJSR 8 (3), 579-584.
Google Scholar
Schlie-Guzmán, M. A., García-Carrancá, A., González-Esquinca, A. R. (2009). In vitro i in vivo antiproliferative activity of laherradurin and cherimolin-2 of Annona diversifolia Saff. Phytother. Res. 23, 1128-1133. doi: 10.1002/ptr.2760
PubMed Abstract | CrossRef Full Text | Google Scholar
Silva, G. L., Cui, B., Chávez, D., You, M., Hee-Byung, C., Rasoanaivo, P., et al. (2001). Modulation of the multidrug-resistance phenotype by new tropane alkaloid aromatic esters from Erythroxylum pervillei. J. Nat. Prod. 64 (12), 1514-1520. doi: 10.1021/np010295+
PubMed Abstract | CrossRef Full Text | Google Scholar
Sousa, O. V., Vieira, G. D., Pinho, JJRGd, Yamamoto, C. H., Alves, M. S. (2010). Antinociceptive and anti-inflammatory activities of the ethanol extract of Annona muricata L. leaves in animal models. Int. J. Mol. Sci. 11 (5), 2067-2078. doi: 10.3390/ijms11052067
PubMed Abstract | CrossRef Full Text | Google Scholar
Sultana, S., Asif, H. M., Nazar, H. M. I., Akhtar, N., Rehman, J. U., Rehman, R. U. (2014). Medicinal plants combating against cancer- a green anticancer approach. Asian Pac. J. Cancer P 15 (11), 4385-4394. doi: 10.7314/APJCP.2014.15.11.4385
CrossRef Full Text | Google Scholar
Tantithanaporn, S., Wattanapiromsakul, C., Itharat, A., Keawpradub, N. (2011). Cytotoxic activity of acetogenins and styryl lactones isolated from Goniothalamus undulatus Ridl. root extracts against a lung cancer cell line (COR-L23). Phytomedicine 18, 486-490. doi: 10.1016/j.phymed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Tormo, J. R., Gallardo, T., Aragón, R., Cortes, D., Estornell, E. (1999). Specific interakcje monotetrahydrofuranic annonaceous acetogenins jako inhibitory mitochondrialnego kompleksu I. Chem. Biol. Interact. 122, 171-183. doi: 10.1016/S0009-2797(99)00120-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Torres, M. P., Rachagani, S., Purohit, V., Pandey, P., Joshi, S., Moore, E. D., et al. (2012). Graviola: nowy obiecujący lek pochodzenia naturalnego, który hamuje tumorigeniczność i przerzuty komórek raka trzustki in vitro i in vivo poprzez zmianę metabolizmu komórek. Cancer Lett. 323 (1), 29-40. doi: 10.1016/j.canlet.2012.03.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, L. Q., Min, B. S., Li, Y., Nakamura, N., Qin, G. W., Li, C. J., et al. (2002). Annonaceous acetogenins from the leaves of Annona montana. Bioorg. Med. Chem. 10, 561-565. doi: 10.1016/S0968-0896(01)00303-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Gundala, R., Mukkavilli, R., Vangala, S., Reid, M. D., Aneja, R. (2015). Synergistic interactions among flavonoids and acetogenins in Graviola (Annona muricata) leaves confer protection against prostate cancer. Carcinogenesis 36 (6), 656-665. doi: 10.1093/carcin/bgv046
PubMed Abstract | CrossRef Full Text | Google Scholar
Yiallouris, A., Patrikios, I., Johnson, E. O., Sereti, E., Dimas, K., De Ford, C., et al. (2018). Annonacyna promuje selektywną śmierć komórek nowotworowych za pośrednictwem szlaków zależnych od NKA i SERCA. Cell Death Dis. 9 (764), 13. doi: 10.1038/s41419-018-0772-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, F., Bai, G., Chen, Y., Miao, Y., Chen, J., Li, X. (2015). Structure-activity relationships of diverse ACGs against multidrug resistant human lung cancer cell line A549/Taxol. Bioorg. Med. Chem. Lett. 25, 787-790. doi: 10.1016/j.bmcl.2014.12.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S., Chang, H. L., Chen, H. W., Yeh, Y. T., Kao, Y. H., Lin, K. H., et al. (2003). Annonacin, mono-tetrahydrofuran acetogenin, zatrzymuje komórki nowotworowe w fazie G1 i powoduje cytotoksyczność na drodze związanej z Bax. And caspase-3-related pathway. Life Sci. 72, 2853-2861. doi: 10.1016/S0024-3205(03)00190-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, S. S., Chang, H. L., Chen, H. W., Kuo, F. c. h., Liaw, C. h. C. h., Su, J. H., et al. (2006). Selective cytotoxicity of squamocin on T24 bladder cancer cells at the S-phase via a Bax-, Bad- and caspase-3-related pathways. Life Sci. 78, 869-874. doi: 10.1016/j.lfs.2005.05.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, L., Wu, F. E., Oberlies, N. H., McLaughlin, J. L., Sastrodihajo, S. (1996). Five new monotetrahydrofuran ring acetogenins from the leaves of Annona muricata. J. Nat. Prod. 59, 1035-1042. doi: 10.1021/np960447e
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhou, S., Lim, L. Y., Chowbay, B. (2004). Herbal modulation of P-glycoprotein. Drug Metab. Rev. 36 (1), 57-104. doi: 10.1081/DMR-120028427
PubMed Abstract | CrossRef Full Text | Google Scholar
.