- Introduction
- Materiały i metody
- Populacja badana
- Zmienne badania
- Wyniki
- Distribution of AB0/Rh Blood Group in Patients with PCa
- No Significant Differences in Clinicopathologic Characteristics among PCa Patients According to AB0/Rh Blood Groups
- No Significant Prognostic Value of Blood Group for BCR-Free Survival after RP
- Discussion
- Informed Consent
- Oświadczenie etyczne
- Wkład autorów
- Oświadczenie o konflikcie interesów
Introduction
Rak gruczołu krokowego (PCa) jest najczęstszym nowotworem złośliwym w krajach zachodnich i drugą główną przyczyną zgonów związanych z rakiem u mężczyzn (1). Najbardziej rozpoznawalnymi czynnikami ryzyka rozwoju PCa są rosnący wiek, pochodzenie etniczne i wywiad rodzinny (2). Predyspozycje rodzinne sugerują dziedziczny komponent genetyczny choroby (3), ale stanowią jedynie mniejszość (5-10%) przypadków PCa. W konsekwencji, predysponujące czynniki środowiskowe i genetyczne dla większości pacjentów są nadal nieznane (4, 5). Grupa krwi AB0 jest cechą dziedziczną, która wiąże się z częstością występowania i rokowaniem w przypadku wielu nowotworów złośliwych (6-8). Zaproponowano kilka prawdopodobnych mechanizmów, w tym zapalenie, nadzór immunologiczny nad komórkami złośliwymi, adhezję międzykomórkową i sygnalizację błonową, aby wyjaśnić obserwowany związek między grupami krwi AB0 a ryzykiem nowotworów.
Antygeny grupy krwi AB0 (ABH) są glikoproteinami wyrażonymi na powierzchni czerwonych krwinek. Fenotypowe antygeny A i B są terminalnymi węglowodanami syntetyzowanymi poprzez dodanie pojedynczych cukrów katalizowane przez serię specyficznych glikozylotransferaz. Fenotyp 0 charakteryzuje się brakiem glikozylotransferaz A i B, tak że obecny jest tylko szkielet białkowy, antygen H. Antygeny krwinek czerwonych mają różne funkcje, w tym integralność strukturalną błony, transport cząsteczek przez błony i adhezję (9). Oprócz ekspresji na krwinkach czerwonych, antygeny ABH ulegają również ekspresji w różnych komórkach nabłonkowych, w tym w moczowodzie, błonie śluzowej przewodu pokarmowego i płucach. W kilku badaniach wykazano zmiany wzoru ekspresji ABH w komórkach nowotworowych w zależności od stopnia zaawansowania nowotworu i progresji choroby, co sugeruje możliwy związek między grupą krwi AB0 a ryzykiem wystąpienia niektórych nowotworów złośliwych nabłonka (8, 10). Ostatnie badania wykazały, że osoby z grupą krwi A, AB lub B miały zwiększoną częstość występowania raka trzustki w porównaniu z osobami z grupą krwi 0, a największe ryzyko wśród nich wiązało się z grupą krwi B (8). Podobnie, serotyp krwi A był związany z wyższym ryzykiem zachorowania na raka żołądka, piersi i jajnika (11). Z drugiej strony, grupa krwi 0 była skorelowana z najwyższym wskaźnikiem nawrotów i progresji po przezcewkowej resekcji pęcherza moczowego i tym samym związana z gorszym rokowaniem u pacjentów z nie-mięśniowo inwazyjnym rakiem urotelialnym pęcherza moczowego (6).
Based on the current evidence of the predictive role of the blood group in several malignancies, we hypothesized that the type of blood group may be used as an additional parameter, which facilitates the assessment of risk and helps to estimate prognosis after surgery in patients with PCa. W aktualnym piśmiennictwie dostępne są jedynie ograniczone dowody kliniczne dotyczące grupy krwi i PCa w ogóle, które wykazały kontrowersyjne wyniki (12-14) Ponadto, obecnie istnieje tylko jedno badanie ze szczególnym uwzględnieniem wpływu grup krwi na rokowanie u pacjentów po radykalnej prostatektomii (RP) (13). Wykorzystując 555 chorych na PCa poddanych RP, autorzy wykazali, że grupa krwi AB0 jest niezależnym predyktorem nawrotu biochemicznego (BCR) w analizie wielowariantowej, ale nie w analizie jednowariantowej.
Celem niniejszego badania było zatem dodanie dalszych informacji do toczącej się debaty poprzez analizę korelacji między grupą krwi AB0/Rh i jej dystrybucją wśród pacjentów z PCa, patologią guza, nawrotami i śmiertelnością u pacjentów z umiejscowionym PCa poddanych RP przy użyciu dużego zestawu danych z jednego ośrodka obejmującego 3574 pacjentów.
Materiały i metody
Populacja badana
Badanie zostało zatwierdzone przez instytucjonalną komisję rewizyjną. Do badania włączono 3582 pacjentów z klinicznie zlokalizowanym PCa, u których w latach 2009-2010 przeprowadzono RP w naszej instytucji. Ci z niekompletnymi zestawami danych i brakującą obserwacją zostali wykluczeni (n = 8), pozostawiając 3574 pacjentów dostępnych do analizy.
Radical prostatectomy was performed using an open retropubic approach (n = 3 220) or robotic-assisted laparoscopic approach (n = 354), as described previously (15). U pacjentów z grupy pośredniego i wysokiego ryzyka D’Amico wykonano dysekcję węzłów chłonnych zgodnie z wytycznymi Europejskiego Towarzystwa Urologicznego (EAU) dotyczącymi PCa (16). Próbki chirurgiczne były przetwarzane zgodnie ze standardowymi procedurami histopatologicznymi i oceniane przez doświadczonych uropatologów w ośrodku o dużej objętości (>2,000 próbek prostatektomii rocznie). Guzy były klasyfikowane zgodnie z systemem klasyfikacji TNM American Joint Committee on Cancer z 2007 roku, a histopatologiczna klasyfikacja została przypisana zgodnie z systemem Gleasona (17).
Wszyscy uczestnicy przeszli badania serologiczne przed RP. Laboratoryjne potwierdzenie AB0 i grupy krwi Rh uzyskano z Departamentu Medycyny Transfuzjologicznej, Szpitala Uniwersyteckiego Hamburg-Eppendorf. Rozkład referencyjny AB0 populacji niemieckiej został użyty jako kontrola (18).
Zmienne badania
Zmienne badania obejmowały grupę krwi AB0/Rh, wiek, przedoperacyjny antygen specyficzny dla gruczołu krokowego (PSA), objętość gruczołu krokowego (przezodbytnicze badanie ultrasonograficzne), wynik w skali Gleasona (próbka), stopień pT, stopień pN, margines chirurgiczny, BCR i śmiertelność po RP. Kontrola pacjentów obejmowała badanie PSA co 3-6 miesięcy w ciągu pierwszych 2 lat po RP, BCR definiowano jako poziom PSA ≥0,2 ng/ml.
Zależność między grupą krwi AB0 a zmiennymi kliniczno-patologicznymi oceniano za pomocą testów chi-squared i t-testów. W analizie wielowariantowej regresji Coxa (testy log-rank) oceniano wpływ grupy krwi, przedoperacyjnego PSA, skali Gleasona, stopnia zaawansowania pT, stopnia zaawansowania pN i marginesu chirurgicznego na przeżycie wolne od BCR w celu oceny wartości prognostycznych dla przeżycia. Prawdopodobieństwo przeżycia wolnego od BCR porównywano w grupach 0, A, B i AB za pomocą analizy Kaplana-Meiera i testu log-rank.
Wszystkie testy były dwuwartościowe, a wartości p <0,05 uznano za istotne statystycznie. Analizy statystyczne przeprowadzono przy użyciu oprogramowania JMP v9.0.2 (SAS Institute, Inc, Cary, NC, USA) i R v2.13.1 (R Project for Statistical Computing, www.R-project.org).
Wyniki
Do ostatecznych analiz zakwalifikowano łącznie 3574 pacjentów z klinicznie zlokalizowanym PCa, mediana wieku w momencie operacji wynosiła 65 lat (zakres: 38-80), a mediana obserwacji 36,9 miesiąca (Tabela 1).

Tabela 1. Związek grupy krwi AB0 i czynnika Rhesus z charakterystyką kliniczno-patologiczną 3 574 pacjentów leczonych prostatektomią radykalną.
Distribution of AB0/Rh Blood Group in Patients with PCa
Rozkład grupy krwi AB0 wśród pacjentów z PCa przed RP był następujący: 0 u 1 350 (38%), A u 1 605 (45%), B u 445 (12%) i AB u 174 (5%) chorych, 83% chorych było Rh dodatnich (tab. 1). Rozkład referencyjny dla populacji niemieckiej jest następujący (18): 0 u 41%; A u 43%; B u 11%; AB u 5%; Rhesus dodatni: 85%. Ogólny rozkład grup krwi AB0 i Rh w badanej kohorcie odpowiadał rozkładowi obserwowanemu w niemieckiej populacji mężczyzn.
No Significant Differences in Clinicopathologic Characteristics among PCa Patients According to AB0/Rh Blood Groups
Większość pacjentów miała klinicznie zlokalizowanego PCa o średnim profilu ryzyka. Najczęściej odnotowywaną punktacją w skali Gleasona była 3 + 4 (66,9%), a u 63,3% pacjentów przedoperacyjne stężenie PSA mieściło się w zakresie 4-10 ng/ml. Guzy pT2 wykryto u 68,7%, a ujemne marginesy uzyskano u 81,3% pacjentów. Mediana objętości gruczołu krokowego wynosiła 40 ml, a zajęcie węzłów chłonnych stwierdzono u 224 (6,3%) chorych (tab. I). Nie stwierdzono istotnych różnic w charakterystyce kliniczno-patologicznej wśród chorych z różnymi grupami krwi AB0. Nieznacznie większy odsetek chorych w zaawansowanym stadium nowotworu (≥pT3b) stwierdzono u chorych z grupą krwi AB w porównaniu z grupami krwi 0, A i B (odpowiednio 16,1, 12,6, 9,9 i 13,7%, p = 0,033). W populacji pacjentów z grupą AB stwierdzono również umiarkowanie podwyższony wskaźnik ujemnego czynnika Rh (21,8%) w porównaniu z pozostałymi grupami krwi (16,9%, p = 0,01) (tab. 1).
No Significant Prognostic Value of Blood Group for BCR-Free Survival after RP
According to multivariable cox regression analysis, preoperative PSA, Gleason score, pT-stage, pN status, and surgical margin significantly and independently correlated with BCR-free survival (all p < 0.05) (Table 2). Nie zaobserwowano natomiast wpływu grupy krwi AB0 na odsetek BCR (ryc. 1). Dalej ocenialiśmy wartość prognostyczną grupy krwi 0 w porównaniu do grup krwi innych niż 0, jak również w obrębie alternatywnych grup krwi A/B/AB z nieistotnymi wynikami (Tabela 2). Nawet jeśli przeprowadzono subanalizy z udziałem chorych z dodatnim lub ujemnym marginesem, wpływ AB0/Rh na BCR pozostał nieistotny (ryc. 2A,B). Co więcej, status czynnika Rhesus u chorych również nie miał wpływu na przeżycie wolne od BCR (p = 0,74).
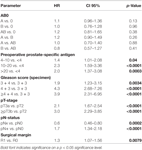
Tabela 2. Wielozmiennowe modele regresji cox dla AB0 i standardowych czynników prognostycznych dla przeżycia wolnego od nawrotu biochemicznego.
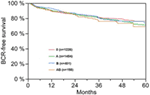
Rysunek 1. Przeżycie wolne od nawrotu biochemicznego (BCR)po radykalnej prostatektomii stratyfikowane grupami krwi AB0 (p = 0,572).
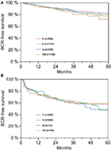
Rysunek 2. (A,B) Biochemical recurrence (BCR)-free survival after radical prostatectomy stratified by AB0 blood groups in patients with negative and positive surgical margin status.
Discussion
Possible associations between AB0 blood group and the risk of some epithelial malignancies, including pancreatic-, colorectal-, and gastric cancer have been reported frequently (19, 20). Co więcej, grupy krwi AB0/Rh są dostępne dla większości pacjentów przed interwencją chirurgiczną, co sugeruje, że są idealnym markerem pomocniczym bez dodatkowych etapów przetwarzania laboratoryjnego.
Kilkadziesiąt lat temu badania immunohistochemiczne wskazały, że komórki PCa pochodzące od pacjentów wykazują inne wzorce ekspresji ABH niż prawidłowe/złośliwe komórki prostaty (21). Ponieważ stwierdzono, że zarówno grupa krwi AB0, jak i ekspresja antygenu w tkankach są związane z występowaniem, progresją choroby i jej wynikiem w wielu nowotworach złośliwych (8, 22, 23), taka zmieniona ekspresja antygenu ABH w tkance gruczołu krokowego sugerowała możliwy wpływ grupy krwi na złośliwą transformację komórek gruczołu krokowego.
W ostatnim badaniu opublikowanym przez Markt i współpracowników (14) przeanalizowano związek między grupą krwi AB0 a ryzykiem nosicielstwa agresywnego PCa. Autorzy przeanalizowali zbiór danych obejmujący 2 774 pacjentów z agresywnym PCa oraz 4 443 pacjentów bez PCa, którzy stanowili grupę kontrolną. Na podstawie tych danych nie udało się wykazać istotnej korelacji pomiędzy grupą krwi AB0 lub „dawką” alleli A lub B a ryzykiem agresywnego PCa. Autorzy przedstawili również dane dotyczące śmiertelności swoistej i ogólnej w zależności od grupy krwi, jednak badanie nie zawierało informacji na temat leczenia PCa. Ponadto do badania włączono tylko chorych z agresywnymi nowotworami, co może maskować potencjalny wpływ różnych grup krwi.
Wyniki te są zgodne z badaniem przeprowadzonym przez Kvista i współpracowników, w którym nie wykazano związku między grupą krwi AB0 a przeżyciem chorych na PCa leczonych metodą watchful waiting. Badanie to było ograniczone głównie przez małą liczbę przypadków (n = 279) (12). Co ciekawe, jedyne badanie skupiające się na pacjentach po RP, obejmujące 555 pacjentów japońskich, wykazało, że grupa krwi 0 była istotnie związana ze zmniejszonym ryzykiem BCR po RP w analizie wielo-, ale nie jedno- (13). W subanalizie chorych z ujemnym marginesem chirurgicznym 5-letni odsetek wolnych od BCR w grupie krwi 0 był istotnie wyższy niż w grupie A (91,2 vs. 71,0%; p = 0,026). W badanej kohorcie 46,3% chorych miało dodatni status marginesu, pomimo klinicznego stopnia zaawansowania T1c u 74,2% chorych. Nie podano stopnia zaawansowania patologicznego (pT).
Nasza retrospektywna kohorta 3 574 pacjentów z klinicznie zlokalizowanym PCa jest największą analizowaną dotychczas kohortą w celu określenia możliwego wpływu grup krwi AB0 i Rh na charakterystykę guza i wyniki po RP. W obecnym badaniu większość pacjentów miała guzy pT2 (68,7%), a 18,6% miało pozytywny status marginesu. Na podstawie tych danych nie udało się wykazać istotnego wpływu grup krwi AB0/Rh na charakterystykę kliniczno-patologiczną (przedoperacyjne PSA, wynik w skali Gleasona, objętość gruczołu krokowego, stopień zaawansowania pT, status pN i margines chirurgiczny) oraz przeżycie wolne od BCR po RP. Co więcej, w subanalizie z udziałem pacjentów z dodatnim lub ujemnym marginesem, wpływ AB0/Rh na BCR pozostał nieistotny. W związku z tym nie udało nam się odtworzyć wyników badania japońskiego (13). W przeciwieństwie do innych nowotworów złośliwych, takich jak rak trzustki lub pęcherza moczowego, grupa krwi AB0/Rh nie ma wartości prognostycznej w PCa.
Nasze badanie ma kilka istotnych ograniczeń. Przede wszystkim są to ograniczenia właściwe dla analiz retrospektywnych oraz brak grupy kontrolnej. Ponadto w naszej kohorcie przeważają zlokalizowane PCa o niskim lub średnim profilu ryzyka (wynik Gleasona 3 + 4 u 66,9%, przedoperacyjne PSA 4-10 ng/ml u 63,3%, pT2 u 68,7% i ujemne marginesy u 81,3% pacjentów), co pozwala na wstępną selekcję pacjentów o korzystnym rokowaniu. Ponadto, ogólny rozkład AB jest – w przeciwieństwie do innych grup krwi – ogólnie mało obfity (4,9%). Niektóre obserwacje, takie jak umiarkowanie podwyższony wskaźnik ujemnego czynnika Rh (21,8%) u pacjentów z grupą AB w porównaniu z innymi grupami krwi (16,9%, p = 0,01), mogą być zwiększone ze względu na rzadkość występowania Rh-ujemnej grupy AB, co uniemożliwia statystycznie istotne wykrycie korelacji w tej podgrupie. Wreszcie, brakowało informacji na temat genotypu odpowiedniej grupy krwi.
W uzupełnieniu do wyżej wymienionych cech, środowiskowe, geograficzne i rasowe obawy nigdy nie mogą być zaniedbane w omawianiu korelacji grupy krwi AB0 z rakiem. Różnice rasowe i etniczne w grupach krwi, jak również w PCa są dobrze znane (24, 25). W Europie, gdzie PCa jest najczęstszym nowotworem złośliwym i drugą co do częstości przyczyną zgonów z powodu nowotworów u mężczyzn (1), najczęstszymi grupami krwi są A i 0, których częstość wzrasta do allelu B z zachodu na wschód. Z kolei kraje azjatyckie o najniższej zachorowalności i niskim stopniu zaawansowania PCa charakteryzują się wysokim występowaniem typów B i względnie niską częstością 0, a także mniejszą populacją z ujemnym czynnikiem Rh (26). Pod tym względem nasze wyniki różnią się od wyników obecnego badania przeprowadzonego u japońskich pacjentów ze względnie wysokim dodatnim statusem marginesu i BCR po leczniczym RP (13).
Zaproponowano wiele mechanizmów wyjaśniających, w jaki sposób grupa krwi wpływa na zachorowalność i progresję nowotworów; jednak nadal pozostają one niejasne. W przypadku raka pęcherza moczowego sugerowano aberrację chromosomalną, ponieważ gen AB0 jest zlokalizowany na chromosomie 9q34, obszarze, który jest często zmieniany w raku pęcherza moczowego (27). Ponieważ gen AB0 faktycznie koduje glikozylotransferazy, które katalizują transfer cukrów do antygenu H (0), występowanie raka pęcherza moczowego jest potencjalnie skorelowane z grupą krwi 0. W przeciwieństwie do tego, donoszono, że osoby z grupami krwi innymi niż 0 (A, AB i B) mają zwiększone ryzyko rozwoju raka żołądka i wskazują na nowotworową rolę grupy krwi.
W odniesieniu do PCa, podejmowanych jest kilka wysiłków w celu wyjaśnienia roli grupy krwi w przeżyciu po terapii. Już wcześniej donoszono, że pacjenci z grupą krwi inną niż 0 powinni mieć zwiększone ryzyko żylnej choroby zakrzepowo-zatorowej po RP, co może mieć wpływ na wynik leczenia (28). Nawet w niedawno opublikowanym badaniu wykazano, że przeciwciała w surowicy dla grupy krwi A przewidują przeżycie po PROSTVAC-VF (terapeutyczna szczepionka przeciwnowotworowa oparta na poxwirusie, będąca w fazie III badań klinicznych w leczeniu zaawansowanego PCa) i powinny być rozważane jako nowy potencjalnie predykcyjny biomarker dla PROSTVAC-VF (29). Chociaż w naszym badaniu nie zaobserwowaliśmy wyraźnego związku między grupą krwi AB0/Rh a patologią nowotworu i wynikiem leczenia, dowody te nadal sugerują predykcyjną rolę grupy krwi w epidemiologii PCa i wyniku klinicznym, zwłaszcza w świetle odpowiedzi na leczenie.
Niniejsze badanie z udziałem 3574 pacjentów jest największym jak dotąd analizującym wpływ grup krwi AB0 lub Rh na patologię i wynik po RP i wnosi istotną wiedzę do literatury.
W podsumowaniu, nasze dane sugerują brak istotnego związku grupy krwi AB0/Rhesus z niekorzystnymi kliniczno-patologicznymi cechami guza lub wynikiem onkologicznym po operacji w przeciwieństwie do kilku innych nowotworów złośliwych. Niemniej jednak wskazane są dalsze badania w celu oceny możliwego związku między genotypem grupy krwi lub jej ekspresją antygenów w tkance PCa a rokowaniem w różnych grupach terapeutycznych, w tym w wysokim stopniu zaawansowania lub zaawansowanym PCa, które nie były wystarczająco odzwierciedlone w naszej grupie badanej.
Informed Consent
Informowana zgoda została uzyskana od wszystkich indywidualnych uczestników włączonych do badania.
Oświadczenie etyczne
Wszystkie procedury wykonywane w badaniach z udziałem ludzi były zgodne ze standardami etycznymi instytucjonalnego i/lub krajowego komitetu badawczego oraz z Deklaracją Helsińską z 1964 roku i jej późniejszymi poprawkami lub porównywalnymi standardami etycznymi.
Wkład autorów
SO, DT, i TS: znaczący wkład w koncepcję lub projekt pracy, sporządzenie projektu pracy, ostateczne zatwierdzenie wersji do publikacji. PM: znaczący wkład w koncepcję lub projekt pracy, sporządzenie projektu pracy, ostateczne zatwierdzenie wersji do publikacji. FC: pozyskanie, analiza lub interpretacja danych do pracy, krytyczna weryfikacja pracy pod kątem istotnych treści intelektualnych, ostateczna akceptacja wersji do publikacji. PT: pozyskanie, analiza lub interpretacja danych do pracy, krytyczna korekta ze względu na istotną zawartość intelektualną, ostateczne zatwierdzenie wersji do publikacji. SP: pozyskiwanie, analiza lub interpretacja danych do pracy, krytyczna korekta ze względu na istotną zawartość intelektualną, ostateczne zatwierdzenie wersji do publikacji. JLH, JH, i MG: pozyskiwanie, analiza lub interpretacja danych do pracy, krytyczna weryfikacja pod kątem ważnych treści intelektualnych, ostateczne zatwierdzenie wersji do publikacji. Wszyscy autorzy zgodzili się być odpowiedzialni za wszystkie aspekty pracy w zapewnieniu, że pytania związane z dokładnością lub integralnością jakiejkolwiek części pracy są odpowiednio zbadane i rozwiązane.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Redaktor prowadzący zadeklarował wspólną afiliację, choć bez innej współpracy, z kilkoma autorami (FC, SP, JH i DT).
1. Siegel R, Ma J, Zou Z, Jemal A. Statystyki nowotworów, 2014. CA Cancer J Clin (2014) 64(1):9-29. doi:10.3322/caac.21208
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Key T. Risk factors for prostate cancer. Cancer Surv (1995) 23:63-77.
PubMed Abstract | Google Scholar
3. Langeberg WJ, Isaacs WB, Stanford JL. Genetic etiology of hereditary prostate cancer. Front Biosci (2007) 12:4101-10. doi:10.2741/2374
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Pinsky PF, Kramer BS, Reding D, Buys S. Zgłoszona historia rodzinna raka w próbie przesiewowej raka prostaty, płuc, jelita grubego i jajnika. Am J Epidemiol (2003) 157(9):792-9. doi:10.1093/aje/kwg043
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, et al. Environmental and heritable factors in the causation of cancer – analyses of cohorts of twins from Sweden, Denmark, and Finland. N Engl J Med (2000) 343(2):78-85. doi:10.1056/NEJM200007133430201
CrossRef Full Text | Google Scholar
6. Klatte T, Xylinas E, Rieken M, Kluth LA, Roupret M, Pycha A, et al. Impact of ABO blood type on outcomes in patients with primary nonmuscle invasive bladder cancer. J Urol (2014) 191(5):1238-43. doi:10.1016/j.juro.2013.11.106
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Duell EJ, Bonet C, Munoz X, Lujan-Barroso L, Weiderpass E, Boutron-Ruault MC, et al. Variation at ABO histo-blood group and FUT loci and diffuse and intestinal gastric cancer risk in a European population. Int J Cancer (2015) 136(4):880-93. doi:10.1002/ijc.29034.
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Wolpin BM, Kraft P, Gross M, Helzlsouer K, Bueno-de-Mesquita HB, Steplowski E, et al. Pancreatic cancer risk and ABO blood group alleles: results from the pancreatic cancer cohort consortium. Cancer Res (2010) 70(3):1015-23. doi:10.1158/0008-5472.CAN-09-2993
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Reid ME. Gen kodujący antygen grupy krwi I: przegląd I dla oka. Immunohematology (2004) 20(4):249-52.
PubMed Abstract | Google Scholar
10. Nakagoe T, Nanashima A, Sawai T, Tuji T, Ohbatake M, Jibiki M, et al. Expression of blood group antigens A, B and H in carcinoma tissue correlates with a poor prognosis for colorectal cancer patients. J Cancer Res Clin Oncol (2000) 126(7):375-82. doi:10.1007/PL00008485
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gates MA, Wolpin BM, Cramer DW, Hankinson SE, Tworoger SS. ABO blood group and incidence of epithelial ovarian cancer. Int J Cancer (2011) 128(2):482-6. doi:10.1002/ijc.25339
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Kvist E, Krogh J, Hjortberg P. Zmienne prognostyczne u pacjentów z rakiem prostaty: wpływ grupy krwi ABO (H), systemu Rhesus, wieku, zróżnicowania, stadium nowotworu i przerzutów. Int Urol Nephrol (1992) 24(4):417-23. doi:10.1007/BF02550636
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ohno Y, Ohori M, Nakashima J, Okubo H, Satake N, Takizawa I, et al. Associations between ABO blood groups and biochemical recurrence after radical prostatectomy. Int J Clin Exp Med (2015) 8(2):2642-8.
PubMed Abstract | Google Scholar
14. Markt SC, Shui IM, Unger RH, Urun Y, Berg CD, Black A, et al. Allelele grup krwi ABO i ryzyko raka prostaty: wyniki z konsorcjum kohorty raka piersi i prostaty (BPC3). Prostate (2015) 75(15):1677-81. doi:10.1002/pros.23035
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Schlomm T, Tennstedt P, Huxhold C, Steuber T, Salomon G, Michl U, et al. Neurovascular structure-adjacent frozen-section examination (NeuroSAFE) increases nerve-sparing frequency and reduces positive surgical margins in open and robot-assisted laparoscopic radical prostatectomy: experience after 11,069 consecutive patients. Eur Urol (2012) 62(2):333-40. doi:10.1016/j.eururo.2012.04.057
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Mottet N, Bellmunt J, Briers E, van den Bergh RCN, Bolla M, van Casteren NJ, et al. Wytyczne dotyczące raka gruczołu krokowego 2015. European Association of Urology (2015).
Google Scholar
17. Gleason D, Mellinger G. Przewidywanie rokowania dla gruczolakoraka gruczołu krokowego przez połączony histologiczny grading i kliniczny staging. J Urol (1974) 111:58-64. doi:10.1016/S0022-5347(17)59889-4
CrossRef Full Text | Google Scholar
18. Pelzer U, Klein F, Bahra M, Sinn M, Dorken B, Neuhaus P, et al. Blood group determinates incidence for pancreatic cancer in Germany. Front Physiol (2013) 4:118. doi:10.3389/fphys.2013.00118
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Newell GR, Gordon JE, Monlezun AP, Horwitz JS. Grupy krwi ABO i rak. J Natl Cancer Inst (1974) 52(5):1425-30. doi:10.1093/jnci/52.5.1425
CrossRef Full Text | Google Scholar
20. Marcus DM. System grup krwi ABO i Lewis. Immunochemia, genetyka i związek z chorobami człowieka. N Engl J Med (1969) 280(18):994-1006. doi:10.1056/NEJM196905012801806
CrossRef Full Text | Google Scholar
21. Abel PD, Marsh C, Henderson D, Leathem A, Powell PH, Williams G. Detection of blood group antigens in frozen sections of prostatic epithelium. Br J Urol (1987) 59(5):430-5. doi:10.1111/j.1464-410X.1987.tb04841.x
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Nakagoe T, Fukushima K, Itoyanagi N, Ikuta Y, Oka T, Nagayasu T, et al. Expression of ABH/Lewis-related antigens as prognostic factors in patients with breast cancer. J Cancer Res Clin Oncol (2002) 128(5):257-64. doi:10.1007/s00432-002-0334-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Orntoft TF, Meldgaard P, Pedersen B, Wolf H. The blood group ABO gene transcript is down-regulated in human bladder tumors and growth-stimulated urothelial cell lines. Cancer Res (1996) 56(5):1031-6.
PubMed Abstract | Google Scholar
24. Watanabe M, Nakayama T, Shiraishi T, Stemmermann GN, Yatani R. Comparative studies of prostate cancer in Japan versus the United States. A review. Urol Oncol (2000) 5(6):274-83. doi:10.1016/S1078-1439(00)00092-2
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Fontes F, Severo M, Castro C, Lourenco S, Gomes S, Botelho F, et al. Model-based patterns in prostate cancer mortality worldwide. Br J Cancer (2013) 108(11):2354-66. doi:10.1038/bjc.2013.217
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Garratty G, Glynn SA, McEntire R. Częstości fenotypów ABO i Rh(D) w różnych grupach rasowych / etnicznych w Stanach Zjednoczonych. Transfusion (2004) 44(5):703-6. doi:10.1111/j.1537-2995.2004.03338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Orlow I, Lacombe L, Pellicer I, Rabbani F, Delgado R, Zhang ZF, et al. Genotypowa i fenotypowa charakterystyka grupy krwi histologicznej ABO(H) w pierwotnych guzach pęcherza moczowego. Int J Cancer (1998) 75(6):819-24. doi:10.1002/(SICI)1097-0215(19980316)75:6<819::AID-IJC1>3.0.CO;2-Y
CrossRef Full Text | Google Scholar
28. Clyne M. Prostate cancer: non-O blood type is VTE risk factor after radical prostatectomy. Nat Rev Urol (2013) 10(12):680. doi:10.1038/nrurol.2013.255
CrossRef Full Text | Google Scholar
29. Campbell CT, Gulley JL, Oyelaran O, Hodge JW, Schlom J, Gildersleeve JC. Serum antibodies to blood group A predict survival on PROSTVAC-VF. Clin Cancer Res (2013) 19(5):1290-9. doi:10.1158/1078-0432.CCR-12-2478
PubMed Abstract | CrossRef Full Text | Google Scholar
.