- Wprowadzenie
- MS/DBB Cholinergic Neuron Activity and Acetylcholine Release in Hippocampal CA1
- Effects of Muscarinic Receptor Activation on Hippocampal CA1 Inhibitory Interneurons
- Activation of Muscarinic Receptors in Hippocampal CA1 Interneurons Following Acetylcholine Release
- Effects of Nicotinic Receptor Activation on Hippocampal CA1 Interneurons
- Activation of Nicotinic Receptors in Hippocampal CA1 Interneurons Following Acetylcholine Release
- Effects of Acetylcholine Release on Hippocampal CA1 Network Function from the Perspective of the Interneuron Membrane Potential
- Oświadczenie o konflikcie interesów
- Acknowledgment
Wprowadzenie
Acetylocholina jest uwalniana w ośrodkowym układzie nerwowym ssaków (OUN), gdzie wpływa na globalne funkcjonowanie mózgu poprzez oddziaływanie na cykle sen-czuwanie, uwagę i tworzenie pamięci. Jednym z regionów mózgu silnie unerwionych przez aferenty cholinergiczne z przegrody przyśrodkowej i ukośnego pasma kompleksu Broca (MS/DBB) jest hipokamp (Dutar et al., 1995). Funkcjonalnie, uwalnianie acetylocholiny w hipokampie zostało zaproponowane jako pomoc w tworzeniu lub odzyskiwaniu wspomnień w zależności od zewnątrzkomórkowego stężenia acetylocholiny (Power i in., 2003; Hasselmo i Giocomo, 2006; Kenney i Gould, 2008; Deiana i in., 2011; Hasselmo i Sarter, 2011; Easton i in., 2012; Blake i in., 2014). Mechanizm, za pomocą którego terminale cholinergiczne MS/DBB wpływają na funkcję sieci hipokampa, odbywa się poprzez aktywację zarówno receptorów muskarynowych, jak i nikotynowych, zlokalizowanych na dendrytach, ciałach komórek i zakończeniach aksonów neuronów piramidowych i interneuronów hamujących, a także na astrocytach (Cobb i Davies, 2005; Teles-Grilo Ruivo i Mellor, 2013). Chociaż acetylocholina wpływa na wiele miejsc na kilku różnych typach komórek, część jej wpływu prawdopodobnie wynika z wpływu na funkcję interneuronów.
Inhibitory interneurons play a crucial role in information processing in the hippocampus. Interneurony są bardzo zróżnicowane pod względem budowy anatomicznej i przypuszczalnej funkcji (Freund i Buzsaki, 1996; Klausberger i Somogyi, 2008). W zależności od podtypu interneuronu i miejsca unerwienia komórki piramidowej, pojedynczy interneuron może całkowicie zablokować aktywność w dendrycie, zmienić fazę odpalania potencjału czynnościowego w somie lub całkowicie uniemożliwić odpalanie potencjału czynnościowego w ciele komórki piramidowej (Miles i in., 1996; Larkum i in., 1999). Na poziomie sieci, interneurony przyczyniają się do generowania synchronicznej aktywności wśród populacji neuronów głównych z różnymi, istotnymi z punktu widzenia zachowania, częstotliwościami (Buzsaki, 2002; Buzsaki i Wang, 2012). Biorąc pod uwagę znaczący wpływ poszczególnych interneuronów na funkcjonowanie sieci neuronalnej, prawdopodobne jest, że znaczna część wpływu acetylocholiny na aktywność hipokampa odbywa się poprzez modulację interneuronów. Chociaż wykazano, że receptory cholinergiczne wpływają na hamujące terminale presynaptyczne (Behrends i Ten Bruggencate, 1993; Tang i in., 2011) i pobudliwość interneuronów (McQuiston i Madison, 1999b; Griguoli i in., 2009; Cea-Del Rio i in, 2010, 2011), niniejszy przegląd ograniczy się do ostatnich badań, w których badano wpływ uwalniania acetylocholiny na zmiany potencjału błonowego interneuronów, szczególnie w hipokampalnym CA1.
MS/DBB Cholinergic Neuron Activity and Acetylcholine Release in Hippocampal CA1
Wpływ, jaki uwalnianie acetylocholiny wywiera w hipokampalnym CA1 oraz stopień, w jakim wpływa na różne podtypy interneuronów, będzie zależał od specyficznej lokalizacji i gęstości zakończeń aksonów cholinergicznych, jak również od enzymu inaktywującego, acetylocholinoesterazy. Wykazano, że zarówno włókna cholinergiczne, jak i acetylocholinoesteraza są różnie rozmieszczone w poszczególnych warstwach hipokampa CA1. U myszy wykazano, że włókna cholinergiczne są rozmieszczone równomiernie z wyjątkiem dwóch pasm o większej gęstości w stratum pyamidale (SP) i na granicy pomiędzy stratum radiatum (SR) i stratum lacunosum-moleculare (SLM) (Aznavour i in., 2002). U szczura podobne pasma o większej gęstości obserwowano w SP oraz na granicy SR i SLM. Jednak w porównaniu z warstwą oriensis (SO), niższe gęstości obserwowano w SR i jeszcze niższe w SLM (SO > SR > SLM) (Aznavour i in., 2002). Dystrybucja acetylocholinoesterazy w hipokampalnej CA1 uzupełnia dystrybucję wejścia cholinergicznego, z wyższymi gęstościami obserwowanymi pomiędzy SP i SO, jak również innym szczytem w SLM w pobliżu granicy z SR (Storm-Mathisen, 1970). Zgodne z tymi danymi anatomicznymi, pomiary zwiększonego uwalniania acetylocholiny podczas rytmów theta wykazały, że stężenia acetylocholiny były najwyższe w pobliżu stratum pyramidale (Zhang i in., 2010). To zróżnicowane rozmieszczenie włókien cholinergicznych i pozakomórkowych poziomów acetylocholiny jest szczególnie ważne, jeśli weźmiemy pod uwagę, że nie wszystkie zakończenia cholinergiczne w hipokampie wydają się przekazywać synaptycznie acetylocholinę. Zarówno w hipokampie, jak i w neocortex, 85-93% aksonalnych zakończeń cholinergicznych nie posiada specjalizacji postsynaptycznej, a zatem większość zakończeń cholinergicznych została uznana za przenoszące acetylocholinę poprzez transmisję objętościową lub niesynaptyczną (Umbriaco i in., 1994, 1995). Jednak inne grupy szacują, że większość zakończeń cholinergicznych (66-67%) w neocortexie tworzy klasyczne połączenia synaptyczne (Smiley i in., 1997; Turrini i in., 2001). Niezależnie od tej rozbieżności, wydaje się, że znaczna część terminali uwalnia acetylocholinę do przestrzeni zewnątrzkomórkowej w sposób parakrynny. Wymaga to, aby uwolniona acetylocholina dyfundowała na znaczne odległości obok acetylocholinesterazy, aby związać się z receptorami na elementach postsynaptycznych. Zatem regiony lub warstwy o korzystnej gęstości zakończeń cholinergicznych (wyższej) i/lub acetylocholinoesterazy (niższej) mogą skutkować większymi stężeniami zewnątrzkomórkowymi acetylocholiny, które mogą być bardziej efektywne w przekazywaniu acetylocholiny na drodze transmisji objętościowej. Ponadto możliwe jest, że istnieje podzbiór zakończeń, które są bardziej aktywne, mają większe prawdopodobieństwo uwalniania lub mogą uwalniać więcej neuroprzekaźnika. Terminale te mogą być bardziej skuteczne w pośredniczeniu w przekazywaniu objętości i wpływaniu na pobliskie interneurony hamujące.
Uwalnianie acetylocholiny z terminali cholinergicznych będzie zależało od aktywności neuronów cholinergicznych w MS/DBB. Jednakże, wzorce odpalania neuronów cholinergicznych MS/DBB opisywane w literaturze wykazują pewną zmienność (Barrenechea i in., 1995; Brazhnik i Fox, 1997, 1999; Simon i in., 2006). Niewielka liczba zidentyfikowanych anatomicznie neuronów cholinergicznych MS/DBB, zarejestrowanych u przytomnych, przytrzymywanych gryzoni, charakteryzuje się niską, nieregularną częstotliwością wypalania (<2 Hz) (Simon i in., 2006). Dla kontrastu, niezidentyfikowane anatomicznie neurony z przebiegiem potencjału czynnościowego zgodnym z neuronami cholinergicznymi MS/DBB mogą pracować z częstotliwością do 30 Hz (Brazhnik i Fox, 1999). W związku z tym, pozostaje niejasne, które częstotliwości najlepiej opisują wzorce odpalania neuronów cholinergicznych w MS/DBB lub czy mieszczą się one w szerokim kontinuum. Niemniej jednak, potencjalne różnice w częstotliwości odpalania lub czasie trwania aktywności neuronów cholinergicznych mogą mieć zmienny wpływ na różne podtypy interneuronów poprzez lokalne różnice w stężeniach acetylocholiny.
Effects of Muscarinic Receptor Activation on Hippocampal CA1 Inhibitory Interneurons
Zaburzenie funkcji cholinergicznej MS/DBB przez ogólnoustrojową blokadę receptorów muskarynowych lub bezpośrednie wstrzyknięcie antagonistów receptorów muskarynowych do hipokampa może upośledzać pamięć i kodowanie informacji przestrzennej (Blokland i in., 1992; Atri i in., 2004; Hasselmo, 2006). Potencjalna rola interneuronów hamujących w modulacji funkcji hipokampa przez receptory muskarynowe opierała się początkowo na obserwacji, że egzogenne podanie agonistów cholinergicznych powodowało wzrost spontanicznych hamujących prądów postsynaptycznych (sIPSCs) w neuronach piramidowych CA1 (Pitler i Alger, 1992). Dane te pośrednio sugerowały, że podgrupa interneuronów hamujących może być depolaryzowana przez aktywację receptorów muskarynowych, a następnie zostały potwierdzone przez bezpośrednie nagrania (Parra i in., 1998; McQuiston i Madison, 1999a). Jednakże nie wszystkie interneurony reagowały na aktywację receptora muskarynowego depolaryzacją. Niektóre interneurony były hiperpolaryzowane lub wykazywały odpowiedź dwufazową, a niektóre nie reagowały na egzogenną aplikację agonisty muskarynowego (Parra i in., 1998; McQuiston i Madison, 1999a). Co więcej, każdy typ odpowiedzi muskarynowej nie mógł być skorelowany z morfologicznym podtypem interneuronu. Wyniki te były dodatkowo komplikowane przez obserwację, że receptory muskarynowe mogą hamować uwalnianie GABA z podgrupy interneuronów hamujących okołosomatycznych (Behrends i Ten Bruggencate, 1993; Fukudome i in., 2004; Szabo i in., 2010), a aktywacja receptorów muskarynowych może zwiększać pobudliwość interneuronów poprzez generowanie depolaryzacji następczej (McQuiston i Madison, 1999b; Lawrence i in., 2006). Tak więc wpływ, jaki uwalnianie acetylocholiny wywiera na populację interneuronów, jest złożony i skutkuje rekrutacją niektórych interneuronów przy jednoczesnym hamowaniu innych.
Activation of Muscarinic Receptors in Hippocampal CA1 Interneurons Following Acetylcholine Release
Although cholinergic muscarinic synaptic responses were first measured in CA1 pyramidal neurons in 1983 (Cole and Nicoll, 1983), it was not until 2006 that muscarinic responses to electrically evoked acetylcholine release were measured in hippocampal CA1 inhibitory interneurons (Widmer et al., 2006). Badanie to wykazało, że uwalniana acetylocholina wywiera rozbieżny wpływ na różne podtypy interneuronów. Interneurony mogły reagować depolaryzacją, hiperpolaryzacją lub odpowiedzią dwufazową. Ogólnie rzecz biorąc, większość interneuronów reagowała depolaryzacją (64%), podczas gdy hiperpolaryzacja była rzadko obserwowana (13%) (Widmer i in., 2006). Ponadto, podobnie jak we wcześniejszych badaniach z zastosowaniem egzogennych agonistów muskarynowych (Parra i in., 1998; McQuiston i Madison, 1999a), różne typy elektrycznie wywołanych odpowiedzi muskarynowych nie mogły być skorelowane z określonymi podtypami anatomicznymi interneuronów (Widmer i in., 2006). Wyniki te zostały ostatnio potwierdzone w badaniach optogenetycznych wykorzystujących wywołane uwalnianie w odpowiedzi na aktywację światłem (Nagode i in., 2011; Bell i in., 2013). Jednak w jednym z tych badań optogenetycznych interneurony reagujące dwufazowo (25%), hiperpolaryzująco (35%) i depolaryzująco (40%) na reakcje muskarynowe były bardziej równomiernie rozłożone wśród różnych typów odpowiedzi (Bell i in., 2013). Co ważne, uwalniana optogenetycznie acetylocholina w przeważającej mierze wywoływała odpowiedzi muskarynowe (80%) vs. odpowiedzi nikotynowe (17%). Pozostałe 3% interneuronów reagowało zarówno na odpowiedzi muskarynowe, jak i nikotynowe. Co więcej, hiperpolaryzacje muskarynowe były mediowane przez aktywację receptorów M4, podczas gdy depolaryzacje były prawdopodobnie wytwarzane przez aktywację receptorów M3 (Bell i in., 2013). Podobnie jak w badaniach stymulacji elektrycznej, typ odpowiedzi muskarynowych nie mógł być skorelowany z anatomicznymi podtypami interneuronów. Co ważne, w obu badaniach wykazano, że perisomatycznie rzutujące interneurony (prawdopodobnie komórki koszyczkowe wykazujące ekspresję parvalbuminy) mogą odpowiadać na uwalnianie acetylocholiny każdym z trzech typów odpowiedzi muskarynowych (Widmer i in., 2006; Bell i in., 2013). W różnych badaniach optogenetycznych potencjał błonowy interneuronów CA1 był pośrednio oceniany poprzez pomiar częstotliwości sIPSC w neuronach piramidowych CA1 (Nagode i in., 2011, 2014). Optogenetycznie uwolniona acetylocholina powodowała wzrost sIPSC o dużej amplitudzie, których częstotliwość mieściła się w paśmie theta (4-12 Hz) (Nagode i in., 2011). Co ważne, ten wzrost sIPSCs mógł być hamowany przez endokannabinoidy, co sugeruje, że wynikał on z aktywacji interneuronów cholecystokininowo dodatnich (Nagode i in., 2011). Co więcej, na sIPSCs nie miała wpływu optogenetyczna supresja komórek parvalbumin positive, co sugeruje, że nie powstały one w wyniku aktywacji komórek koszyczkowych parvalbumin, interneuronów aksonalnych, bistratified lub oriens-lacunosum-moleculare (Nagode i in., 2014). Wyniki te są spójne z badaniami stymulacji synaptycznej, w których zarejestrowano z interneuronu o morfologii cholecystokininowej komórki koszyczkowej, który wytwarzał dwufazową odpowiedź na uwalnianie acetylocholiny (Widmer i in., 2006). Dlatego, opierając się tylko na wpływie na potencjał błonowy, endogennie aktywowane receptory muskarynowe na interneuronach CA1 hipokampa będą miały złożony wpływ na funkcję sieci (patrz Tabela 1).
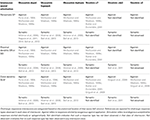
Tabela 1. Odpowiedzi cholinergiczne różnią się w podobnych i różnych anatomicznych podtypach interneuronów.
Chociaż różne typy odpowiedzi muskarynowych były niemal jednolicie obserwowane w interneuronach CA1, nie wszystkie typy odpowiedzi były równie łatwo wywoływane przez stymulację optogenetyczną (Bell i in., 2013). Zgodnie z niektórymi zapisami in vivo (Brazhnik i Fox, 1999), acetylocholina uwalniana z zakończeń cholinergicznych MS/DBB przez błyski niebieskiego światła dostarczane z częstotliwością 20 Hz była w stanie wywołać każdy typ odpowiedzi w interneuronach CA1 hipokampa (Bell i in., 2013). Jednak liczba błysków wpływała na prawdopodobieństwo zaobserwowania danego typu odpowiedzi. W interneuronach hiperpolaryzujących wystarczyło 10 błysków (91% interneuronów hiperpolaryzujących), aby zaobserwować odpowiedź. Z kolei w większości interneuronów depolaryzujących (58%) 10 błysków nie wystarczyło do wywołania odpowiedzi. Podobnie, faza depolaryzacji nie mogła być zaobserwowana w większości interneuronów dwufazowych (55%), gdy dostarczono tylko 10 bodźców. Hiperpolaryzacja muskarynowa może zatem wymagać mniejszej presynaptycznej aktywności cholinergicznej MS/DBB w porównaniu z odpowiedzią depolaryzacyjną w interneuronach CA1 hipokampa. Może być tak, że tłumienie pobudliwości interneuronów będzie dominującym efektem w odpowiedzi na niski poziom aktywności cholinergicznej MS/DBB.
Effects of Nicotinic Receptor Activation on Hippocampal CA1 Interneurons
Aktywacja receptorów nikotynowych w hipokampie ma znaczący wpływ na fizjologiczne i patofizjologiczne formowanie pamięci (Levin, 2002; Levin et al., 2002, 2009; Buccafusco et al., 2005; Davis i Gould, 2006, 2009; Nott i Levin, 2006; Davis et al., 2007). Spośród 11 różnych podjednostek receptorów nikotynowych występujących w OUN ssaków, 9 ulega ekspresji w neuronach CA1 hipokampa (Sudweeks i Yakel, 2000). Przy zastosowaniu egzogennych agonistów nikotynowych, funkcjonalne receptory nikotynowe, które zawierają α7 (Alkondon i in., 1997; Jones i Yakel, 1997; Frazier i in, 1998b; McQuiston i Madison, 1999c), α4β2 (McQuiston i Madison, 1999c; Sudweeks i Yakel, 2000) lub podjednostki α2 (McQuiston i Madison, 1999c; Sudweeks i Yakel, 2000; Jia i in., 2009) zostały zaobserwowane w interneuronach CA1 hipokampa. Chociaż interneurony hipokampa wydają się wyrażać różnorodny zbiór podtypów receptorów nikotynowych, receptory zawierające α7 były częściej obserwowane i dawały większe odpowiedzi (McQuiston i Madison, 1999c; Sudweeks i Yakel, 2000). Rzeczywiście, receptory nikotynowe α7 w hipokampie zostały powiązane z tworzeniem pamięci (Levin, 2002; Levin i in., 2002; Nott i Levin, 2006), a ich dysfunkcja może odgrywać rolę w niektórych formach schizofrenii (Freedman i in., 1994; Leonard i in., 1996; Adler i in., 1998). Jednakże, pomimo niższego poziomu ekspresji, receptory nikotynowe zawierające α4β2 odgrywają istotną rolę w tworzeniu pamięci (Davis i Gould, 2006; Davis i in., 2007) oraz w zależnym od hipokampa uzależnieniu od nikotyny (Perry i in., 1999; Davis i Gould, 2009). Receptory zawierające α4β2 zostały również skorelowane z deficytami poznawczymi związanymi ze starzeniem się i chorobą Alzheimera (Kellar i in., 1987; Wu i in., 2004; Gahring i in., 2005). Aby w pełni zrozumieć rolę, jaką różne podjednostki nikotynowe odgrywają w hipokampie, zaczęto badać wpływ endogennie uwalnianej acetylocholiny na poszczególne komórki hipokampa i sieć hipokampa.
Activation of Nicotinic Receptors in Hippocampal CA1 Interneurons Following Acetylcholine Release
Uwolnienie acetylocholiny z zakończeń cholinergicznych MS/DBB w hipokampie CA1 zostało wykazane w celu aktywacji receptorów nikotynowych na interneuronach (Alkondon i wsp., 1998; Frazier et al., 1998a; Stone, 2007). Nikotynowe pobudzające prądy postsynaptyczne (EPSCs) zostały po raz pierwszy zaobserwowane przy użyciu stymulacji elektrycznej i patch clampingu całokomórkowego w ostrych plasterkach mózgu szczura. Te nikotynowe EPSCs miały szybką kinetykę i były blokowane przez antagonistów receptora nikotynowego α7 (Alkondon i in., 1998; Frazier i in., 1998a), zgodnie z badaniami, w których agonistów receptora nikotynowego aplikowano bezpośrednio na ciała komórek interneuronów (Alkondon i in., 1997; Jones i Yakel, 1997; Frazier i in., 1998b; McQuiston i Madison, 1999c). Jednak nowsze badania optogenetyczne na plastrach mózgu myszy nie były w stanie odtworzyć tych wcześniejszych obserwacji (Bell i in., 2011). Zamiast tego, uwolniona optogenetycznie acetylocholina aktywowała przede wszystkim receptory nikotynowe, które zawierały podjednostki α4β2. Co więcej, odpowiedzi α4β2 były w większości podprogowe i miały bardzo wolną kinetykę. Dane te sugerują, że acetylocholina dyfunduje na znaczną odległość przed związaniem się z receptorami nikotynowymi zawierającymi α4β2 (McQuiston i Madison, 1999c; Bennett i in., 2012), co jest zgodne z transmisją objętościową lub niesynaptyczną (Vizi i in., 2010). Chociaż te małe odpowiedzi nikotynowe mogły się czasowo sumować, ich zdolność do pobudzania interneuronów była ograniczona przez presynaptyczną inhibicję muskarynową. Ponieważ odpowiedzi nikotynowe były w większości podprogowe, transmisja nikotynowa na interneurony CA1 może mieć głównie charakter modulacyjny. W badaniach optogenetycznych badano również odpowiedzi nikotynowe za pomocą obrazowania barwnika wrażliwego na napięcie (voltage-sensitive dye, VSD). Sygnały nikotynowe VSD zostały całkowicie zablokowane przez antagonistę receptora α4β2 DHβE i stwierdzono, że są one znacznie większe w dystalnym obszarze dendrytycznym neuronów piramidowych CA1, który pokrywa się z wejściami z kory entorhinalnej i nucleus reuniens wzgórza (Bell i in., 2011). Co ważne, ponieważ VSD wybarwia wszystkie elementy tkanki, dane VSD sugerują, że receptory nikotynowe zawierające α4β2 są najbardziej rozpowszechnionym receptorem pośredniczącym w depolaryzujących odpowiedziach nikotynowych w mysim hipokampie CA1. Warto zauważyć, że odpowiedzi nikotynowe mogą być wywołane przez pojedynczy błysk światła (Bell i in., 2011), co sugeruje, że uwalnianie acetylocholiny z zakończeń cholinergicznych MS/DBB może pomóc w rekrutacji interneuronów poprzez aktywację receptorów nikotynowych, zanim zostaną one dotknięte przez aktywację receptorów muskarynowych.
Effects of Acetylcholine Release on Hippocampal CA1 Network Function from the Perspective of the Interneuron Membrane Potential
Because CA1 inhibitory interneuron membrane potentials can be differentially modulated by both muscarinic and nicotinic receptor activation following acetylcholine release, the consequential effect on network function is undoubtedly complex. Aktywacja receptora muskarynowego może powodować różne i przeciwstawne efekty, nawet w obrębie tego samego interneuronu (patrz Tabela 1). Niestety, nasza wiedza na temat wpływu aktywacji receptorów muskarynowych i nikotynowych na poszczególne podtypy interneuronów pozostaje niepełna. Niemniej jednak, liczba bodźców wymaganych do wytworzenia każdego typu odpowiedzi różniła się w sposób spójny. Odpowiedzi nikotynowe były najłatwiejsze do wywołania i wymagały najmniejszej liczby bodźców (Bell i in., 2011), podczas gdy depolaryzujące odpowiedzi muskarynowe były najtrudniejsze do wytworzenia i wymagały największej liczby bodźców (Bell i in., 2013). Można zatem postawić hipotezę, że niski poziom aktywności neuronów cholinergicznych MS/DBB oraz niższe stężenia zewnątrzkomórkowej acetylocholiny sprzyjają aktywacji receptorów nikotynowych lub hiperpolaryzacji muskarynowej w specyficznych podgrupach interneuronów CA1.
Ponieważ muskarynowa hiperpolaryzacja interneuronów CA1 wymaga mniejszej presynaptycznej aktywności cholinergicznej, dezynhibicja (pośrednia aktywacja) komórek piramidowych hipokampa CA1 może być faworyzowana podczas niskich poziomów aktywności cholinergicznej MS/DBB (Figura 1B). Ponadto, postulując, że odpowiedzi nikotynowe preferencyjnie wpływają na interneurony, które selektywnie hamują inne interneurony (interneuron-selektywny lub IS), aktywacja receptorów nikotynowych może również powodować dezynhibicję neuronów piramidowych CA1 (Figura 1A). Łącznie, niski poziom aktywności cholinergicznej MS/DBB sprzyjałby dezynhibicji netto hipokampa CA1, pozwalając na większe prawdopodobieństwo wyjścia z neuronów piramidowych CA1. Zwiększone wyjście z CA1 może skutkować ułatwieniem przypominania sobie i konsolidacji pamięci w innych obszarach OUN, jak to ma miejsce podczas snu wolnofalowego (Gais i Born, 2004; Hasselmo i McGaughy, 2004). Z kolei wyższy poziom aktywności neuronów cholinergicznych MS/DBB w połączeniu z wyższym zewnątrzkomórkowym stężeniem acetylocholiny powoduje rekrutację różnych podgrup interneuronów, które odpowiadają poprzez depolaryzację muskarynową. Niektóre z tych depolaryzujących interneuronów mogą narzucać rytmiczne hamowanie neuronów piramidowych CA1 na częstotliwościach theta (Nagode i in., 2011, 2014), rytm sieci obserwowany podczas wyższych poziomów uwalniania acetylocholiny (Zhang i in., 2010). Skutkowałoby to hamowaniem wyjścia neuronu piramidowego CA1 hipokampa (częściowo rytmicznym) przy jednoczesnym ułatwianiu integracji synaptycznej w obrębie dendrytów komórek piramidowych CA1 hipokampa poprzez wpływ cholinergiczny na receptory glutamatergiczne i funkcję dendrytów (rysunek 1C) (Tsubokawa i Ross, 1997; Tsubokawa, 2000; Fernandez De Sevilla i Buno, 2010; Giessel i Sabatini, 2010). Istotnie, taka dynamiczna rola stężenia acetylocholiny w procesie uczenia się i tworzenia pamięci została wcześniej zaproponowana (Hasselmo, 2006; Hasselmo i Giocomo, 2006; Giocomo i Hasselmo, 2007; Hasselmo i Sarter, 2011). W tym schemacie niższe stężenie acetylocholiny pozwala na dominację wewnątrzhipokampowych (kolaterale Schaffera) interakcji synaptycznych, zwiększając w ten sposób wyjście z hipokampa CA1 i odzyskiwanie pamięci, podczas gdy wyższe stężenie acetylocholiny sprzyja przetwarzaniu wejść spoza hipokampa, pozwalając na przejściowe tworzenie się wspomnień w hipokampie CA1. Dlatego łączny efekt uwalniania acetylocholiny na wejścia glutamatergiczne i funkcję interneuronów może odgrywać ważną rolę w dostrajaniu hipokampalnej sieci CA1 do przypominania sobie lub tworzenia nowych wspomnień.

Figura 1. Hipoteza, że wejścia cholinergiczne MS/DBB albo tłumią, albo aktywują sieci interneuronowe w hipokampie CA1 w zależności od aktywności neuronów cholinergicznych. (A) Niski poziom aktywności cholinergicznej MS/DBB preferencyjnie aktywuje podzbiory interneuronów poprzez aktywację receptorów nikotynowych. Postulujemy, że interneurony napędzane przez nikotynę są interneuronami-selektywnymi (IS, żółty-aktywacja), które specyficznie hamują inne interneurony (niebieski). Zwiększenie ich aktywności powoduje zahamowanie neuronów piramidowych (P, żółta aktywacja i zwiększona produkcja). (B) Niski poziom aktywności cholinergicznej MS/DBB również hiperpolaryzuje podgrupy interneuronów poprzez aktywację receptorów muskarynowych (I, niebieski – tłumienie), co prowadzi do zahamowania neuronów piramidowych (P, żółty – aktywacja i zwiększona produkcja). (C) Zwiększenie aktywności neuronów cholinergicznych powoduje depolaryzację podzbiorów interneuronów przez aktywację receptorów muskarynowych (I, czerwona aktywacja, i zwiększone hamowanie synaptyczne), co skutkuje tłumieniem neuronów piramidowych (P, niebieskie tłumienie wyjścia).
Oświadczenie o konflikcie interesów
Autor oświadcza, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Acknowledgment
Ta praca była wspierana przez granty z NIMH/NIH 5R01MH094626 i 1R21MH103695.
Adler, L. E., Olincy, A., Waldo, M., Harris, J. G., Griffith, J., Stevens, K., et al. (1998). Schizophrenia, sensory gating, and nicotinic receptors. Schizophr. Bull. 24, 189-202. doi: 10.1093/oxfordjournals.schbul.a033320
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alkondon, M., Pereira, E. F., and Albuquerque, E. X. (1998). alpha-bungarotoxin- and methyllycaconitine-sensitive nicotinic receptors mediate fast synaptic transmission in interneurons of rat hippocampal slices. Brain Res. 810, 257-263. doi: 10.1016/S0006-8993(98)00880-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alkondon, M., Pereira, E. F., Barbosa, C. T., and Albuquerque, E. X. (1997). Neuronal nicotinic acetylocholine receptor activation modulates gamma-aminobutyric acid release from CA1 neurons of rat hippocampal slices. J. Pharmacol. Exp. Ther. 283, 1396-1411.
Pubmed Abstract | Pubmed Full Text
Atri, A., Sherman, S., Norman, K. A., Kirchhoff, B. A., Nicolas, M. M., Greicius, M. D., et al. (2004). Blockade of central cholinergic receptors impairment new learning and increases proactive interference in a word paired-associate memory task. Behav. Neurosci. 118, 223-236. doi: 10.1037/0735-7044.118.1.223
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Aznavour, N., Mechawar, N., and Descarries, L. (2002). Comparative analysis of cholinergic innervation in the dorsal hippocampus of adult mouse and rat: a quantitative immunocytochemical study. Hippocampus 12, 206-217. doi: 10.1002/hipo.1108
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barrenechea, C., Pedemonte, M., Nunez, A., and Garcia-Austt, E. (1995). In vivo wewnątrzkomórkowe zapisy przyśrodkowej przegrody i diagonalnego pasma neuronów Broca: związki z rytmem theta. Exp. Brain Res. 103, 31-40. doi: 10.1007/BF00241962
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Behrends, J. C., and Ten Bruggencate, G. (1993). Cholinergic modulation of synaptic inhibition in the guinea pig hippocampus in vitro: excitation of GABAergic interneurons and inhibition of GABA-release. J. Neurophysiol. 69, 626-629.
Pubmed Abstract | Pubmed Full Text
Bell, K. A., Shim, H., Chen, C. K., and McQuiston, A. R. (2011). Nicotinic excitatory postsynaptic potentials in hippocampal CA1 interneurons are predominantly mediated by nicotinic receptors that contain alpha4 and beta2 subunits. Neuropharmacology 61, 1379-1388. doi: 10.1016/j.neuropharm.2011.08.024
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bell, L. A., Bell, K. A., and McQuiston, A. R. (2013). Synaptic muscarinic response types in hippocampal CA1 interneurons depend on different levels of presynaptic activity and different muscarinic receptor subtypes. Neuropharmacology 73, 160-173. doi: 10.1016/j.neuropharm.2013.05.026
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bennett, C., Arroyo, S., Berns, D., and Hestrin, S. (2012). Mechanisms generating dual-component nicotinic EPSCs in cortical interneurons. J. Neurosci. 32, 17287-17296. doi: 10.1523/JNEUROSCI.3565-12.2012
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blake, M. G., Krawczyk, M. C., Baratti, C. M., and Boccia, M. M. (2014). Neuropharmacology of memory consolidation and reconsolidation: insights on central cholinergic mechanisms. J. Physiol. Paris. doi: 10.1016/j.jphysparis.2014.04.005.
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Blokland, A., Honig, W., and Raijmakers, W. G. (1992). Effects of intra-hippocampal scopolamine in a repeated spatial acquisition task in the rat. Psychopharmacology (Berl). 109, 373-376. doi: 10.1007/BF02245886
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brazhnik, E. S., and Fox, S. E. (1997). Intracellular recordings from medial septal neurons during hippocampal theta rhythm. Exp. Brain Res. 114, 442-453. doi: 10.1007/PL00005653
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brazhnik, E. S., and Fox, S. E. (1999). Action potentials and relations to theta rhythm of medial septal neurons in vivo. Exp. Brain Res. 127, 244-258. doi: 10.1007/s002210050794
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Buccafusco, J. J., Letchworth, S. R., Bencherif, M., and Lippiello, P. M. (2005). Long-lasting cognitive improvement with nicotinic receptor agonists: mechanisms of pharmacokinetic-pharmacodynamic discordance. Trends Pharmacol. Sci. 26, 352-360. doi: 10.1016/j.tips.2005.05.007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Buhler, A. V., and Dunwiddie, T. V. (2001). Regulation of the activity of hippocampal stratum oriens interneurons by alpha7 nicotinic acetylcholine receptors. Neuroscience 106, 55-67. doi: 10.1016/S0306-4522(01)00257-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Buzsaki, G. (2002). Theta oscillations in the hippocampus. Neuron 33, 325-340. doi: 10.1016/S0896-6273(02)00586-X
CrossRef Full Text
Buzsaki, G., and Wang, X. J. (2012). Mechanisms of gamma oscillations. Annu. Rev. Neurosci. 35, 203-225. doi: 10.1146/annurev-neuro-062111-150444
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cea-Del Rio, C. A., Lawrence, J. J., Erdelyi, F., Szabo, G., and McBain, C. J. (2011). Cholinergic modulation amplifies the intrinsic oscillatory properties of CA1 hippocampal cholecystokinin-positive interneurons. J. Physiol. 589, 609-627. doi: 10.1113/jphysiol.2010.199422
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cea-Del Rio, C. A., Lawrence, J. J., Tricoire, L., Erdelyi, F., Szabo, G., and McBain, C. J. (2010). M3 muscarinic acetylcholine receptor expression confers differential cholinergic modulation to neurochemically distinct hippocampal basket cell subtypes. J. Neurosci. 30, 6011-6024. doi: 10.1523/JNEUROSCI.5040-09.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cobb, S. R., and Davies, C. H. (2005). Cholinergic modulation of hippocampal cells and circuits. J. Physiol. 562, 81-88. doi: 10.1113/jphysiol.2004.076539
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Cole, A. E., and Nicoll, R. A. (1983). Acetylcholine mediates a slow synaptic potential in hippocampal pyramidal cells. Science 221, 1299-1301. doi: 10.1126/science.6612345
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davis, J. A., and Gould, T. J. (2006). The effects of DHBE and MLA on nicotine-induced enhancement of contextual fear conditioning in C57BL/6 mice. Psychopharmacology (Berl). 184, 345-352. doi: 10.1007/s00213-005-0047-y
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davis, J. A., and Gould, T. J. (2009). Hippocampal nAChRs mediate nikotine withdrawal-related learning deficits. Eur. Neuropsychopharmacol. 19, 551-561. doi: 10.1016/j.euroneuro.2009.02.003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Davis, J. A., Kenney, J. W., and Gould, T. J. (2007). Hippocampal alpha4beta2 nicotinic acetylocholine receptor involvement in the enhancing effect of acute nicotine on contextual fear conditioning. J. Neurosci. 27, 10870-10877. doi: 10.1523/JNEUROSCI.3242-07.2007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Deiana, S., Platt, B., and Riedel, G. (2011). The cholinergic system and spatial learning. Behav. Brain Res. 221, 389-411. doi: 10.1016/j.bbr.2010.11.036
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Dutar, P., Bassant, M. H., Senut, M. C., and Lamour, Y. (1995). The septohippocampal pathway: structure and function of a central cholinergic system. Physiol. Rev. 75, 393-427.
Pubmed Abstract | Pubmed Full Text
Easton, A., Douchamps, V., Eacott, M., and Lever, C. (2012). A specific role for septohippocampal acetylcholine in memory? Neuropsychologia 50, 3156-3168. doi: 10.1016/j.neuropsychologia.2012.07.022
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Fernandez De Sevilla, D., and Buno, W. (2010). The muscarinic long-term enhancement of NMDA and AMPA receptor-mediated transmission at Schaffer collateral synapses develop through different intracellular mechanisms. J. Neurosci. 30, 11032-11042. doi: 10.1523/JNEUROSCI.1848-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Frazier, C. J., Buhler, A. V., Weiner, J. L., and Dunwiddie, T. V. (1998a). Synaptic potentials mediated via alpha-bungarotoxin-sensitive nicotinic acetylcholine receptors in rat hippocampal interneurons. J. Neurosci. 18, 8228-8235.
Pubmed Abstract | Pubmed Full Text
Frazier, C. J., Rollins, Y. D., Breese, C. R., Leonard, S., Freedman, R., and Dunwiddie, T. V. (1998b). Acetylcholine activates an alpha-bungarotoxin-sensitive nicotinic current in rat hippocampal interneurons, but not pyramidal cells. J. Neurosci. 18, 1187-1195.
Pubmed Abstract | Pubmed Full Text
Freedman, R., Adler, L. E., Bickford, P., Byerley, W., Coon, H., Cullum, C. M., et al. (1994). Schizofrenia i receptory nikotynowe. Harv. Rev. Psychiatry 2, 179-192. doi: 10.3109/10673229409017136
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Freund, T. F., and Buzsaki, G. (1996). Interneurons of the hippocampus. Hippocampus 6, 347-470.
Pubmed Abstract | Pubmed Full Text
Fukudome, Y., Ohno-Shosaku, T., Matsui, M., Omori, Y., Fukaya, M., Tsubokawa, H., et al. (2004). Dwie odrębne klasy działania muskarynowego na synapsy hamujące hipokampa: M2-mediated direct suppression and M1/M3-mediated indirect suppression through endocannabinoid signalling. Eur. J. Neurosci. 19, 2682-2692. doi: 10.1111/j.0953-816X.2004.03384.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gahring, L. C., Persiyanov, K., and Rogers, S. W. (2005). Mouse strain-specific changes in nicotinic receptor expression with age. Neurobiol. Aging 26, 973-980. doi: 10.1016/j.neurobiolaging.2004.07.005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gais, S., and Born, J. (2004). Low acetylcholine during slow-wave sleep is critical for declarative memory consolidation. Proc. Natl. Acad. Sci. U.S.A. 101, 2140-2144. doi: 10.1073/pnas.0305404101
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Giessel, A. J., and Sabatini, B. L. (2010). M1 muscarinic receptors boost synaptic potentials and calcium influx in dendritic spines by inhibiting postsynaptic SK channels. Neuron 68, 936-947. doi: 10.1016/j.neuron.2010.09.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Giocomo, L. M., and Hasselmo, M. E. (2007). Neuromodulation by glutamate and acetylcholine can change circuit dynamics by regulating the relative influence of afferent input and excitatory feedback. Mol. Neurobiol. 36, 184-200. doi: 10.1007/s12035-007-0032-z
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Griguoli, M., Scuri, R., Ragozzino, D., and Cherubini, E. (2009). Activation of nicotinic acetylcholine receptors enhances a slow calcium-dependent potassium conductance and reduces the firing of stratum oriens interneurons. Eur. J. Neurosci. 30, 1011-1022. doi: 10.1111/j.1460-9568.2009.06914.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E. (2006). The role of acetylcholine in learning and memory. Curr. Opin. Neurobiol. 16, 710-715. doi: 10.1016/j.conb.2006.09.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E., and Giocomo, L. M. (2006). Cholinergic modulation of cortical function. J. Mol. Neurosci. 30, 133-135. doi: 10.1385/JMN:30:1:133
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E., and McGaughy, J. (2004). Wysokie poziomy acetylocholiny wyznaczają dynamikę obwodu dla uwagi i kodowania, a niskie poziomy acetylocholiny wyznaczają dynamikę dla konsolidacji. Prog. Brain Res. 145, 207-231. doi: 10.1016/S0079-6123(03)45015-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hasselmo, M. E., and Sarter, M. (2011). Modes and models of forebrain cholinergic neuromodulation of cognition. Neuropsychopharmacology 36, 52-73. doi: 10.1038/npp.2010.104
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jia, Y., Yamazaki, Y., Nakauchi, S., and Sumikawa, K. (2009). Alpha2 nikotynowe receptory funkcjonują jako molekularny przełącznik do ciągłego pobudzania podzbioru interneuronów w obwodach hipokampa szczura. Eur. J. Neurosci. 29, 1588-1603. doi: 10.1111/j.1460-9568.2009.06706.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jones, S., and Yakel, J. L. (1997). Functional nicotinic ACh receptors on interneurones in the rat hippocampus. J. Physiol. 504(Pt 3), 603-610. doi: 10.1111/j.1469-7793.1997.603bd.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kellar, K. J., Whitehouse, P. J., Martino-Barrows, A. M., Marcus, K., and Price, D. L. (1987). Muscarinic i nicotinic cholinergic binding sites in Alzheimer’s disease cerebral cortex. Brain Res. 436, 62-68. doi: 10.1016/0006-8993(87)91556-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kenney, J. W., and Gould, T. J. (2008). Modulation of hippocampus-dependent learning and synaptic plasticity by nicotine. Mol. Neurobiol. 38, 101-121. doi: 10.1007/s12035-008-8037-9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Klausberger, T., and Somogyi, P. (2008). Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science 321, 53-57. doi: 10.1126/science.1149381
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Larkum, M. E., Zhu, J. J., and Sakmann, B. (1999). A new cellular mechanism for coupling inputs arriving at different cortical layers. Nature 398, 338-341. doi: 10.1038/18686
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lawrence, J. J., Statland, J. M., Grinspan, Z. M., and McBain, C. J. (2006). Cell type-specific dependence of muscarinic signalling in mouse hippocampal stratum oriens interneurones. J. Physiol. 570, 595-610. doi: 10.1113/jphysiol.2005.100875
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Leonard, S., Adams, C., Breese, C. R., Adler, L. E., Bickford, P., Byerley, W., et al. (1996). Nicotinic receptor function in schizophrenia. Schizophr. Bull. 22, 431-445. doi: 10.1093/schbul/22.3.431
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levin, E. D. (2002). Nicotinic receptor subtypes and cognitive function. J. Neurobiol. 53, 633-640. doi: 10.1002/neu.10151
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levin, E. D., Bradley, A., Addy, N., and Sigurani, N. (2002). Hippocampal alpha 7 and alpha 4 beta 2 nicotinic receptors and working memory. Neuroscience 109, 757-765. doi: 10.1016/S0306-4522(01)00538-3
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Levin, E. D., Petro, A., Rezvani, A. H., Pollard, N., Christopher, N. C., Strauss, M., et al. (2009). Nicotinic alpha7- or beta2-containing receptor knockout: effects on radial-arm maze learning and long-term nicotine consumption in mice. Behav. Brain Res. 196, 207-213. doi: 10.1016/j.bbr.2008.08.048
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
McQuiston, A. R., and Madison, D. V. (1999a). Muscarinic receptor activity has multiple effects on the resting membrane potentials of CA1 hippocampal interneurons. J. Neurosci. 19, 5693-5702.
Pubmed Abstract | Pubmed Full Text
McQuiston, A. R., and Madison, D. V. (1999b). Muscarinic receptor activity induces an afterdepolarization in a subpopulation of hippocampal CA1 interneurons. J. Neurosci. 19, 5703-5710.
Pubmed Abstract | Pubmed Full Text
McQuiston, A. R., and Madison, D. V. (1999c). Nicotinic receptor activation excites distinct subtypes of interneurons in the rat hippocampus. J. Neurosci. 19, 2887-2896.
Pubmed Abstract | Pubmed Full Text
Miles, R., Toth, K., Gulyas, A. I., Hajos, N., and Freund, T. F. (1996). Differences between somatic and dendritic inhibition in the hippocampus. Neuron 16, 815-823. doi: 10.1016/S0896-6273(00)80101-4
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nagode, D. A., Tang, A. H., Karson, M. A., Klugmann, M., and Alger, B. E. (2011). Optogenetyczne uwalnianie ACh indukuje rytmiczne wybuchy perisomatycznych IPSCs w hipokampie. PLoS ONE 6:e27691. doi: 10.1371/journal.pone.0027691
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nagode, D. A., Tang, A. H., Yang, K., and Alger, B. E. (2014). Optogenetic identification of an intrinsic cholinergically driven inhibitory oscillator sensitive to cannabinoids and opioids in hippocampal CA1. J. Physiol. 592, 103-123. doi: 10.1113/jphysiol.2013.257428
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Nott, A., and Levin, E. D. (2006). Dorsal hippocampal alpha7 and alpha4beta2 nicotinic receptors and memory. Brain Res. 1081, 72-78. doi: 10.1016/j.brainres.2006.01.052
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Parra, P., Gulyas, A. I., and Miles, R. (1998). How many subtypes of inhibitory cells in the hippocampus? Neuron 20, 983-993. doi: 10.1016/S0896-6273(00)80479-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., and Kellar, K. J. (1999). Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552.
Pubmed Abstract | Pubmed Full Text
Pitler, T. A., and Alger, B. E. (1992). Cholinergiczne pobudzenie interneuronów GABAergicznych w wycinku hipokampa szczura. J. Physiol. 450, 127-142.
Pubmed Abstract | Pubmed Full Text
Power, A. E., Vazdarjanova, A., and McGaugh, J. L. (2003). Muscarinic cholinergic wpływy w konsolidacji pamięci. Neurobiol. Learn. Mem. 80, 178-193. doi: 10.1016/S1074-7427(03)00086-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Simon, A. P., Poindessous-Jazat, F., Dutar, P., Epelbaum, J., and Bassant, M. H. (2006). Firing properties of anatomically identified neurons in the medial septum of anesthetized and unanesthetized restrained rats. J. Neurosci. 26, 9038-9046. doi: 10.1523/JNEUROSCI.1401-06.2006
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Smiley, J. F., Morrell, F., and Mesulam, M. M. (1997). Cholinergic synapses in human cerebral cortex: an ultrastructural study in serial sections. Exp. Neurol. 144, 361-368. doi: 10.1006/exnr.1997.6413
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Stone, T. W. (2007). Kynurenic acid blocks nicotinic synaptic transmission to hippocampal interneurons in young rats. Eur. J. Neurosci. 25, 2656-2665. doi: 10.1111/j.1460-9568.2007.05540.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Storm-Mathisen, J. (1970). Quantitative histochemistry of acetylcholinesterase in rat hippocampal region correlated to histochemical staining. J. Neurochem. 17, 739-750. doi: 10.1111/j.1471-4159.1970.tb03344.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sudweeks, S. N., and Yakel, J. L. (2000). Funkcjonalna i molekularna charakterystyka neuronalnych nikotynowych receptorów ACh w neuronach CA1 hipokampa szczura. J. Physiol. 527(Pt 3), 515-528. doi: 10.1111/j.1469-7793.2000.00515.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Szabo, G. G., Holderith, N., Gulyas, A. I., Freund, T. F., and Hajos, N. (2010). Distinct synaptic properties of perisomatic inhibitory cell types and their different modulation by cholinergic receptor activation in the CA3 region of the mouse hippocampus. Eur. J. Neurosci. 31, 2234-2246. doi: 10.1111/j.1460-9568.2010.07292.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tang, A. H., Karson, M. A., Nagode, D. A., McIntosh, J. M., Uebele, V. N., Renger, J. J., et al. (2011). Nerve terminal nicotinic acetylcholine receptors initiate quantal GABA release from perisomatic interneurons by activating axonal T-type (Cav3) Ca(2)(+) channels and Ca(2)(+) release from stores. J. Neurosci. 31, 13546-13561. doi: 10.1523/JNEUROSCI.2781-11.2011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Teles-Grilo Ruivo, L. M., and Mellor, J. R. (2013). Cholinergic modulation of hippocampal network function. Front. Synaptic Neurosci. 5:2. doi: 10.3389/fnsyn.2013.00002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tsubokawa, H. (2000). Control of Na+ spike backpropagation by intracellular signaling in the pyramidal neuron dendrites. Mol. Neurobiol. 22, 129-141. doi: 10.1385/MN:22:1-3:129
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tsubokawa, H., and Ross, W. N. (1997). Muscarinic modulation of spike backpropagation in the apical dendrites of hippocampal CA1 pyramidal neurons. J. Neurosci. 17, 5782-5791.
Pubmed Abstract | Pubmed Full Text
Turrini, P., Casu, M. A., Wong, T. P., De, K. Y., Ribeiro-Da-Silva, A., and Cuello, A. C. (2001). Cholinergic nerve terminals establish classical synapses in the rat cerebral cortex: synaptic pattern and age-related atrophy. Neuroscience 105, 277-285. doi: 10.1016/S0306-4522(01)00172-5
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Umbriaco, D., Garcia, S., Beaulieu, C., and Descarries, L. (1995). Relational features of acetylcholine, noradrenaline, serotonin and GABA axon terminals in the stratum radiatum of adult rat hippocampus (CA1). Hippocampus 5, 605-620. doi: 10.1002/hipo.450050611
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Umbriaco, D., Watkins, K. C., Descarries, L., Cozzari, C., and Hartman, B. K. (1994). Ultrastructural and morphometric features of the acetylcholine innervation in adult rat parietal cortex: an electron microscopic study in serial sections. J. Comp. Neurol. 348, 351-373. doi: 10.1002/cne.903480304
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vizi, E. S., Fekete, A., Karoly, R., and Mike, A. (2010). Non-synaptic receptorów i transporterów zaangażowanych w funkcje mózgu i cele leczenia farmakologicznego. Br. J. Pharmacol. 160, 785-809. doi: 10.1111/j.1476-5381.2009.00624.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Widmer, H., Ferrigan, L., Davies, C. H., and Cobb, S. R. (2006). Evoked slow muscarinic acetylcholinergic synaptic potentials in rat hippocampal interneurons. Hippocampus 16, 617-628. doi: 10.1002/hipo.20191
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wu, J., Kuo, Y. P., George, A. A., Xu, L., Hu, J., and Lukas, R. J. (2004). beta-Amyloid bezpośrednio hamuje ludzkie receptory alfa4beta2-nicotinic acetylocholiny heterologicznie wyrażone w ludzkich komórkach SH-EP1. J. Biol. Chem. 279, 37842-37851. doi: 10.1074/jbc.M400335200
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhang, H., Lin, S. C., and Nicolelis, M. A. (2010). Spatiotemporal coupling between hippocampal acetylcholine release and theta oscillations in vivo. J. Neurosci. 30, 13431-13440. doi: 10.1523/JNEUROSCI.1144-10.2010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
.