A: Definindo a constante de acidez
Você está sem dúvida ciente de que alguns ácidos são mais fortes que outros. A acidez relativa de diferentes compostos ou grupos funcionais – em outras palavras, sua capacidade relativa de doar um próton a uma base comum sob condições idênticas – é quantificada por um número chamado de constante de acidez, abreviado Ka. A base comum escolhida para comparação é a água.
Consideraremos o ácido acético como nosso primeiro exemplo. Se fizermos uma solução diluída de ácido acético em água, uma reação ácido-base ocorre entre o ácido (doador de prótons) e a água (aceitador de prótons).
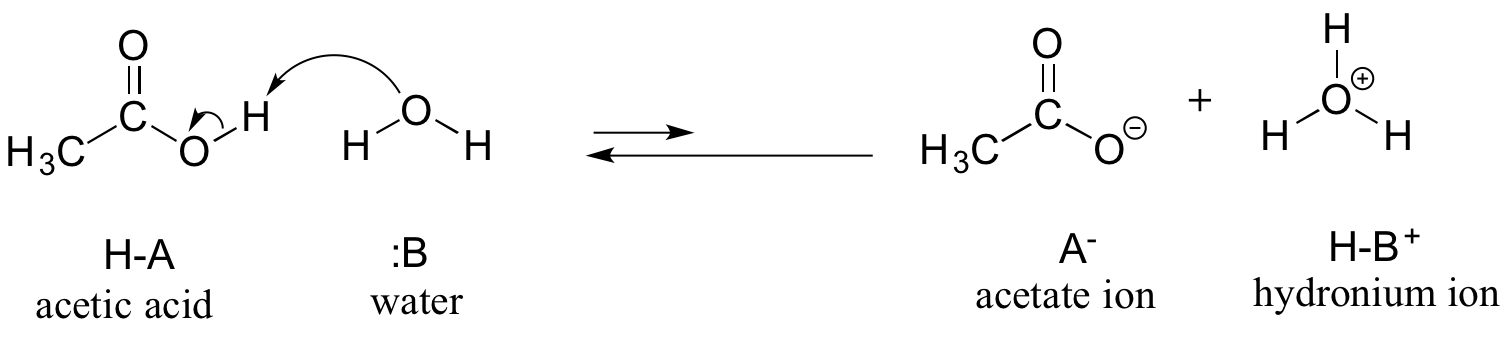
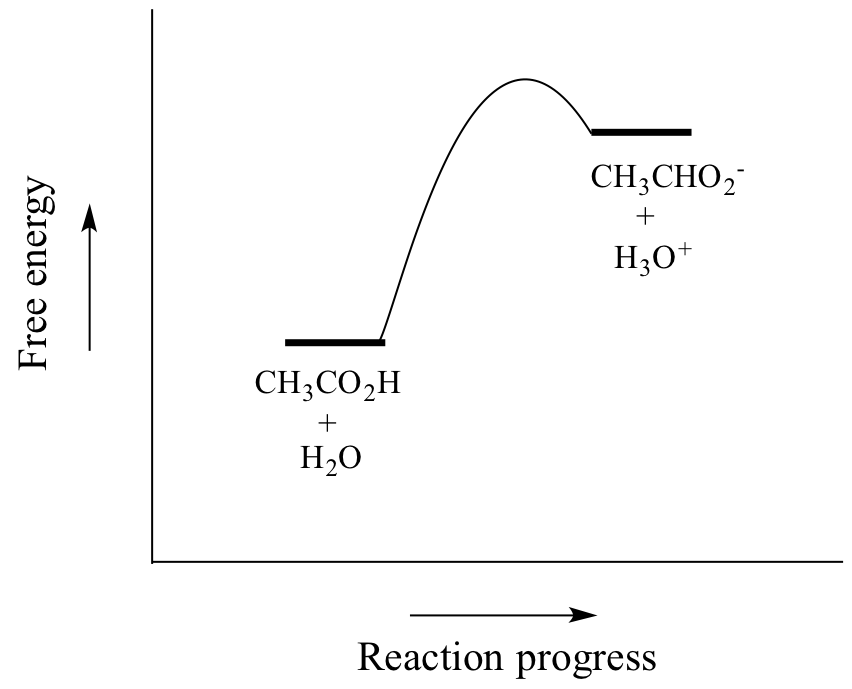
Ácido acético é um ácido fraco, portanto o equilíbrio favorece os reagentes em relação aos produtos – é termodinamicamente ‘ascendente’, como indicado na figura acima pelo comprimento relativo das setas de reação para frente e para trás, e no diagrama de coordenadas de reação abaixo no qual os produtos são mais energéticos do que os reagentes.
Como você sabe, a constante de equilíbrio Keq é definida como:
![]()
Todas as expressões da constante de equilíbrio são na verdade uma razão das atividades de todas as espécies envolvidas na reação. Para evitar o uso de atividades, e para simplificar as medições experimentais, a constante de equilíbrio de concentrações aproxima-se das atividades dos solutos e gases em soluções diluídas com suas respectivas molaridades. Entretanto, as atividades de sólidos, líquidos puros e solventes não são aproximadas com suas molaridades. Ao invés disso, essas atividades são definidas para ter um valor igual a 1 (um).
Assim, se reconhecermos que a atividade da água em uma solução diluída é aproximada com o valor de unidade (1), podemos dividir por 1 para obter a forma comum da expressão para Ka, a constante ácida para ácido acético:
\}{(1)} = \dfrac{}{}{} \]
De facto, para uma solução aquosa diluída, a actividade da água é aproximada ao valor 1, pelo que a constante genérica de dissociação para um dado ácido HA ou HB+ é expressa como:
>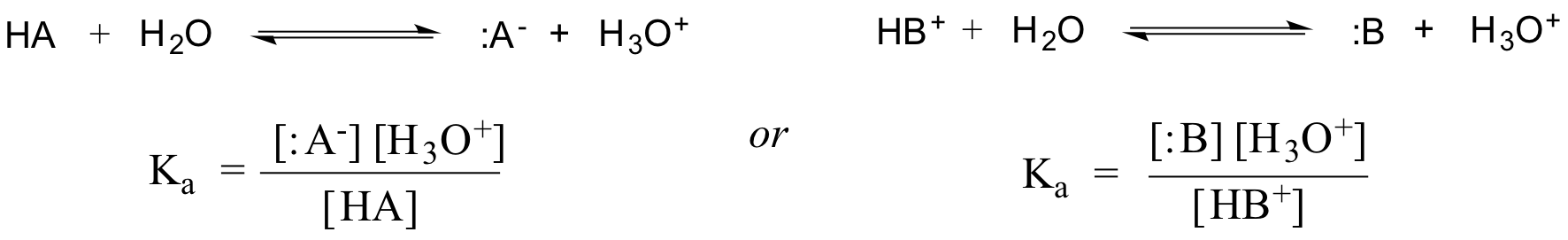
O valor de Ka para o ácido acético é 1.75 x 10-5 – muito menos que 1, indicando que há muito mais ácido acético em solução em equilíbrio do que os íons acetato e hidrônio.
Conversamente, ácido sulfúrico, com um Ka de aproximadamente 109, ou ácido clorídrico, com um Ka de aproximadamente 107, ambos sofrem essencialmente dissociação completa na água: são ácidos muito fortes.
Um número como 1,75 x 10- 5 não é muito fácil de dizer, lembrar, ou visualizar, então os químicos normalmente usam um termo mais conveniente para expressar a acidez relativa. O valor pKa de um ácido é simplesmente o log (base 10) do seu valor Ka.
pKa = -log Ka Ka = 10-pKa
Fazendo as contas, descobrimos que o pKa do ácido acético é 4,8. O pKa do ácido sulfúrico é -10, e do ácido clorídrico é -7. O uso de valores de pKa nos permite expressar a acidez relativa de compostos comuns e grupos funcionais em uma escala numérica de cerca de -10 (para um ácido muito forte) a 50 (para um composto que não é ácido de todo). Quanto menor o valor de pKa, mais forte o ácido.
Os grupos funcionais ionizáveis (prótons doando ou aceitando) relevantes à química orgânica biológica geralmente têm valores de pKa variando de cerca de 5 a cerca de 20. Os mais importantes estão resumidos abaixo, com valores de pKa muito aproximados para as formas ácidas conjugadas. Grupos mais ácidos com valores de pKa próximos de zero também estão incluídos para referência.
Aproximar valores de pKa para saber
hidrônio (H3O+) : 0
álcool protonado: 0
carbonilo protonado: 0
ácidos carboxílicos: 5
iminas protonadas: 7
aminas protonadas: 10
fenóis: 10
tióis: 10
água: 14
álcoois: 15-18
ácidos de alfa-carbono*: 20
*ácidos dealfa-carbono serão discutidos mais adiante neste capítulo
>
Recomendamos vivamente que você submeta estes valores aproximados à memória agora – então se você precisar de um valor mais preciso, você pode sempre procurá-lo em uma tabela pKa.
Cautela! pKa não é o mesmo que pH!
É importante perceber que pKa não é a mesma coisa que pH: o primeiro é uma propriedade inerente de um composto ou grupo funcional, enquanto o segundo é uma medida de concentração de íons de hidrônio em uma determinada solução aquosa:
pH = -log
A ciência dos valores de pKa não só nos permite comparar a força do ácido, como também nos permite comparar a força da base. A ideia chave a lembrar é a seguinte: quanto mais forte o ácido conjugado, mais fraca a base conjugada. Podemos determinar que o ião hidróxido é uma base mais forte que o amoníaco (NH3), porque o ião amónio (NH4+, pKa = 9.2) é um ácido mais forte que a água (pKa = 14.0).
Exercicio 7.2.1
Qual é a base mais forte, CH3O- ou CH3S-? Ião acetato ou amoníaco? Ião hidróxido ou ião acetato?
Solução
>
Vamos colocar o nosso entendimento do conceito pKa para usar no contexto de uma molécula mais complexa. Por exemplo, qual é a pKa do composto abaixo?
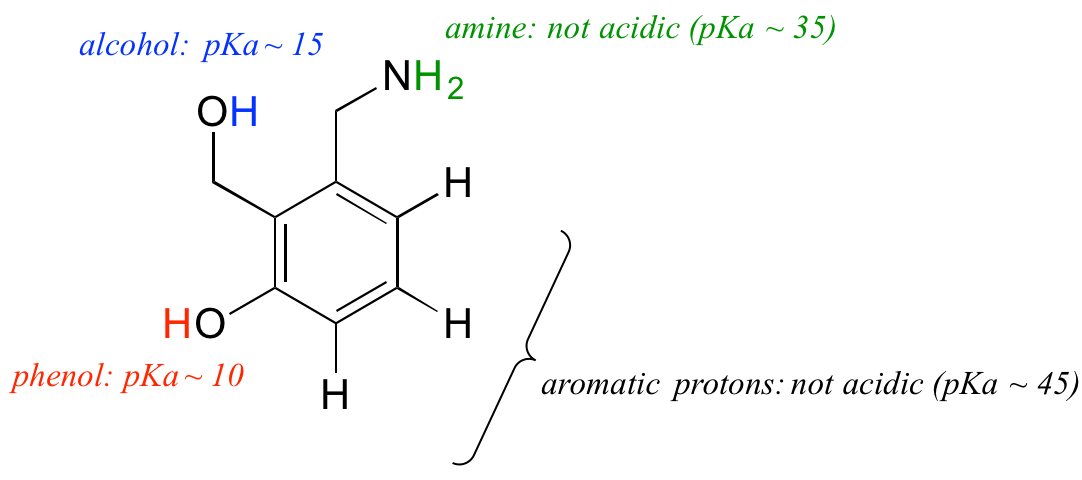
Precisamos avaliar a acidez potencial de quatro tipos diferentes de prótons na molécula, e encontrar o mais ácido. Os prótons aromáticos não são todos ácidos – a sua pKa é cerca de 45. O grupo das aminas também não é ácido, o seu pKa é cerca de 35. (Lembre-se, as aminas não carregadas são básicas: são aminas protonadas com carga positiva, com valores de pKa em torno de 10, que são fracamente ácidos). O próton do álcool tem um pKa de cerca de 15, e o próton do fenol tem um pKa de cerca de 10: assim, o grupo mais ácido na molécula acima é o fenol. (Tenha certeza de que você pode reconhecer a diferença entre um fenol e um álcool – lembre-se, em um fenol o grupo OH é ligado diretamente ao anel aromático). Se esta molécula reagir com um molar equivalente a uma base forte como o hidróxido de sódio, é o próton fenol que seria doado para formar um ânion fenolato.
Exercício 7.2.2
Identificar o grupo funcional mais ácido em cada uma das moléculas abaixo, e dar seu pKa aproximado.

Solução