A forma dos três orbitais 3p. Da esquerda para a direita: 3p, 3pz, e 3px. Para cada uma, as zonas amarelas são onde as funções de onda têm valores positivos e as zonas brancas denotam valores negativos.
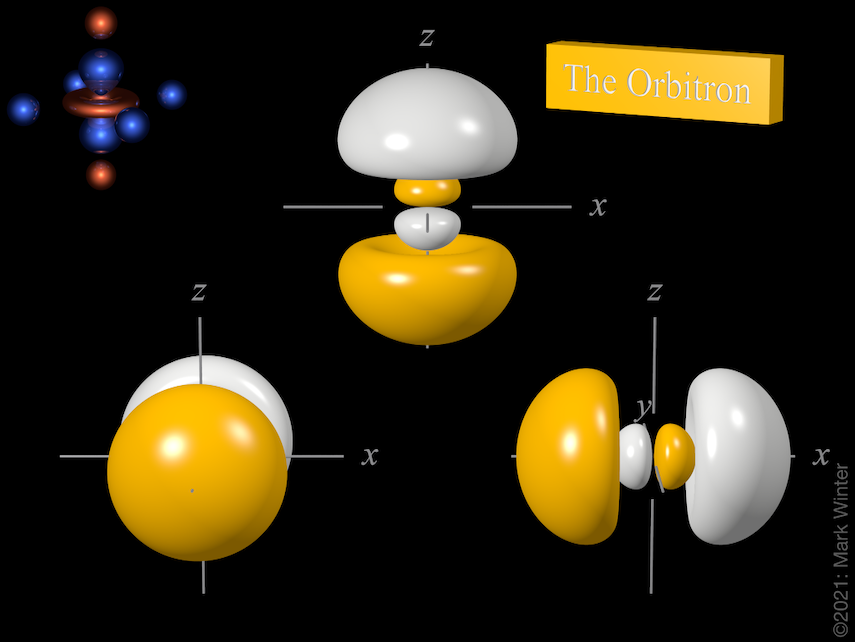
As três orbitais 3p. Use os ícones anterior e seguinte para ver outras vistas
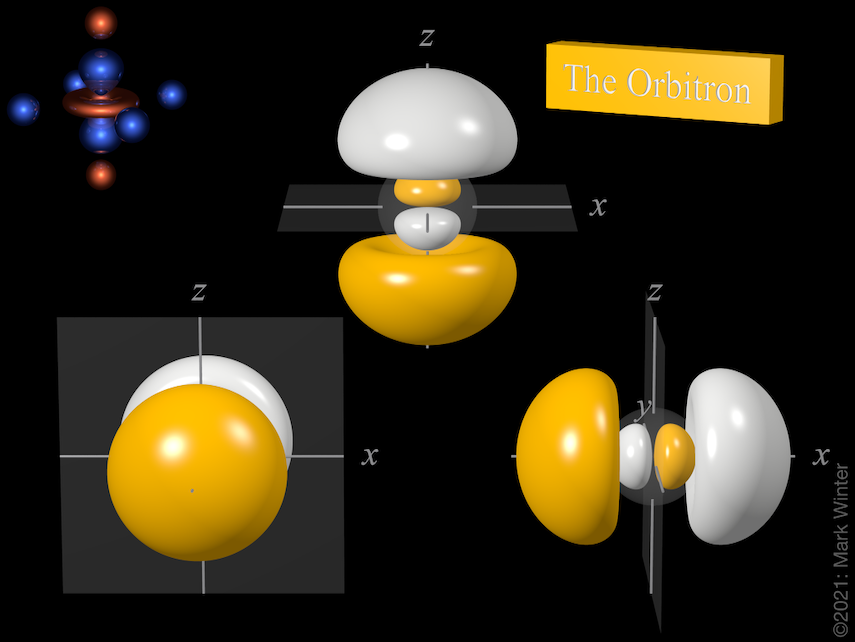
Os três orbitais 3p incluindo os nós orbitais. Use os ícones anterior e seguinte para ver outras vistas
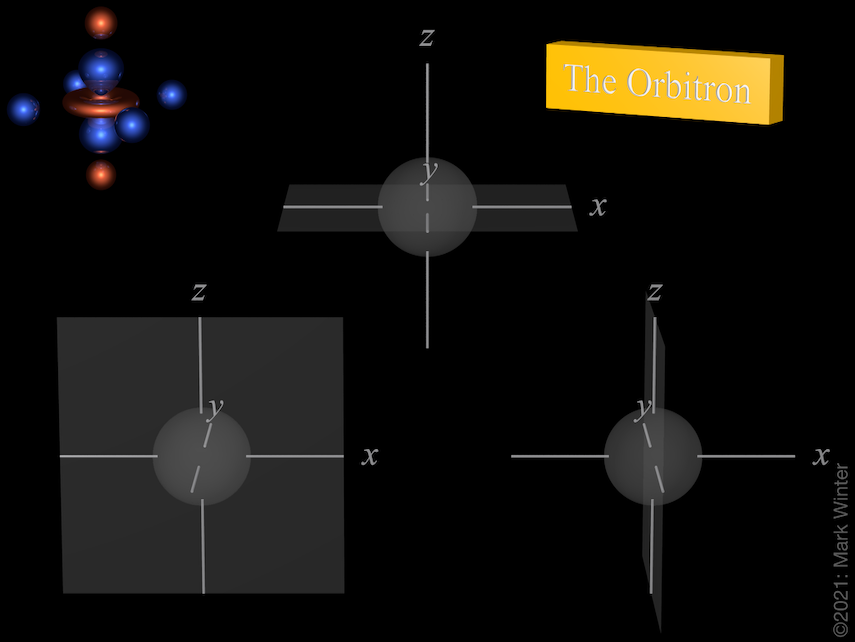
Nós dos três orbitais 3p. Use os ícones anterior e seguinte para ver outras vistas
Anterior
Para qualquer átomo, existem três orbitais 3p. Estas orbitais têm a mesma forma mas estão alinhadas de forma diferente no espaço. Os três orbitais 3p normalmente utilizados são rotulados como 3px, 3py e 3pz uma vez que as funções estão “alinhadas” ao longo dos eixos x, y e z respectivamente.
Cada orbital 3p tem quatro lóbulos. Existe um nó planar normal ao eixo do orbital (assim o orbital 3px tem um plano nodal yz, por exemplo). Além do nó planar há também um nó esférico que separa os pequenos lóbulos internos. Os maiúsculos p-orbitais (4p, 5p, 6p e 7p) são mais complexos ainda uma vez que eles têm mais nós esféricos.
A origem do nó planar torna-se clara ao inspecionar as equações da onda que, por exemplo, inclui um termo x no caso do orbital de 4px. Quando x = 0, então há um nó, e este por definição é o plano yz.
A origem do nó esférico se torna clara ao inspecionar as equações da onda que, por exemplo, incluem (4 – ρ) termos. Quando (4 – ρ) = 0, então há um nó. Como para qualquer orbital 3p ρ = 2Zr/3 (Z = carga nuclear efetiva, r = raio em unidades atômicas), então os nós estão no raio para que (4 – 2Zr/3) = 0, ou seja, r = 6/Z unidades atômicas.
The OrbitronTM, uma galeria de orbitais na WWW: https://winter.group.shef.ac.uk/orbitron/