A definição Brønsted-Lowry de acidez e basicidade
Comecemos nossa discussão da química ácido-base com algumas definições essenciais. A primeira delas foi proposta em 1923 pelo químico dinamarquês Johannes Brønsted e pelo químico inglês Thomas Lowry, e ficou conhecida como a definição Brønsted-Lowry de acidez e basicidade. Um ácido, pela definição Brønsted-Lowry, é uma espécie que atua como doador de prótons, enquanto uma base é um aceitador de prótons. Já discutimos no capítulo anterior um dos exemplos mais familiares de uma reação Brønsted-Lowry ácido-base, entre ácido clorídrico e íon hidróxido:
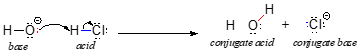
Nesta reação, um próton é transferido do HCl (o ácido, ou doador de prótons) para o íon hidróxido (a base, ou aceitador de prótons). Como aprendemos no capítulo anterior, setas curvas descrevem o movimento dos elétrons neste processo de quebra de ligação e formação de ligação.
Após um ácido Brønsted-Lowry doar um próton, o que resta é chamado de base conjugada. O íon cloreto é assim a base conjugada do ácido clorídrico. Pelo contrário, quando uma base Brønsted-Lowry aceita um próton, ele é convertido em sua forma de ácido conjugado: a água é assim o ácido conjugado do íon hidróxido.
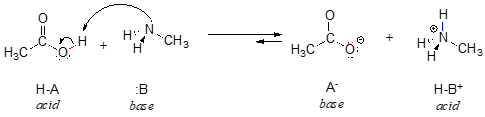
Há uma reacção ácido-base orgânica, entre ácido acético e metilamina:
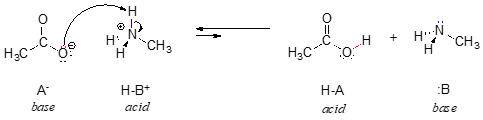
No reverso desta reacção, o ião acetato é a base e o ião metilamónio (metilamina protonada) é o ácido.
O que torna um composto ácido (susceptível de doar um próton) ou básico (susceptível de aceitar um próton)? Responder a essa pergunta é uma das nossas principais tarefas neste capítulo, e exigirá que utilizemos muito do que aprendemos sobre estrutura orgânica nos dois primeiros capítulos, assim como as idéias sobre termodinâmica que revisamos no capítulo 6.
Por enquanto, vamos considerar apenas uma propriedade comum das bases: para atuar como base, uma molécula deve ter um par de elétrons reativos. Em todas as reações ácido-base que vamos ver neste capítulo, a espécie básica tem um átomo com um par de elétrons solitário. Quando a metilamina actua como base, por exemplo, o par único de electrões sobre o átomo de azoto é usado para formar uma nova ligação a um próton.
Claramente, o ião metilamónio não pode actuar como base – não tem um par reactivo de electrões com o qual aceitar um próton.
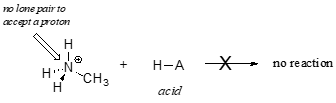
Later, no capítulo 14, vamos estudar reacções em que um par de electrões numa ligação de um alqueno ou anel aromático actua de uma forma básica – mas, por agora, vamos concentrar-nos na basicidade dos electrões sem ligação (par único).
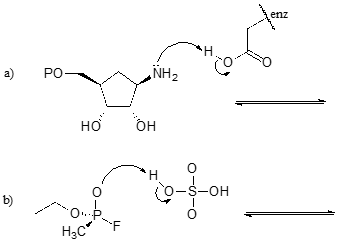
Exercício \(\PageIndex{1}})
Completar as reacções abaixo – por outras palavras, desenhar estruturas para os ácidos conjugados em falta e bases conjugadas que resultam das setas curvas fornecidas.