Definindo a constante de acidez
Você está sem dúvida ciente de que alguns ácidos são mais fortes que outros. A acidez relativa de diferentes compostos ou grupos funcionais – em outras palavras, sua capacidade relativa de doar um próton a uma base comum sob condições idênticas – é quantificada por um número chamado de constante de acidez, abreviado \\i(K_a). A base comum escolhida para comparação é a água.
Consideraremos o ácido acético como nosso primeiro exemplo. Se fizermos uma solução diluída de ácido acético em água, uma reação ácido-base ocorre entre o ácido (doador de prótons) e a água (aceitador de prótons).

Ácido acético é um ácido fraco, então o equilíbrio favorece os reagentes em relação aos produtos – é termodinamicamente ‘ascendente’. Isto é indicado na figura acima pelo comprimento relativo das setas de reação para frente e para trás.
A constante de equilíbrio \(K_{eq}}} é definida como:
}{} = \frac{}{}}
Lembrem-se que esta é uma solução aquosa diluída: adicionamos uma pequena quantidade de ácido acético a uma grande quantidade de água. Portanto, no decorrer da reação, a concentração de água (aproximadamente 55,6 mol/L) muda muito pouco, e pode ser tratada como uma constante.
Se movermos o termo constante para a concentração de água para o lado esquerdo da expressão da constante de equilíbrio, obtemos a expressão para \(K_a\), a constante ácida para o ácido acético:
\ = \frac{}{}]
Em termos mais gerais, a constante de dissociação para um dado ácido HA ou HB+ é expressa como:
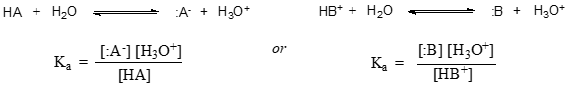
O valor de \(K_a\) para o ácido acético é \(1).75 ^{-5}) – muito menos do que ^(1), indicando que há muito mais ácido acético em solução em equilíbrio do que acetato e íons hidrogênio.
Conversamente, ácido sulfúrico, com um ácido sulfúrico de aproximadamente 10^9, ou ácido clorídrico, com um ácido clorídrico de aproximadamente 10^7, ambos sofrem essencialmente dissociação completa na água: são ácidos muito fortes.
Um número como ^(1.75 ^(1.75 ^10^{- 5}) não é muito fácil de dizer, lembrar, ou visualizar, então os químicos normalmente usam um termo mais conveniente para expressar a acidez relativa. O valor de um ácido é simplesmente o log (base 10) do seu valor.
Fazendo as contas, descobrimos que o valor de ácido acético é 4,8. O uso de valores de ácido sulfúrico é de -10, e de ácido clorídrico é de -7. O uso de valores de ácido clorídrico permite-nos expressar a acidez relativa de compostos comuns e grupos funcionais numa escala numérica de cerca de -10 (para um ácido muito forte) a 50 (para um composto que não é ácido de todo). Quanto mais baixo o valor \(pK_a\), mais forte o ácido.
Os grupos funcionais ionizáveis (prótons doando ou aceitando) relevantes para a química orgânica biológica geralmente têm valores que variam de cerca de 5 a cerca de 20. Os mais importantes destes estão resumidos abaixo, com valores muito aproximados para as formas ácidas conjugadas. Grupos mais ácidos com valores próximos de zero também estão incluídos para referência.
Típico \(pK_a\) valores
| grupo | aproximado \(pK_a\) |
|---|---|
| ião-hidrônio | 0 |
| álcool protonado | 0 |
| carbonilo protonado | 0 |
| Ácidos carboxílicos | 5 |
| iminas com botões | 7 |
| aminas com botões | 10 |
| fenóis | 10 |
| thiols | 10 |
| álcoois, água | 15 |
| (\alfa)-ácidos de carbono * | 20 |
**(\alfa)-ácidos de carbono serão explicados na secção 7.6A
É altamente recomendável que você coloque esses valores aproximados na memória agora – então se você precisar de um valor mais preciso, você pode sempre procurá-lo em uma tabela mais completa \(pK_a). O apêndice deste livro contém uma tabela mais detalhada de valores típicos \\(pK_a), e tabelas muito mais completas estão disponíveis em recursos como o Manual de Química e Física.
\(pK_a}) vs. \É importante perceber que o primeiro é uma propriedade inerente a um composto ou grupo funcional, enquanto o segundo é uma medida de concentração de íons de hidrônio em uma determinada solução aquosa:
\]
Saber os valores \(pK_a\) não só nos permite comparar a força ácida, como também nos permite comparar a força da base. A ideia chave a lembrar é a seguinte: quanto mais forte o ácido conjugado, mais fraca a base conjugada. Podemos determinar que o ião hidróxido é uma base mais forte que o amoníaco (NH_3), porque o ião amónio (NH4^++), { pK_a = 9.2\)) é um ácido mais forte que a água (\(pK_a = 15,7\)).
Exercício \(\PageIndex{1})
Qual é a base mais forte, \(CH_3O^-\) ou \(CH_3S^-\)? Íon acetato ou amoníaco? Ião hidróxido ou ião acetato?
Vamos colocar o nosso entendimento do conceito \\(pK_a) para usar no contexto de uma molécula mais complexa. Por exemplo, qual é o \(pK_a) do composto abaixo?

Precisamos avaliar a acidez potencial de quatro tipos diferentes de prótons na molécula, e encontrar o mais ácido. Os prótons aromáticos não são todos ácidos – o seu {\i1}(pK_a}) é cerca de 45. O grupo das aminas também não é ácido, o seu grupo (pK_a) é de cerca de 35. (Lembre-se, as aminas não carregadas são básicas: são aminas protonadas com carga positiva, com valores em torno de 10, que são fracamente ácidos). O próton do álcool tem um valor de cerca de 15, e o próton do fenol tem um valor de cerca de 10: assim, o grupo mais ácido na molécula acima é o fenol. (Tenha certeza que você pode reconhecer a diferença entre um fenol e um álcool – lembre-se, em um fenol o grupo do fenol está ligado diretamente ao anel aromático). Se esta molécula reagir com um molar equivalente a uma base forte como o hidróxido de sódio, é o próton de fenol que seria doado para formar um ânion fenolato.
Exercício \(\PageIndex{2})
Identificar o grupo funcional mais ácido em cada uma das moléculas abaixo, e dar o seu valor aproximado \(pK_a\).